人乳来源的外泌体microRNA及其靶标在HIV-1感染的母亲中的表达谱
人乳来源的外泌体microRNA及其靶标在HIV-1感染的母亲中的表达谱
尽管在感染HIV-1的母亲中使用了抗逆转录病毒疗法(ART),但每年仍约有5%的新HIV-1感染发生在母乳喂养的婴儿中,这为开发预防婴儿新HIV-1感染的新策略提供了保证。人乳(HM)外泌体高度富含microRNA(miRNA),它们在新生儿免疫中起重要作用。此外,已知来自健康供体的HM外泌体可抑制HIV-1的感染和传播。但是,HIV-1对HM外泌体miRNA信号的影响仍然未知。在这项研究中,我们使用nCounter NanoString技术并研究了HIV-1感染和未感染对照母亲(n = 36)在产后第一周HM外泌体中的miRNA表达谱。我们的结果表明,与健康对照组相比,HIV-1感染了HIV-1感染妇女中19个miRNA(13个上调和6个下调)的差异表达模式。DIANA-miR功能途径分析显示,涉及多种生物学途径,包括细胞周期,癌症途径,TGF-β信号传导,FoxO信号传导,脂肪酸生物合成,p53信号传导和凋亡。此外,对miR-630和miR-378g的接收器工作特性(ROC)曲线分析得出的ROC曲线下面积分别为0.82(95%CI 0.67至0.82)和0.83(95%CI 0.67至0.83)。用作识别女性HIV-1感染的生物标记。这些数据可能有助于开发预防HIV-1的母婴传播(MTCT)的新治疗策略。
介绍
令人震惊的统计数字表明,每年有110,000多名儿童死于与HIV-1 / AIDS相关的疾病,并且每个月有15,000多名儿童新感染HIV-1 1,这在目前约有4000万艾滋病毒感染者中占很大比例全世界-1 1,2。实际上,HIV-1的母婴传播(MTCT)是婴儿中HIV-1感染的重要来源,并且可能发生在子宫内,分娩过程中和通过母乳喂养。预防策略已将MTCT HIV传播的风险从35%降低到了5%以下;然而,由HIV-1阳性母亲母乳喂养的婴儿中的新HIV-1感染仍然是小儿HIV-1感染的主要来源。奇怪的是,促进母乳喂养,不管母亲表演HIV感染状况相比,婴儿谁是减少艾滋病毒垂直传播率的干预非纯母乳喂养1,3。造成这种现象的机制尚不清楚;但是,此处提供的数据可能会为潜在的预防和治疗策略提供新的见解,这些策略可能对未来的婴儿和成人都有用4。
更重要的出生HIV-1阳性妇女的婴儿最不受到感染自己,这是有可能归因于抗HIV-1的分子存在于人乳(HM)5,6。先前的工作表明特定的HM外泌体,而非血浆来源的外泌体,具有抑制HIV-1感染单核细胞衍生的树突状细胞(MDDC)并随后转移至CD4 + T细胞的保护作用。这些数据表明,HM衍生的外来体通过母乳喂养降低了HIV-1 MTCT的风险7。外来体是几乎存在于所有生物流体中的各种细胞分泌的纳米管腔内囊泡。此外,它们是专门在长距离胞间通讯和促进核酸如信使RNA(mRNA)和微RNA(miRNA),用于在靶细胞中高度调节的和有效的方式随后表达转印8,9。miRNA是小的,单链的,非编码,通过翻译抑制抑制靶基因表达的内源性的RNA 10,11,12,并且以此方式,起到不同的生物学过程,包括细胞增殖,分化和凋亡中起关键作用13。由于miRNA的在血浆,尿液,乳汁和其他体液存在14,它们具有很大的希望,作为在各种疾病,包括癌症有用的生物标记15,16,17,18,19,20,21,22,23,24。
鉴定在MTCT HIV-1感染中起重要作用的HM外泌体miRNA对我们对传播的理解至关重要。但是,尚无任何研究可以证明来自HIV-1感染妇女的HM外泌体的表达情况。在这里,我们调查了HIV-1相关miRNA在从HIV-1感染妇女收集的HM样品中的表达谱,并鉴定出总共19个miRNA(倍数变化> 1.3;P <0.05)在感染HIV-1的女性中差异表达,并靶向参与多种生物学途径的细胞基因,这些生物学途径包括细胞周期,癌症途径,病毒癌变,粘附连接,TGF-β信号传导,脂肪酸生物合成,p53信号传导和凋亡。此外,我们的数据表明,两个miRNA miR-630和miR-378g可以作为HIV-1感染的生物标记。综上所述,这些数据确定了重要的HM外泌体miRNA,可在未来的研究中用于监测受感染母亲的HIV-1状况以及它们在预防婴儿MTCT中的潜在作用。
材料和方法
人类主体
从尼日利亚高原州招募了未感染HIV-1的健康对照和感染HIV-1的妇女,以参加本研究。根据队列研究方案25,所有妇女均在其自愿的“健康”研究访问期间进行了抽样,因此在收集样本时未患严重疾病。参与研究的妇女在产后或产后不服用除ART或维生素补充剂以外的药物,并且未接受硬膜外产后。此外,如果妇女剖腹产或产后被诊断出患有乳腺炎,则将其排除在外。
样品采集和准备
HM样品在产后第一周,产后一,三个月和六个月内被自动收集到无菌试管中,并立即在冰上运输以在我们的实验室中进行处理。将样品分离成脂质,脱脂乳的上清液,和细胞级分并贮存于- 80℃和液氮,分别如前所述26,27。
从人乳中分离外泌体
根据制造商的建议(Thermo Fisher,加拿大),使用总外泌体分离试剂(从其他体液中)从脱脂乳上清液中分离外泌体。简而言之,将500 µl的每个HM样品以2000× g离心10分钟(第一次旋转)。在不破坏沉淀的情况下,将上清液转移至新试管中,并再次以10,000x g离心30分钟(第2次旋转)。将上清液转移至新管中,并以10,000x g离心10分钟(第3次旋转)。向澄清的上清液中,加入500 µl 1×PBS和500 µl外泌体分离试剂,涡旋混合并在室温下孵育30分钟。孵育后,将样品以10,000× g离心保持10分钟,小心除去上清液并丢弃。将沉淀中的外泌体溶解在50μl外泌体重悬缓冲液(加拿大,Thermo Fisher)中,涡旋混合,然后在室温下以10,000x g再次离心5分钟。在不干扰沉淀物中非有机颗粒物质的情况下,将含有纯化的HM外泌体的上清液转移至新试管中,并在– 20°C下保存,直至进一步使用。
透射电子显微镜(TEM)
HM衍生的外体形态通过TEM通过阴性染色进行了评估,如所述28。简而言之,将HM外泌体置于formvar网格上,用2.5%戊二醛固定,并与1%乙酸双氧铀对比,最后用位于McMaster Electron Microscopy设施的JOEL-1200EX透射电子显微镜观察。使用AMTV600计算机程序拍摄放大倍率为40,000××300,000的图像。
蛋白质印迹
如上所述,从HM样品中分离出外来体。分离蛋白质级分,使用DC™蛋白质测定试剂盒(Bio-Rad)进行定量,并在SDS-PAGE凝胶上电泳。如所描述的和HRP标记的山羊抗小鼠IgG 1706516(Bio-Rad公司)作为第二抗体;与初级抗体进行蛋白质印迹分析针对CD81(圣克鲁斯SC-166029)26,27。
外泌体RNA分离
按照制造商的说明(Invitrogen,Carlsbad,CA),使用总外泌体RNA和蛋白质分离试剂盒从HM外泌体中提取总RNA。简短地说,将分离的外泌体溶解在预热的2 x变性溶液中,然后进行酸-苯酚:氯仿萃取。用乙醇沉淀上层水相,并用预热的(95°C)洗脱缓冲液洗脱总RNA。使用Nanodrop分光光度计(Nanodrop Technologies,Inc,Wilmington,Germany)按照29中所述测定RNA的浓度,并将其保存在-80°C下直至进一步使用。
NanoString nCounter miRNA分析和数据分析
在处理NanoString芯片之前,先使用Agilent Bioanalyzer 2100和RNA 6000 Nano LabChip试剂盒(美国加利福尼亚州安吉伦)对RNA样品进行分析。未通过质量检查的RNA样品被排除在外,并替换为新的RNA样品,因此,仅对高质量的RNA进行了miRNA NanoString分析。使用nCounter Human ver 3.0 miRNA Panel在nCounter分析系统(NanoString Technologies)上进行了外泌体miRNA表达谱分析,如30所述。。总共同时运行三个盒装芯片,每个芯片包含12个样品(每个芯片9个HIV-1阳性对照和3个阴性对照)。为了进行数据分析,将HIV-1阳性和对照样品分开收集。生NanoString计数预处理和分类计数使用R包“轧边机”(PMID:19910308)导出描述29,31。简而言之,使用修整后的M值平均值(TMM)方法对计数进行归一化,并且去除了一半以上样品的,小于阴性对照探针几何平均值的miRNA;最终用于差异表达分析的miRNA计数为267。组间差异表达是使用函数fixTest计算的,该函数类似于Fisher的精确检验,但适用于过度分散的数据(PMID:19910308)。调整后的p值是使用Benjamini-Hochberg的方法控制错误发现率得出的。为了预测这些miRNA作为生物标志物的作用,针对前五个miRNA生成了接收者操作特征(ROC)曲线,并使用R包“ plotROC”计算了它们的曲线下面积(AUC)(P <0.001) 。
电子生物信息学分析
对于miRNA的功能分类,将DIANA-mirPath v3.0用于《京都议定书》的基因和基因组百科全书(KEGG)途径和基因本体论(GO)注释分析,如所述32。选择DIANA-Tarbase和“途径联合”选项,以使用该经过实验验证的目标数据库进行KEGG途径分析。对于GO分析,基于“类别联盟”的实验结果,进行了特定GO类别的miRNA的研究。使用修正的Fisher精确检验生成每个功能注释项的显着性,对于KEGG途径,P值阈值<0.05,对于GO分析,P值阈值<1e-20,分别描述了32。使用TarBase v8.0预测鉴定出的miRNA的候选靶基因33。非翻译区(UTR)的位置由TargetScan v7.2 34预测。为了鉴定HIV-1感染妇女的HM中差异表达的miRNA的潜在相互作用,使用Network Analyst软件 29对miRNA-mRNA网络进行了分析,其中miRNA与基因的相互作用数据是从诸如miRTarBase v7之类的注解数据库中收集的.0,TarBase v7.0和miRecords,如所述 35。对于程度,中间度和最短路径,选择了“除miRNA节点以外的所有节点”过滤器选项进行分析。
道德规范的批准和同意参加
从所有研究参与者处获得关于人口统计学,行为数据和生物学样本收集的书面和知情同意书。该研究得到了麦克马斯特研究伦理委员会(REB批准书编号08-176),洛杉矶儿童医院的CCI,曼尼托巴大学医院伦理审查委员会的机构审查委员会,马里兰大学巴尔的摩分校和高原州立专科医院的批准。尼日利亚机构审查委员会如前所述25,27。所有临床研究均根据《赫尔辛基宣言》的原则进行。
结果
女性参加者的临床特征
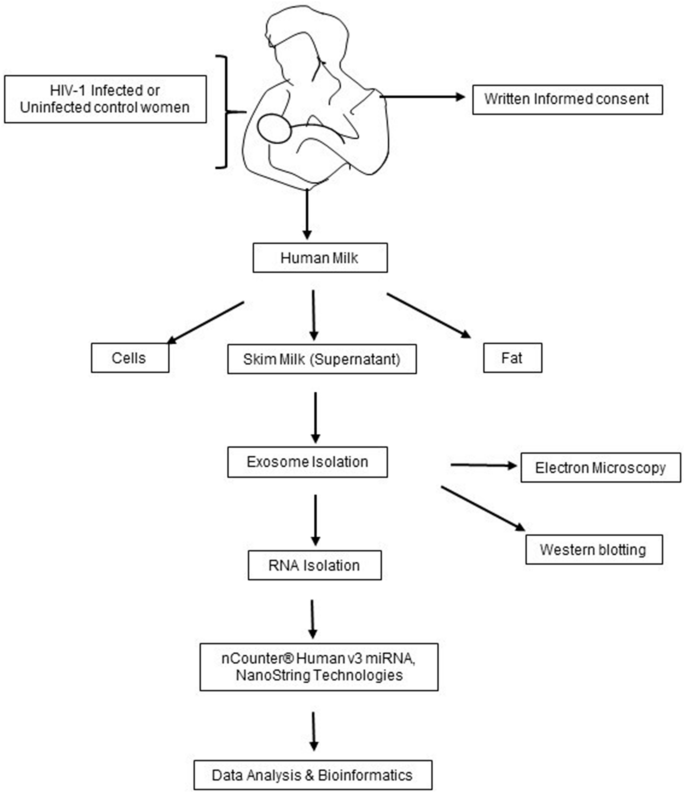
HIV-1感染和如先前所描述的未感染的妇女从高原州,尼日利亚招募27,36共有来自第一周产后36个HM样品(27 HIV-1阳性和9 HIV-1阴性作为对照)进行处理用于HM外泌体miRNA分析,如图1所示 。表1列出了当前分析中所包括的研究人群的特征。在27位HIV-1阳性母亲中,有22位在4-15年内感染了HIV-1,而5位女性仅在3年内感染了HIV-1。所有HIV-1阳性女性均按照尼日利亚政府和WHO 37制定的方案接受抗逆转录病毒疗法,且CD4 +计数≤300 / mm 3病毒载量无法检测。无法从未接受过ART-1治疗的HIV-1阳性女性中获得样本。计算妇女被诊断出HIV-1阳性并接受抗病毒治疗的那一天的抗病毒治疗年数。如表1所示,与未感染相比,22名HIV-1阳性妇女中有13名婴儿死亡率高。此外,发现HIV-1阳性妇女的婴儿发育迟缓且体重过轻,类似于先前描述的情况25。
牛奶外泌体表征和RNA质量检查
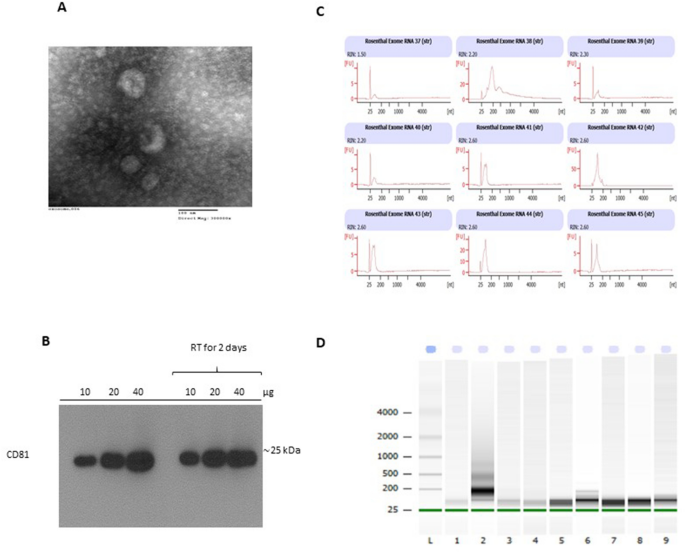
从单个HM样品中分离外来体并通过TEM确认。HM衍生的外泌体大小为30–100 nm,形状大致为球形(图 2 A)。在蛋白质印迹分析中,使用蛋白标记CD81确认了新鲜分离的HM衍生的外泌体或在室温下放置两天(图 2 B,图S1)。接下来,从HIV-1阳性和阴性HM样品中分离出外泌体RNA,平均产量为40 ng / µl。分离的RNA在> 25个核苷酸处显示出非编码RNA带的独特尖峰(图 2 C,D)。
从HIV-1感染妇女中鉴定HM衍生的外泌体miRNA
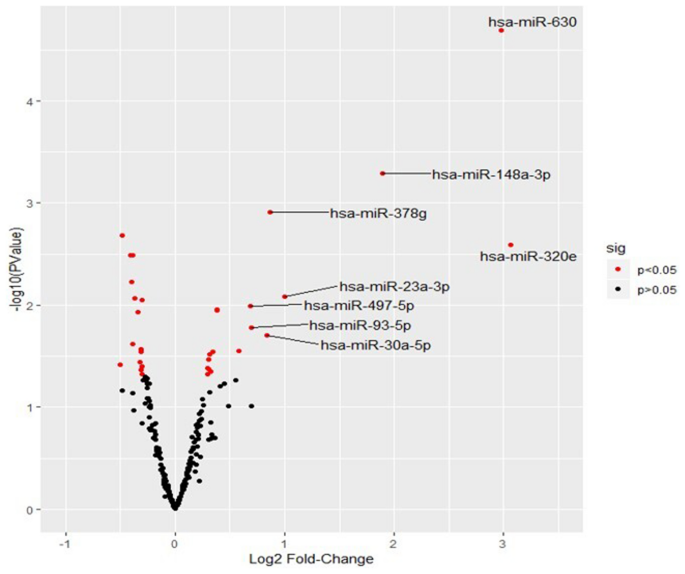
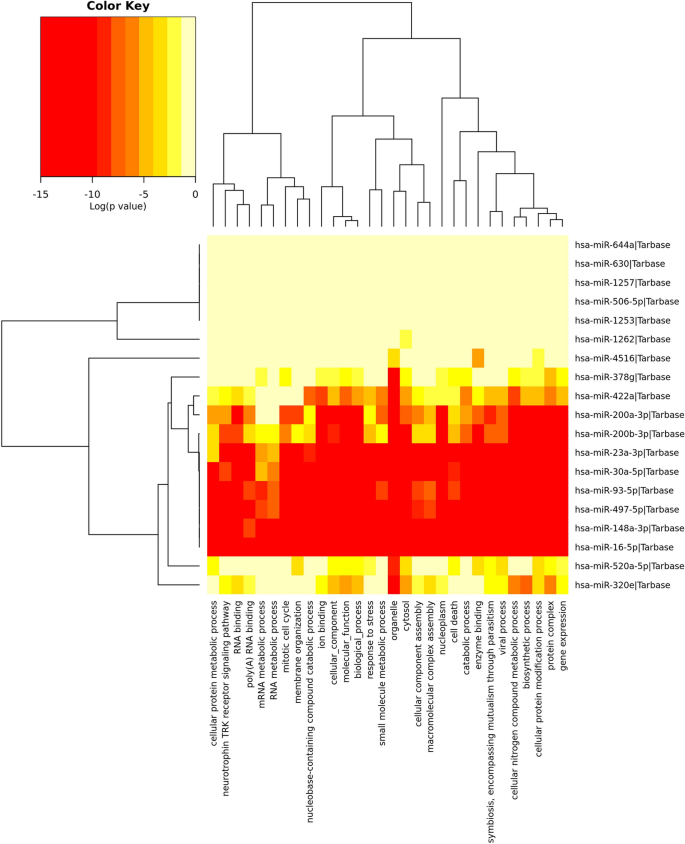
与阴性女性相比,HIV-1阳性的41个miRNA的表达有显着差异(图 3;P <0.05)。附表S1中显示了所有41种miRNA的完整列表。具体而言,包括hsa-miR-320e;mRNA,mRNA和mRNA的13种miRNA被显着上调(P <0.05; FC> 1.3;表2)。hsa-miR-630; hsa-miR-148a-3p; hsa-miR-23a-3p; hsa-miR-378g; hsa-miR-30a-5p; hsa-miR-93-5p; hsa-miR-497-5p; hsa-miR-200b-3p; hsa-miR-200a-3p; hsa-miR-16-5p; hsa-miR-1262和hsa-miR-4516。相反,与未感染的母乳(包括hsa-miR-422a)相比,在HIV感染的母乳中有6个miRNA下调;hsa-miR-644a; hsa-miR-520a-5p; hsa-miR-506-5p; hsa-miR-1257和hsa-miR-1253(表2)。进一步分析后,感染HIV-1 3和4-15岁的母亲分别显示了28个(分别上调18个; 10个下调)和17个(10个上调; 7个下调)差异调节的miRNA,其倍数变化无明显差异。 (补充表S2,S3)。从此处开始,从miRNA中删除了前缀hsa。
十大miRNA及其潜在靶基因
由于miRNA通过直接沉默和/或减少靶基因的表达而起作用,因此我们接下来使用一个特征明确的数据库(Tarbase v8.0)33预测前十个差异表达的miRNA的有效靶基因。我们的结果表明总共进行了19895次交互(表3)。发现miR-16-5p靶向最大数量的基因,包括IRF9,TLR4,TLR6和JUN。显示miR-630靶向BCL2,BCL2L11和YAP1。显示miR-378g靶向123个基因,包括SMAD2,CREBBP和WDR5。有趣的是,包括miR-320e和miR-148a-3p的多个miRNA靶向BCL2L11,miR-630和miR-497-5p均靶向BCL2L2。miRNA miR-30a-5p和miR-200b-3p靶向NOTCH1,而miR-378g,miR-497-5p和miR-16-5p靶向SMAD2(表3)。
GO和KEGG途径
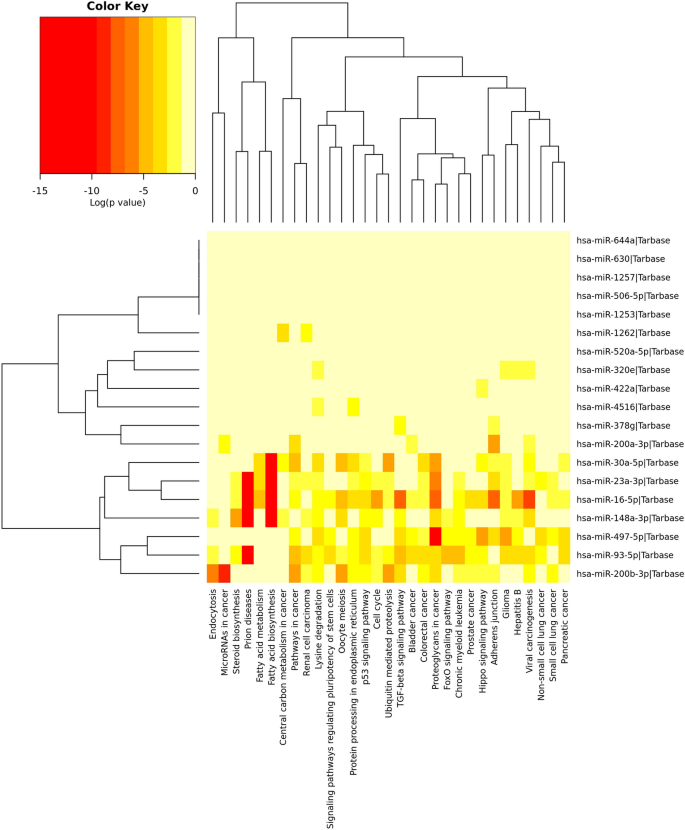
对预测靶标的KEGG途径分析导致鉴定了31条有效途径,其中丰富了预测的miRNA靶点(图 4)。具体来说,与HIV-1相关的miRNA靶标属于多种途径,例如癌症中的途径,病毒致癌,粘附连接,TGF-β,脂肪酸生物合成,p53信号传导,细胞周期,调节癌症中干细胞和蛋白聚糖多能性的途径(图 4)。接下来,我们进行了GO分析,以确定与miRNA相关的生物学过程。总共观察到30个GO生物学过程(图 5)。这些miRNA靶向的最高富集GO术语包括生物合成过程,随后的病毒过程,分解代谢过程,细胞死亡,离子结合,膜组织,有丝分裂细胞周期,RNA代谢过程,poly(A)RNA结合和Neurotropin TRK受体信号传导途径(图 5)。
miRNA-基因相互作用网络
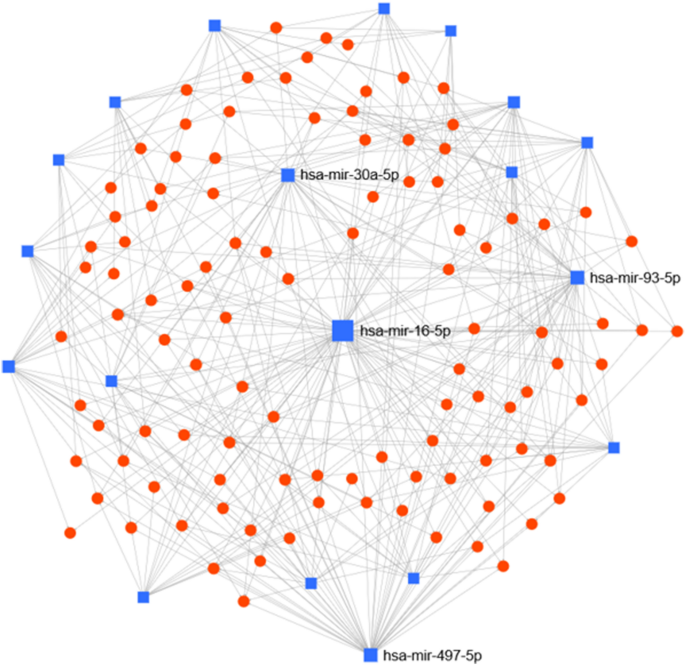
为了了解HIV-1感染的HM中差异表达的miRNA与其靶蛋白的关联,使用miRNet工具生成了miRNA-基因相互作用网络。将19个差异表达的miRNA上载到miRNet平台,观察到miRNA-基因相互作用,产生了4190个靶节点和6042个边缘。具有“除miRNA节点外的所有节点”的最短路径过滤器生成了124个具有105个目标和393个边缘的节点(图 6))。顶级集群中心包括miR-16-5p,其次是miR-497,miR-93-5p,miR-30a-5p和miR-23a-5p。使用“超几何测试”算法在“反应组数据库”中确定生物学功能,P值<0.05。结果显示,缺刻前转录和翻译(TP53,E2F3,AGO2,CCND1)是最主要的组,其次是有丝分裂G1 / S期(Wee1,CDK6,CDKN1A,E2F3,PSMD11,CCND1,CCNE2),细胞周期蛋白D相关事件G1(E2F3,CDK6,CDKN1A,CCND1),EGFR信号传导(EGFR,GRB2,HSP90AA1),细胞凋亡的内在途径(BCL2,XIAP,TP53,DYNLL2)和细胞周期(BIRC5,CCND1,CDK6,CDKN1A,CCNE2,WEE1, TP53,PSMD11,PAFAH1B1,HSP90AA1,E2F3,TAOK1,FOXM1,CSNK2A1)。总体而言,这些结果表明,HIV-1干扰的miRNA的靶基因属于多种生物途径。
miR-630和miR-378g作为HIV-1感染的生物标记
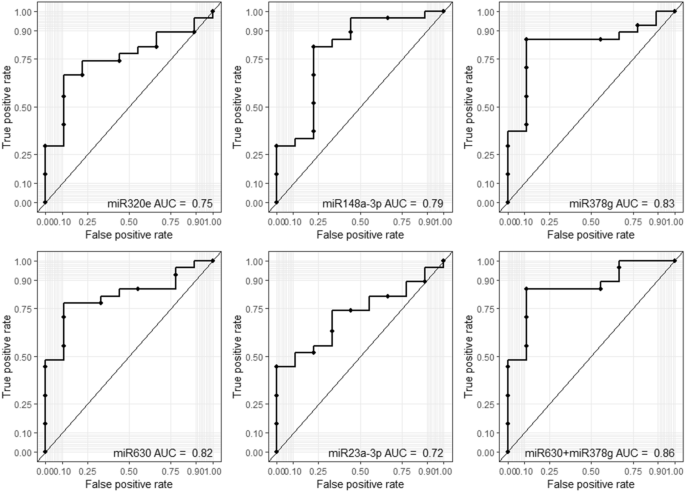
为了评估外泌体miRNA在HM中作为潜在诊断工具的实用性,我们对前5个miRNA进行了ROC曲线分析,以区分HIV-1感染妇女与健康对照。该分析表明,感染HIV-1的母乳中的miR-320e,miR148a-3p,miR-378g,miR-630和miR-23a-3p显着增加,并且ROC AUC值为0.75(95%CI为0.58至0.75)分别为0.79(95%CI 0.67至0.83),0.83(95%CI 0.67至0.83),0.72(95%CI 0.67至0.82)和0.72(95%CI 0.55至0.72)(图 7)。此外,将miR-630和miR-378g合并使用时,ROC AUC为0.86(95%CI为0.72至0.86)(图 7),表明miR-630和miR-378g可以作为区分HIV-1的生物标志物感染的HM来自非HIV-1感染的HM。
显示miR-378g介导的HIV-1反式激活因子(TAR)结合蛋白2(TARBP2)耗竭及其在HIV-1感染中的预测作用的示意图
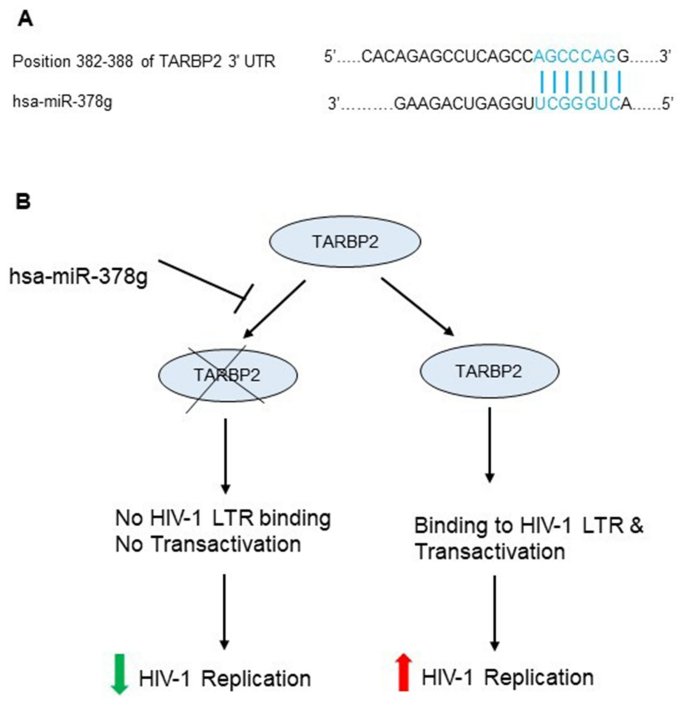
TargetScan通过搜索与每个mRNA 13的种子区匹配的保守的8聚体,7聚体和6聚体位点的存在来预测miRNA的靶标。使用搜索词HIV,我们确定了miR-378g在382至388的TARBP2(ENST 00000552857.1)的3'UTR中具有一个靶位点(图 8A)。众所周知,TARBP2可以促进HIV-1 LTR的表达和病毒产生,而其siRNA介导的敲低抑制HIV-1 LTR的表达和病毒产生55。假设布局的示意图如图 8 B所示,其中我们推测miR-378g介导的RNA干扰将降低HIV-1的表达和病毒的产生,基本上如先前所述56。
显示miR-378g介导的TARBP2耗竭和HIV-1复制抑制的示意图。(A)被miR-378g识别的人TARBP2的3'UTR的靶核苷酸序列(ENST00000552857.1),如由TargetScan v7.2可靠地注释。顶部显示预期的目标区域配对,底部显示miRNA-378g序列。(B)TARBP2,一种最初被鉴定为HIV-1 LTR(在5'和3'处都发现的反式激活因子)的结合伴侣的细胞蛋白,众所周知,一旦被宿主耗尽,它就会增强HIV-1的表达和病毒的产生细胞miR-378g可能会降低HIV-1的表达和病毒的产生55。
讨论区
HIV-1是已知的导致在细胞miRNA表达谱的剧烈变化57,58,59,60但是,其对HM衍生的外泌体miRNA的作用仍然未知。在这里,我们表征了源自HIV-1感染的HM的HM外泌体的miRNA表达谱,并表明HIV-1感染显着改变了外泌体miRNA的表达水平。通过基因本体论和基于KEGG通路的方法对差异表达的miRNA进行分析,发现几种生物过程均受HIV-1感染的影响。此外,我们鉴定了两个失调的miRNA,它们有可能将HIV-1阳性HM与未感染的HM区别开来,具有良好的预测能力。总的来说,这些数据首次首次全面了解了HIV-1感染期间涉及的HM外泌体miRNA谱。
我们的数据都及时给予外来体在HIV-1发病最近出现了新的球员在HIV-1感染,虽然他们的确切作用和传输不完全了解20,59。重要的是,外来体可能通过调节免疫应答,感染性或可能激活潜在的病毒库9在HIV-1发病机理的不同水平上起作用。实际上,已提出外来体对HIV-1的影响是治疗HIV-1感染和/或治疗的潜在策略61。目前,只有少数报告证明了HM衍生外泌体的免疫调节功能62,部分原因可能是其分离和纯化的方法学局限性8。。在这项研究中,我们提供了成功的HM外泌体分离方法,这将可能有助于与HM衍生的外泌体表征和机理相关的未来研究。
为了进一步了解HIV-1对HM衍生的外泌体miRNA的调控,我们进行了NanoString miRNA分析,并显示HIV-1干扰了19种miRNA的表达水平(FC> 1.3;P <0.05;表2)。此外,我们确定了31条可能受miRNA调控的KEGG途径,包括癌症中的途径,TGF-β,脂肪酸生物合成,FoxO信号传导,p53信号传导,细胞周期,调节癌症干细胞多能性和蛋白聚糖的途径。miRNA-mRNA网络显示差异表达的miRNA通过其靶基因相互连接。此外,除了细胞周期外,miRNA-mRNA网络分析还发现了凋亡和NOTCH和EGFR通路的参与。
两种miRNA(miR-630和miR-378g)的组合在预测HIV-1感染时具有86%的准确率,可作为将HIV-1阳性HM与未感染HM分离的生物标记。HM外泌体在室温下的稳定性也增加了它们在中低收入国家在HIV-1特异性血液检测之前的初始筛查过程中使用的可能性。感染HIV-1的3年和4-15年的母亲在miRNA表达水平上没有明显的倍数变化差异(附表S2,S3)。此外,参加该研究的大多数妇女携带HIV-1的时间超过5年(表1)。),因此建议将这两个miRNA用于监测HIV-1感染妇女的AIDS进展。确实,我们的发现与先前的研究一致,在该研究中,miR-630被报道为HIV-1 63慢性进展者的生物标志物。有趣的是,我们来自南非队列的HM外泌体miRNA数据显示,受HIV-1感染的妇女携带HIV-1负荷<1年(数据未显示),表明这些miRNA在本研究中被下调,并与最近的报道相关。研究表明,急性HIV-1导致miRNA的下调57。尽管如此,此处显示的miRNA数据可用于将来的研究,以进一步了解HIV-1的发病机理。
的miRNA被认为是参与介导免疫抑制,建立病毒潜伏的59,64或通过减小HIV-1的依赖因素抑制HIV-1复制65。有些我们已经确定了miRNA的先前牵连HIV-1感染包括的miR-630的miR-4516,的miR-16-5p,的miR-378,的miR-93的miR-23的miR-30A 57,63,66,67,68,69因此有力地表明了本研究中获得的NanoString数据的可靠性。此外,已经描述了NanoString可以以数字精度执行miRNA分析,并且结果不需要通过另一种方法70进一步验证。miRNA-630通过靶向BCL2,BCL2L2和IGF-1R 71引起细胞凋亡,或通过靶向多种调节剂72维持凋亡平衡。已显示miR-15a / b,miR-16,miR-20a,miR-93,miR-106b结合Pur-α并抑制其表达68。PUR-α是用于HIV-1的Tat的调节蛋白的蜂窝伙伴并促进其转录活性73,74和所需的HIV-1感染的巨噬细胞68,75。我们发现,Pur-α是HM外泌体miR-93-5p和miR-497-5p的靶标。HM外泌体miR-93-5p和miR-497-5p是否能降低巨噬细胞的R5嗜性HIV-1感染尚不清楚,但将在未来的研究中引起关注。
HM衍生的免疫调节因子是从母亲通过母乳的婴儿,其包括免疫球蛋白,细胞因子,趋化因子,生长因子,激素,乳铁蛋白,并转移Toll样受体26,27,76,77,78,79,80。TGF-β是在HM的主要细胞因子有利于R5向性HIV-1的优先母婴传播81,82。的miR-378克,的miR-16-5p和miR-497-5p发现靶向SMAD2先前已经显示介导TGF-β和调节多种途径,如细胞增殖,凋亡和细胞分化81,83。热灭活和蛋白水解消化后的HIV-1阳性人类脱脂乳馏分保留了HIV-1抑制活性,并被证明可以显着抑制口服HIV-1在体内的传播3。由于已知HM外泌体miRNA到达体循环62,这些数据表明本文报道的HM衍生的含miRNA的外泌体可能通过母乳到达胎儿全身循环,并在降低HIV-1 7的 MTCT中起重要作用。需要进一步的研究来阐明这些HM外泌体miRNA的功能作用。
使用共识评分方法,已显示miR-378靶向HIV-1包膜基因67。根据miRbase数据库(www.mirbase.org),mir-378家族由11个成熟的miRNA成员组成,包括miR-378a-5p,miR-378a-3p,miR-378b,miR-378c,miR-378d,miR-378e ,miR-378f,miR-378g,miR-378h,miR-378i和miR-378j;但是,这项研究是第一个表明miR-378g参与HIV-1感染的研究。此外,预测分析表明miRNA的-378克目标(图位于3'382至388个核苷酸的TARBP2 UTR部位 8),这是需要对于HIV-1的表达和病毒粒子产生55,84。有趣的是,由于内源性TARBP2 85水平低,星形胶质细胞对HIV-1感染具有抗性。TARBP2最初被鉴定为一种蛋白质结合保守TAR元件59个核苷酸发现在5'和3'的所有HIV-1转录物的端部并增强其翻译和复制56,84,86。此外,还发现miR-378g靶向人类HIV-1增强子结合蛋白3(HIVEP3)(ENST00000372583.1)3'UTR中4个可靠注释的位点,分别位于582-588、2026-2032、2208-2214和2580–2586个核苷酸(数据未显示)。尽管尚不清楚HIVEP3在HIV-1复制中的作用,但已知通过miRNA靶向HIVEP2可以减少HIV-1复制87。在未来的研究中必须研究miR-378g对HIV-1复制和MTCT的影响。
与HIV-1相关的神经系统疾病(HAND)发生在25%以上感染AIDS的HIV-1感染患者中88。以前,miR-4516已被证明是HIV-1感染患者中HAND的生物标志物66。我们的数据显示,在感染HIV-1的HM中,miR-4516在4到15年内被上调,这可能表明感染HIV-1的妇女是没有HAND症状的女性或已经患上HAND的女性。尽管我们的临床数据未收集到这些受感染妇女的任何神经系统症状,但在未来的研究中监测miR-4516的免疫状态以及时间表达模式将非常有趣。
总之,这些数据是第一个表征HM外泌体miRNA在HIV-1感染的HM中表达的特征。鉴于在HIV-1阳性母亲中使用目前的ART并不能完全缓解HIV-1的MTCT,因此可能需要采取干预措施,包括在可用的ART之外使用外泌体miRNA来预防婴儿的HIV-1新感染。在这种情况下,我们详细描述HM外泌体miRNA的数据可能会被用来降低MTCT HIV-1的传播。而且,本文报道的miRNA可以充当HIV-1感染的HM的潜在生物标记。
资料可用性
本研究报告和分析的数据集可在NCBI基因表达综合库(GEO)中找到,并可通过GEO系列登录号GSE143039进行访问。
|
|