饮食诱发肥胖大鼠血小板分析:肥胖时血小板功能紊乱
摘要
肥胖是工业化国家的主要健康问题之一。肥胖中发展的多种因素的贡献很难在体外建模。在这种情况下,模仿人类肥胖的动物模型的发展可能至关重要。本研究的目的是将饮食诱发肥胖症(DIO)大鼠模型的血小板与其瘦对照组进行比较,以阐明肥胖症中的血小板功能障碍机制,并将结果与病态肥胖患者的先前数据相关联。同时,我们还建立了采血和血小板分离方法,以在生化和功能水平上研究DIO大鼠模型。从腔静脉获得最佳血液收集,并基于一系列避免血小板活化的离心分离血小板。我们的结果表明,DIO大鼠模型在病理上模拟肥胖,因为肥胖大鼠的体重增加,空腹血糖和血小板计数增加。有趣的是,Src(pTyr419)显示出DIO大鼠增加的趋势,指出肥胖症中Src家族激酶相关的信号传导途径中的潜在功能障碍。此外,与对照组相比,来自DIO大鼠的血小板与胶原蛋白的粘附性更高,这表明糖蛋白VI(GPVI)是肥胖中失调的受体之一。这些结果证实,与人类研究一致,肥胖症会引起血小板功能异常,并突出说明在这些患者(例如GPVI)中考虑使用新型抗血栓药物靶标的相关性。
介绍
全球肥胖病流行是工业化国家中最大的健康问题之一。众所周知,与肥胖相关的改变构成了几种疾病的相关危险因素,包括糖尿病,癌症,关节炎,高血压和心血管疾病(CVD)。事实上,肥胖与CVD之间的联系已被反复报道,其中慢性暴露于肥胖者的促炎和促血栓形成状态,其中血小板起关键作用1。此外,最近的研究描述血小板过度活化和灵敏度降低的致病作用于肥胖antiaggregating治疗1。然而,肥胖诱发血小板功能障碍的确切机制仍未得到充分研究2。
肥胖中发展的多种因素的贡献很难在体外建模,这就是为什么使用动物模型对此至关重要的原因。虽然动物模型无法彻底复制人类肥胖症,但它们是开发预防和治疗病理的新治疗方法的有力工具。在过去的20年中,许多小组采用了既定的动物模型,饮食诱发的肥胖(DIO)模型,以了解肥胖的发展和持续性以及超重所伴随的代谢并发症3。为了执行该模型,大鼠在数周内接受高脂饮食(脂肪含量超过40%),导致肥胖,高血糖,高甘油三酯血症和高瘦素血症。今天,这种动物模型被认为是模仿人类肥胖症和代谢综合征4的病理生理最广泛使用的模型之一。不过,也有只有调查血小板功能障碍的肥胖大鼠模型的最新研究很少5,6,7,8。在这种情况下,本研究的第一个目标是建立大鼠采血和血小板分离的标准化方案,以实现研究实验室之间的数据比较,并将研究结果转移至人类临床研究中。
我们最近进行了一些研究,从病态肥胖患者血小板,他们与他们的精益匹配的对照,我们发现,Src家族激酶(SFKs)信号通路,特别是糖蛋白VI(GPVI)在肥胖的改变比较9,10。符合以上所述,本研究的第二个目标是表征肥胖对DIO大鼠血小板的影响,并尝试将其生化参数与我们先前在人体中获得的参数相关联。这样,动物模型和我们先前的临床数据都将经过交叉验证,从而有助于阐明肥胖症中的血小板功能障碍。
结果
DIO大鼠模型模仿肥胖的病理特征
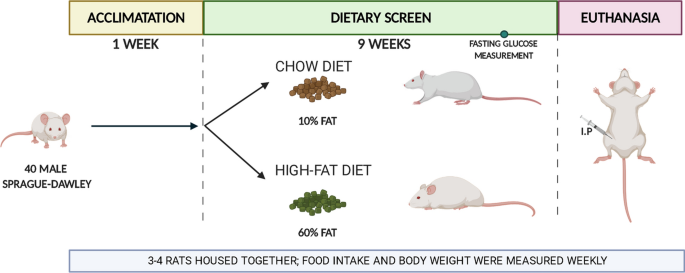
在1周的基线期内,向40只成年Sprague–Dawley大鼠提供免费的标准饮食(10%脂肪)。在此阶段之后,将它们随机分为两个实验组(每组n = 20):用标准饮食或HFD喂养9周(图 1)。
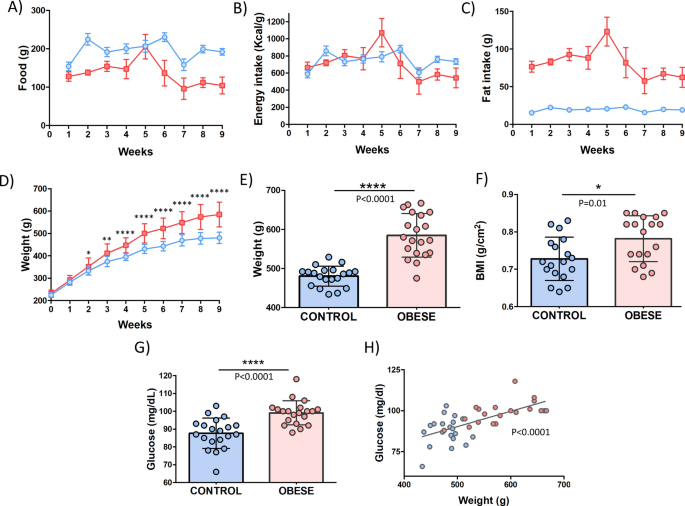
在DIO大鼠和瘦型匹配的对照组在自由进食时的膳食期间(9周)(图饲喂 2一个)。在能量摄入而言,被基团(图之间没有发现差异 2 B)。有趣的是,脂肪摄入的DIO组中的量的程序(图的第5周后降低 2 ℃)。
正如所料,HFD的程序(图中与对照组相比时产生的显著增加体重 2 d)。在不同饮食方式的9周后,DIO组的体重分布存在显着差异(图 2 e,f)。此外,还测量了其他与肥胖相关的发病机制有关的人体测量参数。该数据表明,DIO大鼠模型与其瘦交配组相比具有更多的胸围和腹围(表1)。此外,还对空腹血糖进行了测试,结果显示HDF饲料模型中的空腹血糖水平较高,并且与最终体重呈正相关(图 2 g,h)。
建立研究大鼠血小板的血小板分离方法
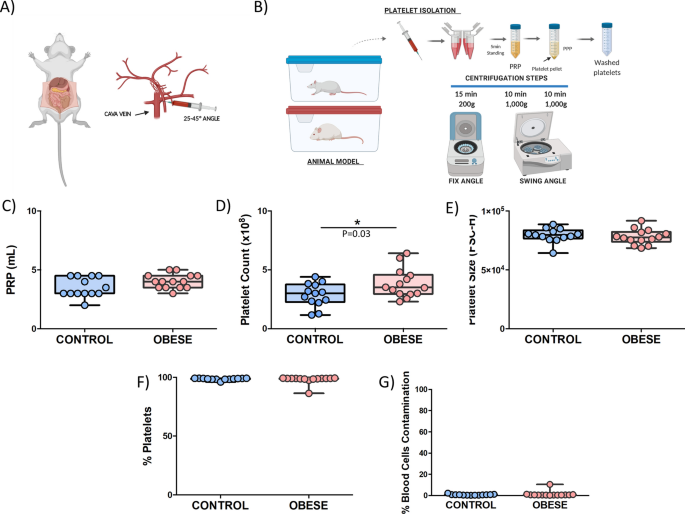
一个重要的问题是根据计划的实验充分选择最佳的采血和血小板分离选择。在我们研究的情况下,协议的设计基于对老鼠血小板制定若干准则,我们修改和调整我们的大鼠模型(图 3 A,B)11,12。
为了评估该方法的效率和可重复性,在总共14只DIO大鼠和13个瘦匹配对照中成功测量了各种不同的质量参数。
如图所示。 3 C,富含血小板的血浆(PRP)水平几乎朝向该方法具有高度可重复性的指向组之间是相同的。此外,就血小板相关参数而言,与对照组相比,DIO大鼠模型中的血小板计数明显更高(图 3 d)。此外,在血小板计数与总重量和BMI之间未发现正相关(补充图1a,b)。另外,也没有显著发现差异关于血小板大小组间并有后者和重量之间没有正相关(图 3 E,补充图1个 C)。
除上述参数外,其他血细胞的污染也是要考虑的重要问题。根据结果,“纯”血小板的百分比超过99%,这意味着我们建立了一种血小板分离方法,其中少于1%属于其他血细胞污染物(图 3 f,g)。
总而言之,整体数据表明,该方法的建立显示了各组之间的高度可重复性,从而可以收集样品中超过99%的纯血小板。
DIO血小板中的活跃Src(pTyr 419)水平升高
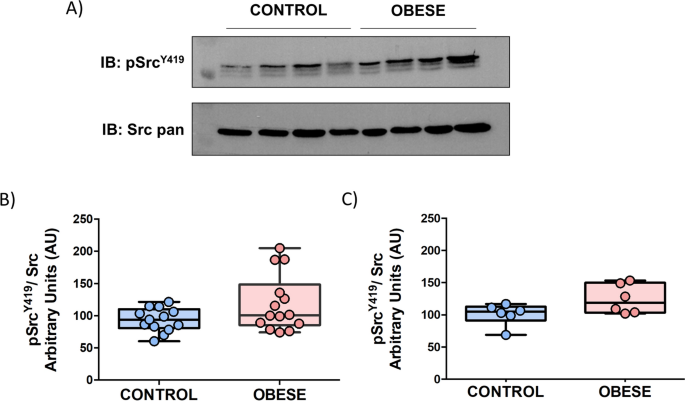
为了研究我们的肥胖大鼠模型中的血小板功能障碍,我们通过蛋白质印迹分析法分析了Src Y419活性形式的血小板表达水平。Src和SFK的其他成员受到酪氨酸磷酸化的严格调控。Src的全部催化活性需要位于催化域中的酪氨酸419的磷酸化。通过使用特异性抗Src(pTyr419)抗体,比较了14只DIO大鼠和13个瘦肉匹配对照的队列。根据研究结果,存在朝向增加的Src一个明显趋势Y419在肥胖组水平(倍数变化= 1.3)(图 4的a,b)。
DIO大鼠血小板显示与SFKs介导的途径有关的血小板信号传导改变。(A)来自单个样品(13只瘦肉匹配的对照和14只DIO大鼠)的血小板中Src-pTyr 419和Src pan蛋白表达水平的1D-Western印迹分析。(B)光密度法图,显示了通过Src校正的Src(Tyr 419)的平均值±SD。通过不成对的t检验进行统计学分析(p = 0.06)。(C)密度计图显示了在亚组动物(极重和高血糖,6个DIO和6个对照)中被Src校正的Src(Tyr 419)的平均值±SD。统计分析通过不成对t检验(p = 0.07)。图像代表获得的结果,并显示样品分布在一种凝胶中(补充图 2)。IB免疫印迹。
此外,我们还分析了一个具有极高体重和高血糖水平的动物亚组(每组6只大鼠),试图类似于病态肥胖患者和苗条对照组之间的人类比较。与以前的结果一致,也存在朝向增加的Src的倾向Y419在肥胖组(图的水平 4 ℃)。
这些数据与先前在病态肥胖患者中获得的结果相符,这些患者指出了与SFKs相关的信号通路9的潜在功能障碍。
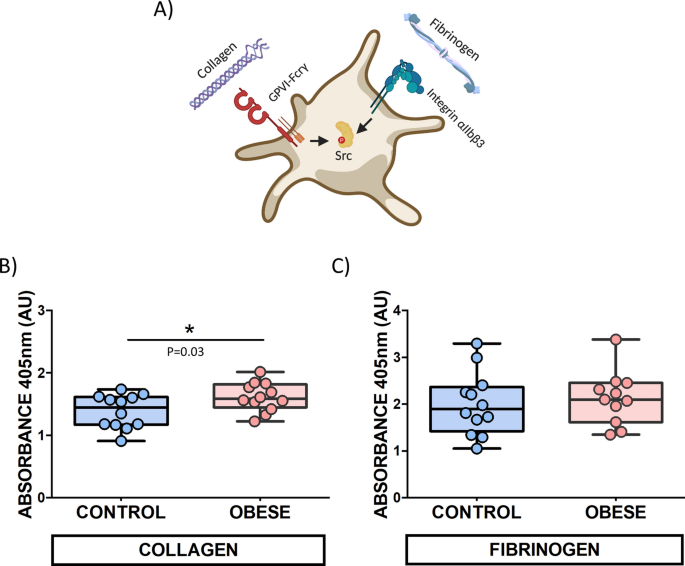
DIO大鼠的血小板与胶原蛋白的粘附增加
以上结果提示与SFK介导的信号通路有关的潜在血小板功能障碍。为了进一步探索我们大鼠模型中的这些血小板改变,进行了使用静态粘附测定的功能研究。为了更好地了解肥胖症对原发性SFKs相关受体GPVI和整联蛋白αIIbβ3的影响,将板分别涂有胶原蛋白和纤维蛋白原(图 5a)。
在12只肥胖大鼠和12只匹配的对照之间进行了比较分析。在肥胖组(图中观察到血小板粘附到胶原包被的板增加的水平 5 b)中。尽管如此,发现关于与纤维蛋白原的血小板粘附和DIO对照组之间没有显著差异(p = 0.6)(图 5 ℃)。
讨论区
本研究的目的是在肥胖相关的血小板研究中建立DIO大鼠模型,并更好地了解与肥胖相关的血小板的病理机制,从而阐明该病理中的新药靶点,耐药性和生物标记物发现。这项研究的主要发现是:(1)建立了可再现的采血和血小板分离方法,用于大鼠的血小板功能和生化研究;(2)Src(pTyr419)的活性物质在DIO大鼠血小板中显示出增加的趋势;(3)与瘦对照组相比,DIO大鼠的血小板对胶原蛋白的粘附性更高。
在与内分泌学相关的研究中,有几种适合研究肥胖症的动物模型。但是,重要的是要根据计划学习的主要目标选择适当的最佳模型。实际上,与肥胖症研究相关的动物模型可以分为两种主要的模型:由于单基因突变而引起的肥胖症(例如Zucker脂肪大鼠)或饮食诱导的动物模型(DIO大鼠)。在单基因突变(自发或工程突变)的情况下,该模型对于研究饮食控制的特定机制方面非常有用。1961年,Zucker等人。13由于常染色体隐性自发突变影响瘦素受体基因,发现大鼠肥胖表型。这些突变存在于少数肥胖人群中,因此该模型不太适合接受人群中的“常见”肥胖症14。但是,已知其他与肥胖有关的主要模型(DIO大鼠)(多基因动物模型)可以复制促进肥胖和人类代谢综合征的机制。确实,这些动物通常用于研究饮食,疾病的生理病理学和病因学以及药理试验的作用15。
在人类中,收益,由于长时间暴露于脂肪的饮食在一段长时间的体重已经报道了几项研究16,17。在这种情况下,DIO大鼠模型可以表征和监测HFD对模拟人类肥胖症病理特征的体重增加的贡献18。该模型还使我们能够将动物模型中的数据与肥胖患者中获得的数据相关联,从而有助于更好地了解肥胖者的血小板功能障碍。
在动物模型(尤其是啮齿动物)中,采用最合适的程序进行血液采集和血小板制备对于体外测定至关重要。不幸的是,文献中描述的制备方案不一致,并且描述了许多收集方法,分离步骤,材料和抗凝缓冲液19。迄今为止,只有少数的研究试图定义最适合的程序的采样和制备过程中,以排除血小板预活化11,12,19。从大鼠模型研究血小板的研究很少。但是,由于血小板与小鼠的相似性,我们结合了先前在小鼠中测试过的一些实用指南,以建立我们的程序11,12。
在喂养程序结束时,将大鼠用氯胺酮/甲苯噻嗪混合物腹腔麻醉以收集血液。在采血方面,啮齿动物最常见的终末手术部位是心脏穿刺(HP)和VCP。根据Jirouskova等。19HP在采血过程中会产生组织因子触及的心肌撕裂,这可能导致凝血酶生成和血小板活化。对于肥胖的老鼠,HP有更多的缺点,因为由于脂肪过多,如果不打开胸腔就很难正确识别心脏。在另一方面,VCP被称为是在获得的,容易获得的静脉和较少血小板活化与其它方法相比,血液的高量方面最值得推荐的血液收集方法11,19。根据上述数据,我们通过VCP收集血液,从而获得了少量血小板活化较少的大量血液。
在实验设置期间,使用了不同的针头以获得最佳的采血效率和技术处理条件。准确地说,由于21G的尺寸,规格和处理方式,它是最容易使用的针头。在血小板预激活方面,Pedersen等人。发现与19号和21号针头相比,血小板预激活没有差异(少于10%),都适合进行血液采样20。
穿刺后,应在抗凝剂存在下直接收集血液。在血小板相关的研究中,根据分析的目的,通常使用几种抗凝剂。通常,乙二胺四乙酸(EDTA)酸用于测量准确的血小板计数和平均血小板体积。就肝素而言,通常用于血小板功能测定(全血和PRP)。最后,主要使用柠檬酸钠作为抗凝剂,在PRP和洗涤过的血小板中进行血小板信号转导研究。在本程序的情况下,我们在血小板分离过程中将两种抗凝剂(柠檬酸钠和ACD)合并使用。2 21。
本研究中使用的血小板分离程序基于一系列离心步骤,以避免其他血细胞污染和自发性血小板活化。离心步骤适用于小鼠的实用指南,因为两种啮齿动物的血小板大小实际上相似22。此外,在分离方案期间样品之间的效率和可重复性是要考虑的重要问题。在这种情况下,我们的方法学允许各组之间具有高度的可重复性,从而允许超过99%的纯洗涤血小板。
在血小板相关参数,血小板计数和血小板大小方面都与一般血小板功能障碍相关的23,24,25,26。实际上,这两个参数都与心血管风险直接相关。的确,血小板计数与其他人体测量学参数(如腹围和脂肪分布)之间存在正相关关系27。在我们的案例中,我们发现与对照组相比,DIO模型中的血小板计数明显更高。但是,各组之间的血小板大小没有差异。在这种情况下,使用肥胖的非糖尿病大鼠(Zucker脂肪模型)Hernández-Vera等人。7 假定该模型中的血小板计数发生变化和血小板大小增加。
我们最近报道,来自肥胖患者的血小板显示出与SFK相关的信号通路,特别是胶原蛋白受体GPVI 9的潜在改变。Src是一个60 kDa的非受体酪氨酸激酶,参与传输来自不同血小板表面受体的激活信号,这对于血栓的生长和稳定性至关重要(GPVI,整联蛋白αIIbβ3,CLEC-2等)28。残基Tyr 419的磷酸化对于达到Src的全部催化活性是必需的。根据我们在人类中的数据,尽管个体间差异很大,但我们发现DIO大鼠血小板中pSrc Y419水平明显升高。
GPVI和整联蛋白αIIbβ3血小板刺激通过Tyr 419 28处的自身磷酸化作用导致Src活化。有趣的是,我们证明了来自DIO大鼠的血小板显示出与胶原蛋白包被的板的粘附水平增加,表明GPVI信号的改变。在这种情况下,Kreuts等人进行了一项研究。29表明肥胖猪对胶原蛋白的反应也比瘦猪高。在人类中,Leite等。30还显示肥胖患者的血小板对胶原蛋白反应过度。确实,如上所述,我们的研究小组最近显示,肥胖患者的血小板对胶原蛋白相关肽(CRP)和胶原蛋白9的反应具有更高的GPVI表面水平和更高的血小板聚集性。
我们的动物模型证实了肥胖中GPVI信号的过度激活,从而增强了人类先前的整体数据。就模仿人类肥胖的病理生理而言,DIO大鼠模型是将研究结果转移到人类临床研究的最佳选择。
本研究有一些局限性应予以考虑。有效的血液采样并非无关紧要。因此,尽管这项研究是对40只大鼠进行的,但其中有几只在安乐死和采血过程中出现了困难。由于样品的质量是进行分析的主要考虑因素之一,因此将这些大鼠的样品取出以明确确定研究质量不会受到影响。
另一个限制是缺乏可用于功能研究的试剂。例如,通过流式细胞术检查肥胖大鼠中GPVI血小板表面表达水平将是令人感兴趣的,但是尚无可用于大鼠GPVI的抗体。此外,样品数量的限制使我们无法并行进行其他实验,例如直接针对经过验证的蛋白质进行免疫沉淀或进行血小板聚集试验。
总而言之,本研究允许为DIO大鼠建立足够的采血和血小板分离方法,并有助于阐明肥胖症中的血小板功能障碍。方法学的发展将使实验室之间的数据比较和将发现更好地转移到临床研究中成为可能。此外,我们显示,来自DIO大鼠的血小板对胶原蛋白包被的板块表现出更多的粘附性,这表明肥胖症中GPVI信号的上调。总体而言,DIO动物模型可能是研究大鼠血小板中与肥胖相关的变化的有力工具。确实,我们的结果证实了肥胖与应考虑的动脉粥样硬化血栓形成风险有关,并且与我们在人体中的研究一致,强调了进一步研究GPVI作为肥胖症中抗血栓形成药物靶标的相关性。
材料与方法
动物模型
根据机构准则和欧盟关于实验动物的护理和使用的标准,该研究是根据代码15005/2015/003的程序进行的。该程序经批准Consellería德麦迪欧农村,Xunta德加利西亚和圣地亚哥德孔波斯特拉大学的动物护理委员会(圣地亚哥德孔波斯特拉,西班牙)。
从圣地亚哥大学的动物设施购买了40只重150至199 g,5周龄的成年Sprague–Dawley雄性大鼠。将大鼠饲养在动物饲养场中7天,以使其适应当地条件(温度(22–24°C)和明/暗周期(12 h光照,12 h黑暗))。适应后,将动物随机分为两个实验组(每组n = 20):对照和DIO模型。
关于饮食,DIO动物饲喂60%高能量饮食(HFD),能量密度为5.21 kcal / g。热量信息如下:60%大卡脂肪,20%大卡蛋白质,20%大卡碳水化合物(D12492,Research Diets,NJ)。此外,60%HFD包含以下成分:酪蛋白,乳酸,30目(200克),胱氨酸,L(3克),Lodex 10(125克),蔗糖,细粒(72.80克),Solka Floc,FCC20 (50克),猪油(245克),大豆油,美国药典(25克),S10026B(Rearch Diets,50克),胆碱Bitartre(2 g),V10001C(Research Diets,1 g),染料蓝FD&C#1明矾,湖中35–42%(0.05克),总量为7,773.85克。
另外,对年龄和性别匹配的对照大鼠饲喂脂肪含量为10%(D12450B,Research Diets,NJ)的标准[低脂饮食(LFD)],能量密度为3.82 kcal / g。热量信息是10%大卡脂肪,20%大卡蛋白质,70%大卡碳水化合物。此外,食物中含有以下成分:酪蛋白,乳酸,30目(200克),胱氨酸,L(3克),蔗糖,细粒(354克),玉米淀粉(315克),洛德克斯10(35克) ,Solka Floc,FCC20(50克),猪油(20克),大豆油,USP(25克),S10026B(Rearch Diets,50克),胆碱Bitartre(2 g),V10001C(Research Diets,1 g),染料黄FD&C#5明矾,色淀35–42%(0.05克),总量1,055.05克。
在该过程中,两个实验组均随意喂养9周。每周测量食物摄入量和体重。此外,在安乐死前1周使用Accu-check performa设备(Roche)通过尾部切口测量空腹血糖。步骤在图1中详细描述 。
采血
在文献中有几种适用于血小板功能常规研究的方案。然而,重要的是要根据计划的实验为血液采集和血小板分离选择足够的最佳选择。在我们研究的情况下,协议的设计基于对老鼠血小板制定若干准则,我们修改和调整我们的大鼠模型(图 3 A,B)11,12。
用氯胺酮/甲苯噻嗪鸡尾酒(KETAMIDOR(氯胺酮100 mg / mL,Richer pharma)和ROMPUR(甲苯噻嗪,20 mg / mL,Bayer)进行腹腔麻醉,收集所有大鼠的血液,捏紧大鼠后通过反射消失来测试镇痛效果。然后,沿着白线切开腹部,将胃肠道移至右侧以观察腔静脉(图 3a)。
将针以25°至45°的平角插入腔静脉。将血液抽入预先装有10%柠檬酸钠的19G 10 mL注射器中,并轻轻吸出,直到达到最大注射器体积或停止向针头中流血(大约6-8 mL)。避免将血管壁吸入针头很重要。
血小板分离
在人类血小板研究中使用的方法多年来已被用于动物血小板测定。在我们的案例中,我们根据Aurbach等人在小鼠中进行采血和血小板分离的实用指南进行了修改后的方案。12。血小板分离方案,以避免与其他血细胞和自发的血小板活化的污染物是基于对离心步骤的串行31(图 3 b)中。
从注射器上取下针头后,将约1.5 mL血液从注射器中转移到2 mL收集管中,其中装有150 µL预热的柠檬酸右旋糖(ACD,117 mM柠檬酸钠,111 mM葡萄糖,78 mM柠檬酸)。之后,使用定角离心机在200 g的室温下将血液离心15分钟。重要的是要强调在第一步离心之后;血液在垂直方向静置5分钟,以便更有效地吸收红细胞。
汇集来自同一个人的PRP,并将其转移到50 mL管中。然后将前列环素(终浓度为1μM)添加到PRP中,该PRP立即在室温下在旋出式离心机中离心10分钟(1,000 g)。此步骤之后,吸出贫血小板血浆并将沉淀的血小板重悬于含有400 µL ACD(10%)和3.6 mL Tyrodes-HEPES缓冲液的缓冲液(134 mmol / L NaCl,0.34 mmol / L Na 2 HPO 4,2.9毫摩尔/ L的KCl,12 mmol / L的碳酸氢钠3,20毫摩尔/升HEPES,5毫摩尔/升葡萄糖,1毫摩尔/升的MgCl 2,pH 7.3)中(90%)。
使用Z1库尔特粒子计数器(Beckman Coulter)对血小板浓度进行计数。将5 µL血小板悬浮液与10 mL Isoton II混合。计数后,在存在前列环素(终浓度为1μM)的摇摆式离心机中于室温下将血小板离心10分钟(1,000 g)。获得沉淀后,将血小板用Tyrodes-HEPES缓冲液稀释至所需浓度(1×10 8 血小板/ mL),并在室温下静置30分钟。
流式细胞仪
为了验证血小板分离方案的质量,进行了FACs相关测定。此外,我们还通过前向散射(FSC)参数测量了血小板大小,因为已知它是血小板大小的常见指标。
按照上述方法, 用200 µL稀释剂(Beckman Coulter,美国)稀释10 µL洗涤过的血小板(5×10 7细胞/ mL),然后使用Accuri C6流式细胞仪(BD Biosciences)进行测量。由于样品限制,测试一式两份进行。数据表示为FSC的几何平均值和血小板门中的%以及其他细胞血门中的%的几何平均值。
血小板静态粘附测定
在96孔测定板(Nunc MaxiSorpTM)上涂满胶原蛋白荷尔蒙(5 µg / mL; Takeda Austria GmbH(奥地利))和大鼠纤维蛋白原(100 µg / mL; Enzyme research,美国)过夜。首先,使用封闭液[2%牛血清白蛋白(BSA)] 1 h,以避免任何非特异性粘附。1小时后,除去封闭溶液,并用PBS洗涤板3次。然后,将50 µL洗涤过的血小板以1×10 8 血小板/ mL的浓度在37°C下暴露于包被的板上1 h。通过用Tyrode's缓冲液洗板3次来除去未结合的血小板,然后用底物溶液处理粘附的血小板(p-硝酸硝基苯酯)搅拌40分钟。添加NaOH(3 M),并用Tecan Infinite M1000测量吸光度(405 nm)。该测定重复三次。结果表示为将吸光度值与阴性对照(无配体)的吸光度值归一化的任意单位。
蛋白质印迹
进行蛋白质印迹以分析单个样品(生物学重复)以进行验证。将血小板溶解在2%SDS(终浓度)中,然后通过Pierce 660 nm蛋白质测定(Thermo Scientific,美国)对蛋白质进行定量,然后通过11%SDS-PAGE分离蛋白质。每个泳道上样五微克蛋白质。用于免疫印迹的主要抗体是兔抗磷酸SRC(Tyr419)(Invitrogen),稀释度为1:1,000和兔抗SRC pan(Invitrogen)。在TBS-T中洗涤后,将膜暴露于辣根过氧化物酶标记的山羊抗兔(稀释度1:5,000)(Pierce,Rockford,IL),并使用增强的化学发光系统(ECL,Pierce,Rockford,USA)进行处理。 。
统计分析
两组的分类变量均以具有标准差(SD)的平均值表示,并使用Fisher精确检验进行比较。组间差异通过不配对t检验进行分析。p值<0.05被认为是显着的。
|
|