脂多糖用于小脑共济失调伴神经炎症的小鼠模型
脂多糖用于小脑共济失调伴神经炎症的小鼠模型
大多数小脑共济失调(CA)是无法治愈的神经系统疾病,导致小脑发炎或受损缺乏自愿控制。尽管CA可能与小脑炎症直接或间接相关,但尚无合适的具有神经炎症的CA动物模型。在这项研究中,我们评估了脑室内注射脂多糖(LPS)生成炎性CA动物模型的效用。我们观察到,LPS给药可在胶质细胞激活后诱导促炎分子的表达。另外,LPS的施用导致凋亡的浦肯野细胞死亡并诱导异常的运动活动,例如运动协调性受损和后肢紧握姿势异常。
介绍
小脑性共济失调(CA)是由影响小脑或与其相关联的传导途径的病理过程的运动神经元疾病的1,2。它们的特征是平衡,运动和步态异常协调等症状。当前,大多数CA都是可以治愈的,只有少数例外,并且只有减轻症状的可能3。CA可以由遗传缺陷,散发性神经变性疾病,和采集到的条件(例如,感染,中毒反应,醇,和维生素缺乏)引起的,但它们也可以出现原因不明1,3,4。特别是,许多报道显示小脑炎症与CA 1之间存在密切关系,3,5。导致产生促炎症分子的神经胶质细胞的活化已经在CA的许多动物模型中被观察到,并且也是患者小脑与CA明显 6,7,8,9。此外,小脑炎症已经显示出诱导浦肯野细胞的损失,这导致在小脑功能障碍 1,7。虽然CA的发病与遗传因素,小脑的神经毒性,和物理伤害有关的理解已经到CA的一些动物模型的发展做出了贡献 1,3,目前尚无合适的动物模型来研究胶质细胞激活和体内神经毒性小脑炎症后的CA。
神经炎症在神经退行性疾病如帕金森氏病和阿尔茨海默氏病10的发病机理和进展中起着至关重要的作用。作为神经炎症的有效刺激剂,脂多糖(LPS)已用于介导神经退行性进展11。大量证据表明,LPS诱导的神经炎症通过激活小胶质细胞和星形胶质细胞,M1小胶质细胞极化和促炎性介质的释放而引起神经元损伤。例如,注入黑质的LPS会诱导小胶质细胞活化,从而引起多巴胺神经元的变性,这构成了帕金森氏病的病理基础12。此外,脂多糖导致淀粉样蛋白β的增加,这导致小鼠大脑中的脱髓鞘和少突胶质细胞损伤,进而引起阿尔茨海默氏病13。
在本研究中,为了开发与小脑炎症相关的CA动物模型,我们评估了脑内注射LPS诱导小鼠小脑中神经胶质炎症介导的神经毒性事件的效用。
结果
通过LPS给药在小鼠小脑中激活神经胶质
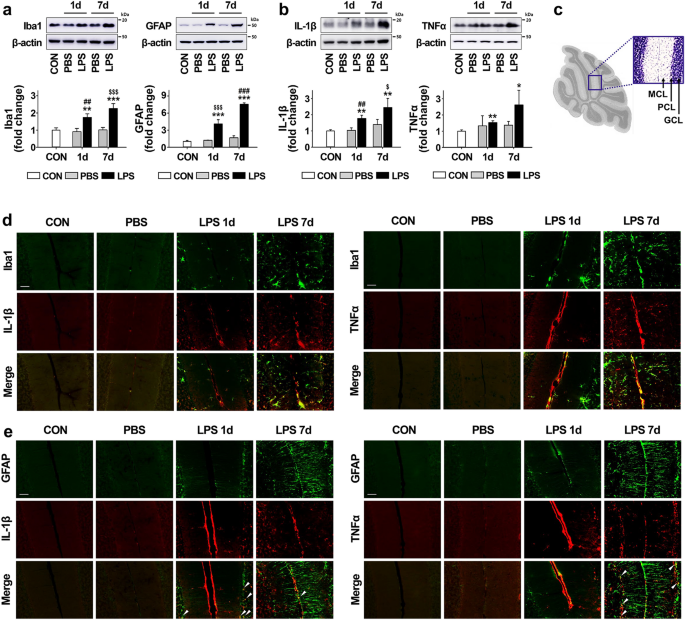
为了建立由炎症引起的CA的动物模型,我们在本研究中将LPS直接注射到小脑作为神经炎症的有效引发剂。如图1a中的蛋白质印迹所示 ,通过LPS注射以时间依赖性方式显着增加了Iba1(对于小胶质细胞)和GFAP(对于星形胶质细胞)的表达水平。与Iba1和GFAP的表达结果一致,与完整对照组相比,LPS注射后7天促炎细胞因子(如IL-1β和TNFα)的表达水平显着上调了2.4倍和2.6倍(图 1)。b)。PBS处理的小鼠中的神经胶质和促炎细胞因子水平与对照组无差异。此外,我们用细胞特异性标记物Iba1和GFAP对促炎细胞因子IL-1β和TNFα进行了双重免疫荧光染色,以鉴定在LPS处理后表达促炎分子的细胞类型。免疫染色结果显示,LPS处理后,IL-1β和TNFα分布在小脑中,主要与Iba1阳性细胞共定位,而很少与GFAP阳性细胞共定位(分别见图 1 d和e),提示LPS促炎细胞因子的诱导主要发生在小胶质细胞中。
LPS注射在小脑中,炎症反应增加。(a)注射LPS后1天和7天,小脑中Iba1(对于小胶质细胞)和GFAP(对于星形胶质细胞)的表达水平。Iba1:** p = 0.008,*** p <0.001(相对于CON),$$ p <0.001,相对于PBS(7天),## p = 0.004,相对于PBS(1天)(每组n = 3,F( 4,10)= 26.219)。GFAP: 相对于CON,*** p <0.001,相 对于PBS ,$$ p <0.001(1天), 相对于PBS ,### p <0.001(7天)(每组n = 3,F(4,10)= 150.249)(b)注射LPS后1天和7天,小脑中促炎细胞因子如IL-1β和TNFα的表达水平。IL-1β:** p = 0.002 vs CON,$ p = 0.014 vs PBS(7天),## p = 0.003 vs PBS(1天)(每组n = 3,F(4,10)= 11.034) 。TNFα:** p = 0.0027和* p = 0.035,相对于CON(每组n = 3,t(4)= − 6.632和t(4)= − 3.136)。(c)小鼠小脑的矢状组织切片。此框显示小脑皮质,(d)和(e)被采取。我们用“ MCL”代表分子细胞层,“ PCL”代表浦肯野细胞层,“ GCL”代表颗粒细胞层。(d)LPS注射后1天和7天,小胶质细胞(绿色)和促炎细胞因子(IL-1β和TNFα;红色)在小脑之间的表达模式(比例尺=50μm)。(e)LPS注射后1天和7天,小脑中星形胶质细胞(绿色)和促炎细胞因子(IL-1β和TNFα;红色)的表达方式。与对照组相比,LPS注射后小脑中的活化小胶质细胞显着增加了IL-1β和TNFα的表达,但很少与星形胶质细胞共定位(箭头)。比例尺= 50μm。所有值均表示为平均值±标准偏差(SD)。采用Tukey 事后分析的单向方差分析(a和b;IL-1β)和双面配对t检验(b; TNFα)。首先根据蛋白质的分子量大小切割膜。印迹的图像以裁剪的形式显示,并且(a)和(b)的原始印迹带有裁剪的膜分界显示在补充图2中。
LPS给药在小鼠小脑中诱导趋化因子
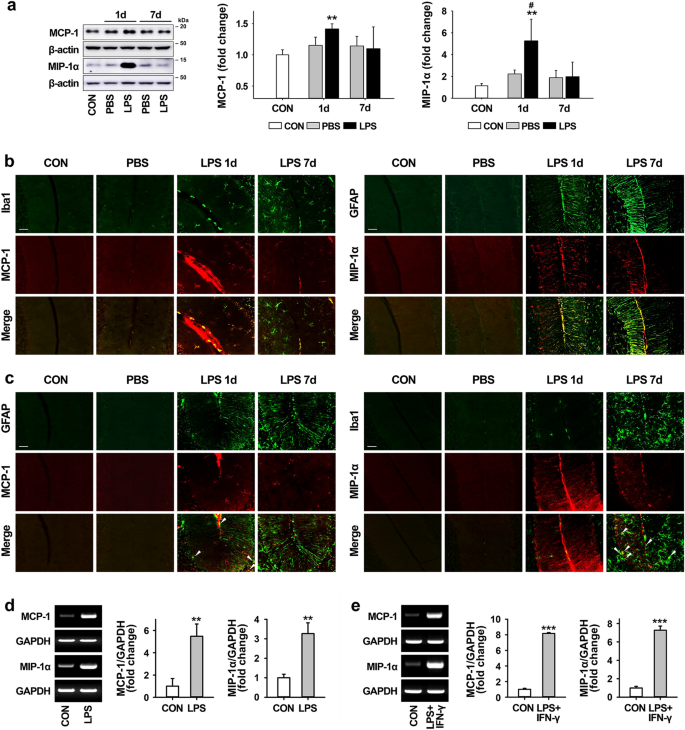
我们还检查了注射LPS的小脑中促炎性趋化因子(例如MCP-1和MIP-1α,称为炎症细胞趋化因子)的产生。如图所示通过蛋白质印迹(图 2 a)中,MCP-1和MIP-1α在小脑的表达显著LPS注射后相比,在完整对照水平增加1天,并且该增加在第7天减少。类似于免疫印迹,双重免疫染色显示,LPS处理后第1天这些趋化因子的增加比7天更明显,MCP-1的表达主要在小胶质细胞中观察到,而MIP-1α则主要观察到在星形胶质细胞(图 2 b)所示,虽然各趋化因子的一些表达在两个星形胶质细胞和小胶质细胞,也观察到在体内(图 2 c),并且在暴露于LPS和LPS +IFN-γ的原代小胶质细胞和星形胶质细胞中,MCP-1和MIP-1α的mRNA水平(通过传统的RT-PCR测量)分别升高(图 2 d,e) )。
LPS注射在小脑中诱导化疗药物。(a)LPS注射后1天和7天,小脑中促炎性趋化因子如MCP-1和MIP-1α的表达水平。MCP-1:** p = 0.003 vs CON(每组n = 3,t(4)= − 6.26)。MIP-1α:** p = 0.008(相对于CON),#p = 0.049(相对于PBS)(1天)(每组n = 3,F(4,10)= 6.042)。(b和c)LPS注射后1天和7天时小脑中的神经胶质细胞(小胶质细胞和星形胶质细胞;绿色)和促炎性趋化因子(MCP-1和MIP-1α;红色)之间的表达模式(比例尺= 50μm)。在LPS暴露的小脑中,小胶质细胞和星形胶质细胞会上调MCP-1和MIP-1α的表达(b),而很少分别与星形胶质细胞和小胶质细胞共定位(c,箭头)。比例尺= 50μm。(d和e)通过LPS和LPS + IFN-γ处理原发小胶质细胞(d)和星形胶质细胞培养(e)中MCP-1和MIP-1α的mRNA表达水平增加(e)。)。通过RT-PCR测定在炎性刺激治疗后6小时MCP-1和MIP-1α的相对mRNA表达。图代表对GADPH标准化的凝胶图像的定量分析。小胶质细胞:** p = 0.004(MCP-1,t(4)= − 6.003)和** p = 0.003(MIP-1α,t(4)= − 6.750)vs CON(每组n = 3)。星形胶质细胞:*** p <0.001(MCP-1,t(4)= − 74.306;MIP-1α,t(4)= − 22.787)vs CON(每组n = 3)。所有值均表示为平均值±标准偏差(SD)。统计显着性采用单向方差分析与Tukey 事后分析(a; MIP-1α)和双面配对t检验(a; MCP-1,d和e)。首先根据蛋白质的分子量大小切割膜。印迹的图像以裁剪的形式显示,并且(a),(d)和(e)的原始印迹(带有裁剪的膜划界)显示在补充图2中。
LPS对小鼠小脑小胶质细胞极化的影响
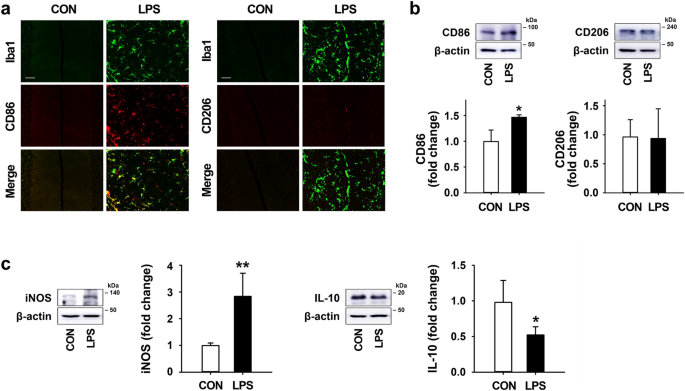
为了检查LPS对小鼠小脑小胶质细胞表型调节的影响,我们研究了LPS治疗7天后M1和M2型小胶质细胞的表达水平。在双重免疫染色的结果中,通过LPS注射,CD86(一种M1标记)在Iba1阳性小胶质细胞中高度表达,而CD206(一种M2标记)很少在小脑中表达(图 3a)。与双重免疫染色结果一致,蛋白质印迹显示与完整对照组相比,小脑中LPS暴露诱导CD86显着增加,而CD206表达无变化(图 3)。b)。此外,在蛋白质印迹结果,LPS处理,发现增加的iNOS(一个M1标志物)的表达,并减少显著IL-10(一种M2标记物)相对于对照的水平(图中的表达 3 C)。
LPS对小鼠小脑小胶质细胞极化的影响。(a)LPS治疗7天后小脑中小胶质细胞(Iba1;绿色)和M1 / M2型小胶质细胞标记物(CD86和CD206;红色)的表达模式(比例尺= 50μm)。(b)在LPS注射后7天,小脑中CD86和CD206的表达水平。CD86: 相对于CON,F(4,10)= 10.512),* p= 0.038 。(c)LPS处理7天后小脑中iNOS(M1标记物)和IL-10(M2标记物)的表达水平。iNOS:** p = 0.007 vs. CON(每组n = 4,F(3,12)= 10.207)。IL-10:* p = 0.022 vs CON(每组n = 4,F(3,12)= 25.728)。所有值均表示为平均值±标准偏差(SD)。统计显着性采用Tukey 事后分析进行单向ANOVA 检验。首先根据蛋白质的分子量大小切割膜。印迹的图像以裁剪的形式显示,并且(b)和(c)的原始印迹(带有裁剪的膜分界)显示在补充图2中。
LPS诱导的神经炎症反应后的运动障碍和浦肯野细胞损伤
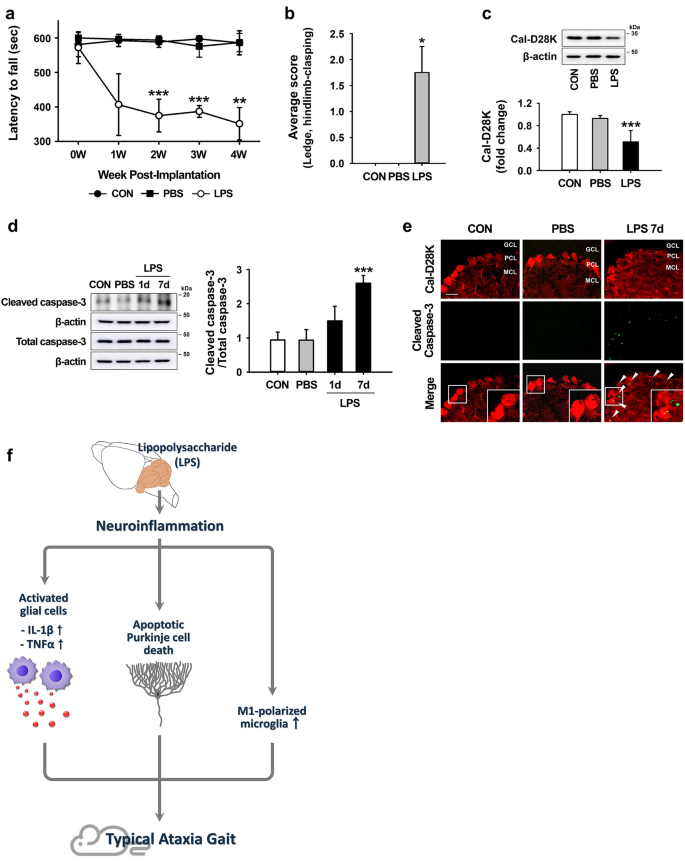
为了调查基于LPS的炎性CA(ICA)动物模型的适用性,我们从10周大的老鼠开始,每隔4周每周进行轮转试验,以证实ICA小鼠的运动功能障碍。在旋转棒上的保留时间显著下降,从572±46号在第0周,以351±47 4周注射LPS后相比完整对照(≥580 S)(图的性能 4 a)中。此外,我们进行了LPS注射后4周的共济失调样缺陷快速,敏感的表型评估,如先前所述14。尽管任何一组都没有死亡率(数据未显示),但与完整对照组相比,注射LPS的小鼠表现出运动协调障碍(壁架试验)和后肢紧握姿势异常(图 4)。b)。我们还评估了由神经炎症引起的共济失调样运动障碍是否与Purskinje细胞的丢失有关,这是CA 15的典型神经病理特征。相对于对照小鼠,LPS注射的小鼠表现出> 50%减少在钙结合蛋白的蛋白质,这表明浦肯野细胞死亡,在7天后注射LPS(图小脑 4 ℃)。如蛋白质印迹和双重免疫染色所示,与完整对照组(图4 d;补充图S1)和裂解的半胱天冬酶相比,caspase-3的活化显示注射LPS的小脑的时间依赖性增加 。-3小脑蒲肯野细胞中观察到下列体内(图LPS给药 4 E)。
注射LPS的小鼠的炎症引起的行为障碍和凋亡浦肯野细胞死亡。(a)注射LPS后4周进行Rotarod测试。** p = 0.001 and *** p <0.001 vs CON(CON,n = 6; PBS,n = 4; LPS,n = 3; 2 W,t(5)= 8.316; 3 W,t(5) = 21.243; 4 W,t(5)= 6.690)。(b)LPS注射后4周的简单复合表型评分系统。* p = 0.029 vs CON(每组n = 4)。(c)注射LPS 7天后小脑中Cal-D28K(对于浦肯野细胞)的表达水平。*** p <0.001 vs CON(每组n = 4,F(3,12)= 14.735)(d)LPS注射7天后小脑中激活的caspase-3的表达水平。*** p <0.001 vs CON(每组n = 4,F(3,12)= 25.842)。所有值均表示为平均值±标准偏差(SD)。统计显着性用双向配对t检验(a),Mann-Whitney U统计量(b)和具有Tukey 事后分析的单向方差分析(c和d)检验。(eLPS注射后7天,使用裂解的caspase-3的免疫荧光分析检测小脑中的凋亡性Purkinje细胞(箭头)。我们用“ MCL”代表分子细胞层,“ PCL”代表浦肯野细胞层,“ GCL”代表颗粒细胞层。由右侧面板中的实线界定的插图显示图像的高放大倍率部分。(比例尺= 100μm)。(f)LPS暴露的小脑中由神经炎症引起的共济失调症状的示意图。首先根据蛋白质的分子量大小切割膜。印迹的图像以裁剪的形式显示,(c)和(d的原始印迹)的膜分界在图2中显示。
讨论区
CA是从小脑炎症或损伤引起的,由于各种原因引起的神经系统疾病的1,3,4。最近关于共济失调的全球研究报告说,每10万名儿童中26例的总体患病率16。CA的病因通常可分为三大类:遗传性,特发性和获得性17。最近的临床和临床前证据积累支持了小脑炎症在CAs进程中起重要作用的假说。例如,神经毒性炎症应答,涉及生产由活化的小胶质细胞和星形细胞炎性分子,已在患者和遗传性CA,尤其是脊髓小脑性共济失调的动物模型中观察到6,7。此外,一些研究表明通过病毒感染或有毒曝光(曝光到酒精,药物,或环境毒素)引起的炎性反应会导致CA因为小脑是特别容易受到中毒和中毒8,9,18。这些研究结果表明,小脑中炎症反应的上调可能是CAs进展的重要机制,而神经炎症的控制可能是CAs管理的潜在治疗靶点。
针对CA的有效靶向疗法的发展由于其复杂而广泛的原因3以及缺乏合适的动物模型而受到阻碍。在这里,我们评估了LPS作为小脑发炎的有效启动子以开发ICA小鼠模型的适用性。我们观察到用LPS诱导的Ca发展与神经胶质细胞活化相关的严重炎症小脑,导致促炎分子IL-1β,TNFα,MCP-1和MIP-1α(图的表达增加的小鼠1,2)。IL-1β和TNFα主要由活化的小胶质细胞产生(图 1)和MCP-1和MIP-1α(已知具有化学吸引活性,并在LPS处理后迅速增加)分别主要由小胶质细胞和星形胶质细胞产生(图 2)。炎症刺激后,诸如MCP-1和MIP-1α等化学引诱剂的上调在小胶质向损伤部位的运输中起重要作用。例如,缺氧缺血性损伤后MCP-1的表达增加促进小胶质细胞向损伤部位的迁移19,而MIP-1α的上调诱导梗塞性脑小胶质的蓄积20。结合以前的证据,我们的结果表明,LPS治疗后产生MCP-1和MIP-1α可能有助于神经胶质迁移和炎症反应增加。
在神经退行性疾病中,有两种主要的活化小胶质细胞,它们具有不同的功能:产生促炎性细胞因子的M1型和产生促炎性介质(例如IL-10,精氨酸酶-1和转化生长因子β)的M2表型,其中抑制促炎症反应,神经元提高修复,促进异常蛋白的吞噬作用21,22。LPS暴露的小脑中M1-和M2型小胶质细胞的细胞表面标志物和细胞因子表达水平表明,LPS暴露后,许多小胶质细胞被激活并朝着M1表型极化,这通过CD86和iNOS和通过降低IL-10的水平(图 3)。这些结果与促炎分子如IL-1β和TNFα的诱导一致(图 1),这些结果表明LPS的施用促进了活化的小胶质细胞的转移,从而在LPS治疗的小脑中诱导了炎性作用。
越来越多的证据表明,浦肯野细胞的损失,这是CA的典型的病理特征,可以用在各种类型的CA的炎症相关联1,7,23。此外,浦肯野细胞损失和功能障碍的患者和动物模型中最常见的功能与共济失调的症状7,24。除了小脑中活化的神经胶质的炎症反应外,我们还观察到了LPS处理的小脑中Purkinje细胞的凋亡性死亡,受伤的小鼠显示出运动功能障碍的证据,例如协调能力受损,失去平衡以及后肢紧握姿势异常(图 4)。
总之,我们检查了脑内注射LPS可能开发ICA小鼠模型的潜力。LPS诱导的ICA小鼠表现出平衡和运动控制受损,表明小脑功能障碍,并且这些特征伴随着神经胶质激活引起的促炎分子上调,随后浦肯野细胞凋亡死亡(图 4 f)。因此,这些结果表明,LPS处理的小鼠表现出炎症反应和CA患者的典型症状,表明它们可能作为ICA的实验动物模型。
方法
动物
雄性C57BL / 6小鼠(10周龄;大韩生物链接有限公司,韩国阴城)被关在可控环境(23±2°C,湿度为50–60%)中,光照时间为12 h,可免费使用食物和水。所有实验动物程序均按照批准的动物规程和庆北国立大学动物保护委员会的指导原则进行(编号KNU 2019-0002)。尽一切努力使实验中涉及的动物的痛苦和数量最小化。
ICA动物模型
为了建立ICA动物模型,将LPS(5μg/ 5μL)直接注入小鼠小脑,如前所述,但有一些改变25。简而言之,通过腹膜内施用115 mg / kg的氯胺酮(大韩民国,Yuhan)和23 mg / kg的Rompun,深度麻醉雄性C57BL / 6小鼠(10周大,大韩生物技术有限公司,韩国阴城)。 (位于韩国的Bayer Korea Ltd.)并置于立体定位镜架上(David Kopf Instruments,Tujunga,CA,USA)。为了注射到小脑,进行中线矢状切口以暴露颅骨,并钻出毛刺孔。总共以0.5μL的速率向小脑中注射一次5μLLPS(1 mg / mL)或磷酸盐缓冲盐水(PBS)(AP:-2.5 mm; DV:-2.5 mm,相对于λ) /分钟通过连接到汉密尔顿注射器(10μL,30G)的注射泵进行。将针头再留5分钟以限制沿注射道的回流。注射后
原始神经胶质文化
混合原代胶质细胞培养物由2天大的C57BL / 6小鼠切碎并使用尼龙网机械破坏整个大脑,如先前所述26。简而言之,将细胞在含有10%热灭活胎牛血清(FBS,Gibco BRL,美国纽约州格兰德岛)和1%青霉素-链霉素(Gibco BRL,美国纽约州格兰德岛)的DMEM中生长。 C在5%CO 2的湿润气氛中。在开始的5天后,然后每3天,将培养基替换为新鲜的培养基。通过轻度胰蛋白酶消化从混合的神经胶质培养物中获得原发性小胶质细胞。培养3周后,用在无血清DMEM中以1∶3稀释的胰蛋白酶溶液(0.25%胰蛋白酶-EDTA,Gibco BRL,Paisley,Scotland)处理混合的神经胶质细胞20分钟。这导致星形胶质细胞脱离,而小胶质细胞仍然附着在培养瓶的底部。通过以5,000× g离心10分钟收集分离的星形胶质细胞 用于原代星形胶质细胞培养,并将剩余的原代小胶质细胞用于实验。使收集的小胶质细胞和星形胶质细胞生长并保持在含有10%FBS和1%青霉素-链霉素的DMEM中。
传统RT-PCR在胶质细胞培养物中测量MCP-1和MIP-1α
为了诱导神经胶质细胞活化,将小胶质细胞用终浓度为100 ng / mL的大肠埃希氏菌 0111:B4(美国Sigma公司)的LPS进行处理6小时,该DPS用DMEM稀释,稀释度为10%FBS和1%青霉素-链霉素。用LPS(100 ng / mL)和IFN-γ(50 U / mL; R&D系统,美国明尼阿波利斯)组合刺激星形胶质细胞6小时,这通过大量释放促炎因子来增强炎症反应,例如作为TNFα,IL-6和一氧化氮27。洗涤细胞并根据制造商的说明收集在TRIzol试剂(Life Technologies,Gaithersburg,MD)中。使用Superscript II(Invitrogen,Gaithersburg,MD,USA)和oligo(dT)引物进行逆转录。使用特定引物组的传统PCR扩增是在55-60°C的退火温度下经过25-30个循环进行的。具体的引物如下。GADPH正向:5′-ACCACAGTCCATGCCATCAC-3′,GADPH反向:5′-TCCACCACCCTGTTGCTGTA-3′,MIP-1α正向:5′-TCTGCAACCAAGTCTTCTCAG-3′,MIP-1α反向:5′-GAAGAGTCCCTCGATGTGGCGC-3′,MCP- 1fwd:5'-CAGCAGGTGTCCCAAAGAA-3',MCP-1 rev:5'-CTTGAGGTGGTTGTGGAAAAG-3'。扩增产物在琼脂糖凝胶上电泳,并通过溴化乙锭染色观察。GAPDH用作内部对照。
行为测试
旋转脚架测试在LPS注射前1天开始,然后每周进行4周。对于下面描述的简单的复合表型评分系统,在LPS注射后4周进行一次行为测试。
罗塔罗德测试
根据Zhang等人的方法,旋转脚架试验用于评估运动协调和平衡。28。每周将实验小鼠小心地放在旋转棒上4周。旋转速度从4 rpm线性增加到40 rpm,然后在剩下的5分钟内保持该速度。记录小鼠停留在旋转杆上的总时间。为了避免肌肉疲劳,每次试验之间每只小鼠休息10分钟。
简单的综合表型评分系统
为了量化在LPS诱导的CA小鼠模型中的疾病严重程度,结合了壁架测试和后肢扣紧测试的先前描述的评分系统,使用了修饰14。评分是在14周龄时进行的。所有测试均以0–3评分,并合并为0–6的综合表型评分:0表示不存在相关表型,而3表示最严重的症状。每个测试重复三次。
壁架测试不平衡和不协调使用壁架测试进行评分。如果鼠标通常沿着壁架行走而不会失去平衡,则得分为0。如果鼠标沿壁架以不对称姿势行走,则得分为1。如果鼠标在壁架上行走时失去立足点,则得分为2。如果鼠标没有有效地使用其后腿,则得分为3。
后肢扣紧测试后肢扣紧已被用作CA小鼠模型中疾病进展的标志物29。如果后肢一直向外张开,远离腹部,则得分为0。如果一个后肢向腹部缩回的时间超过所测时间的50%,则得分为1。如果两个后肢均朝着腹部部分缩回超过测量时间的50%,则得分为2。如果后肢完全缩回并接触腹部超过测量时间的50%,则得分为3。
免疫荧光染色
小鼠用氯胺酮/赛拉嗪混合物麻醉,并用4%多聚甲醛经心脏灌注;在0.1M PBS(PFA Sigma公司,圣路易斯,MO,USA),如先前所描述30。取出大脑并在4%PFA中固定过夜,然后在4°C下转移到4%PFA中的30%蔗糖中48小时。使用HM525 NX低温恒温器(Thermo Fisher Scientific,Scoresby,VIC,Austrailia)收集自由漂浮的矢状小脑切片(厚30μm),然后用0.1 M PBS洗涤,然后用0.5%BSA和0.1%Triton X-封闭100在0.1 M PBS中放置1小时。将切片与两种一抗在4°C下孵育过夜。使用了以下一级抗体:抗离子钙结合衔接子分子1(Iba1,1:2,000,和光,大阪,日本),抗神经胶质纤维酸性蛋白(GFAP,1:2,000,Millipore,Billerica,MA,美国) ),抗肿瘤坏死因子α(TNFα,1:500,Abcam,Cambridge,UK),抗白介素1 beta(IL-1β,1:500,Abcam,Cambridge,MA,USA),抗单核细胞趋化蛋白1(MCP-1,1:100,Abcam,Cambridge,UK),抗巨噬细胞炎性蛋白1 alpha(MIP-1α,1:100,R&D Systems,Minneapolis,MN,USA),抗calbindin-D-28K(Cal-D28K,1:500,Sigma,St.Louis,MO,USA),抗切割的caspase-3(1:400,Cell Signaling,Beverly,MA,USA),抗集群分化86(CD86,1:200,Invitrogen,Carlsbad,CA,USA)和抗分化206簇(CD206,1:200,R&D Systems,Minneapolis,MN,USA),然后与Texas Red-( 1:400,Vector Laboratories,Burlingame,CA)和FITC标记的IgG抗体(1:400,Jackson ImmunoResearch,West Grove,PA),并用DAPI(Sigma)复染。用Vectashield固定介质(Vector Laboratories,Burlingame,CA)固定载玻片。在显微镜下检查染色的切片(Axio Imager;
蛋白质印迹分析
如先前所述,制备来自小鼠小脑the部的总细胞裂解物以进行蛋白质印迹31。分离小脑ver,将每个组织在裂解缓冲液(58 mM Tris-HCl,pH 6.8; 10%甘油;和2%SDS)中匀浆,加入蛋白酶抑制剂混合物(1:100,Millipore,Burlington,MA,美国) )和磷酸酶抑制剂鸡尾酒(1:100,Cell Signaling Technology)。通过离心清除裂解物,并使用BCA试剂盒(Bio-Rad Laboratories,Hercules,CA,USA)测定蛋白质浓度。使用凝胶电泳分离蛋白质,并使用电泳转移系统(Bio-Rad Laboratories)将其转移到PVDF膜上。将膜与以下一抗在4°C下孵育过夜:抗离子钙结合衔接子分子1(Iba1,1:1500,Wako,大阪,日本),抗神经胶质纤维酸性蛋白(GFAP,1:2,000,美国马萨诸塞州比勒里卡密理博)000,美国加利福尼亚州圣克鲁斯)。在偶联辣根过氧化物酶(HRP)的二抗(Amersham Biosciences,Piscataway,NJ,美国)中孵育后,使用增强的化学发光西方印迹检测试剂(Amersham Biosciences)开发了印迹。对于半定量分析,通过ImageQuant LAS 500成像仪(GE Healthcare Life Science)测量条带密度。使用Multi Gauge V3.0软件计算每个蛋白质条带的强度,并针对相应的β-肌动蛋白条带进行强度标准化。西方乐队的图像代表人物。所有图像的全长印迹显示在补充图中。使用增强的化学发光蛋白质印迹检测试剂(Amersham Biosciences)显影印迹。对于半定量分析,通过ImageQuant LAS 500成像仪(GE Healthcare Life Science)测量条带密度。使用Multi Gauge V3.0软件计算每个蛋白条带的强度,并将其标准化为相应的β-肌动蛋白条带的强度。西方乐队的图像代表人物。所有图像的全长印迹显示在补充图中。使用增强的化学发光蛋白质印迹检测试剂(Amersham Biosciences)显影印迹。对于半定量分析,通过ImageQuant LAS 500成像仪(GE Healthcare Life Science)测量条带密度。使用Multi Gauge V3.0软件计算每个蛋白质条带的强度,并针对相应的β-肌动蛋白条带进行强度标准化。西方乐队的图像代表人物。所有图像的全长印迹显示在补充图中。0软件并标准化为相应的β-actin谱带。西方乐队的图像代表人物。所有图像的全长印迹显示在补充图中。0软件并标准化为相应的β-actin谱带。西方乐队的图像代表人物。所有图像的全长印迹显示在补充图中。2。本研究中使用的所有抗体均在Suppl中进行了描述。表S1。
统计分析
所有统计分析均使用SigmaPlot软件12.0版(Systat软件,加利福尼亚州圣莱安德罗)进行。数据描述为平均值±标准差(SD)。使用单向方差分析(ANOVA),然后通过Tukey事后检验对组之间进行多次比较,或者在某些情况下使用Mann–Whitney U统计量和双面成对t检验来比较两组来确定统计显着性。
|
|