单细胞分析揭示了成纤维细胞的异质性以及成纤维细胞和壁细胞鉴定和鉴别的标准
单细胞分析揭示了成纤维细胞的异质性以及成纤维细胞和壁细胞鉴定和鉴别的标准
成年脊椎动物中许多重要的细胞类型具有间充质来源,包括成纤维细胞和血管壁细胞。尽管它们的生物学重要性是无可争议的,但是尽管器官内和器官之间的间充质细胞异质性水平得到了认可,但尚未进行详细分析。在这里,我们比较了四个鼠类肌肉器官(心脏,骨骼肌,肠和膀胱)中成纤维细胞和血管壁细胞的单细胞转录谱。我们揭示了从壁细胞中划定成纤维细胞的基因表达特征,并为细胞亚型鉴定提供了分子特征。我们观察到在成纤维细胞中明显的器官间和器官内异质性,主要反映了细胞外基质成分表达的差异。成纤维细胞亚型定位于离散的解剖位置,从而提供有关生理功能和调控信号传导回路的新颖预测。我们的数据为定义不明确的细胞类别的多样性提供了新的思路,并为进一步了解它们在生理和病理过程中的作用提供了基础。
介绍
成纤维细胞最初是在1800年代中期由Virchow 1和Duvall 2观察到的,是大多数哺乳动物器官3的纤维状或疏松结缔组织中包埋的细胞。在这里,成纤维细胞有助于细胞外基质(ECM)的形成和周转,从而为组织提供不同的拉伸性能和含水量4。成纤维细胞也有重要的病理生理和病理功能,例如,在伤口收缩和组织纤维化5,6,7。但是,匿名的形态和缺乏特定的分子标记使驻留的组织成纤维细胞难以研究8与其他结缔组织细胞类型不同,例如成骨细胞/细胞,软骨细胞,脂肪细胞和血细胞。因此,器官内和器官之间的成纤维细胞异质性仍未得到充分探索。目前还不清楚密切相关的成纤维细胞是如何与血管壁细胞(血管平滑肌细胞(SMC)和周细胞)4,9,10,11,其,血管提供稳定性,收缩性和弹性,在几个大血管和微血管的失调疾病12,13。
为了使某些问题更加清晰,我们在这里使用单细胞RNA测序(scRNAseq)分析了小鼠四个不同器官的成纤维细胞,周细胞和SMC。选择器官(心脏,骨骼肌,结肠和膀胱)来容纳带有或不带有粘膜衬里的不同类型的肌肉,从而涵盖可能反映成纤维细胞和壁细胞功能差异的生理环境和需求。我们的研究提供了成纤维细胞和壁细胞原型和亚型的分子指纹,并揭示了在器官特征和解剖位置方面广泛的器官间和器官内异质性,暗示了不同的生理专长。通过解码哺乳动物体内某些鲜为人知的血管和结缔组织细胞类型的复杂性,
结果
基因表达区分壁细胞中的成纤维细胞
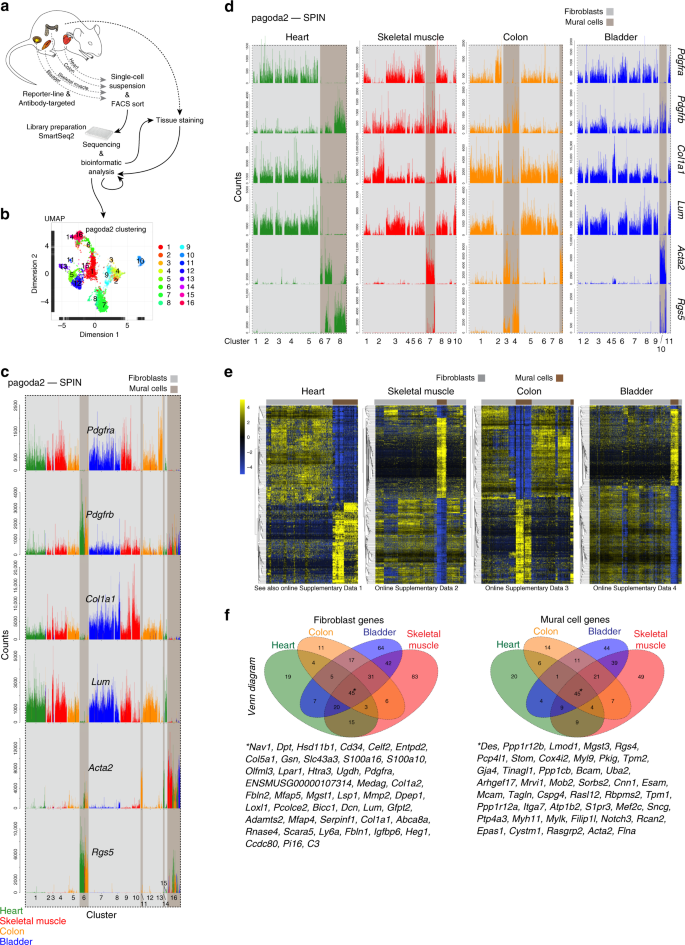
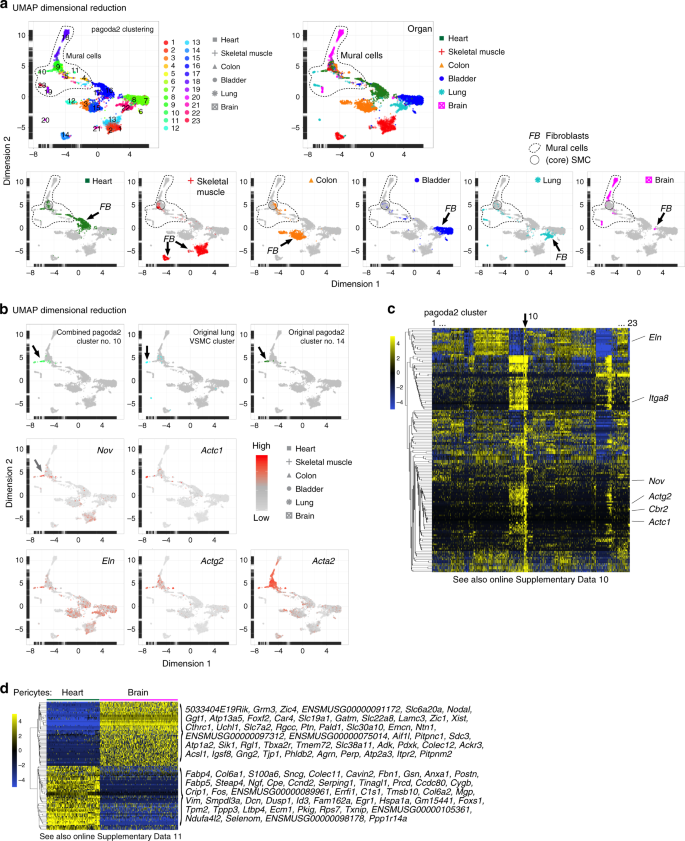
根据报告子和/或血小板源性生长因子受体-α(Pdgfra)和/或-β(Pdgfrb)的抗体识别表位的表达,从成年小鼠心脏,骨骼肌,结肠和膀胱中收集细胞,硫酸软骨素蛋白聚糖4(Cspg4)和平滑肌肌动蛋白α-2(Acta2)。这些标记是公知的是在间充质细胞,包括成纤维细胞和周细胞中广泛表达11,14,15。使用SmartSeq2协议16从总共6158个细胞中生成单细胞转录组(图 1a,补充图 1a)。),并使用pagoda2和SPIN算法分析17,18,19,生成主柱状图的图表和UMAP(统一歧管近似和凸起)20的可视化图(图 1b中,补充图 1B,C)。
一个研究大纲。b完整数据集的Pagoda2聚类(16个聚类)叠加在UMAP降维可视化上。c柱状图显示了16个pagoda2簇的单个细胞(条形)中典型成纤维细胞和壁细胞标志物的表达,每个簇中的细胞顺序由SPIN确定。d与c中相同的数据,但在每个器官中分配了pagoda2簇,并在各个器官中分别对细胞进行了SPIN定位(相应的UMAP 参见补充图 2a)。Ë表达的热图(蓝色,低;黄色,高)是表示每个相应的数据集器官成纤维细胞和壁细胞之间的最差异表达的基因(用于可缩放图像,请参阅在线补充DATAS 1 - 4)。f各个器官内差异表达基因的维恩图。中号/星号:这四个器官共有的标志物清单(另见补充表 1)。
基于在脑脉管系统为成纤维细胞建立的标记和附壁细胞类型11,13,我们首先分配成纤维细胞和壁细胞原型的预备的注释中表示的所有四个器官和出16个不同的簇,12个由成纤维细胞的组合数据集,和4个壁画细胞(图 1c,补充数据 1)。在每个器官中还分别分配了不同的成纤维细胞和壁细胞簇(图 1d,补充图 2a,b,补充数据 1)。UMAP可视化证实了pagoda2-SPIN的聚类结果,可在所有器官中实现壁画细胞和成纤维细胞的明显分离(补充图。 2c)。
接下来,通过差异表达分析为每个器官生成了全基因组的成纤维细胞和壁细胞特异性标记物列表。我们用于基因资格严格的标准,包括高表达水平和特异性,以适合用于免疫组织化学和原位RNA杂交分析(图精确标记。 1E ;补充DATAS 1 - 4 ;这些和所有下面的补充数据文件是在可访问的[ https://betsholtzlab.org/Publications/FibroblastMural/database.html ]。我们在器官特异性列表中搜索了常见表达的基因(图 1f),以产生可区分成纤维细胞和壁细胞的公认通用标记物的简短列表。通过这种方式,我们发现富含纤维原细胞和壁细胞的基因分别有12.1%(372个中的45个)和15.9%(283个中的45个)重叠在所有四个器官之间(图 1f)。常见的成纤维细胞标志物入围名单包括许多ECM基因,例如Col1a1,Col1a2,Col5a1,Loxl1,Lum,Fbln1和Fbln2,以及细胞表面受体Cd34和Pdgfra。重要的是,该列表不包含经常使用的标记成纤维细胞特异性蛋白1(FSP1 akaS100A4)3,21。壁画细胞入围列表包括已知的壁画细胞标记Des,Mcam,Tagln和Notch3,但不包括常用的标记Pdgfrb和Anpep(CD13)13。这些数据确定了基因表达特征,这些特征将成纤维细胞与跨器官的壁细胞区分开来,并用几种常用标记物精确定位了歧义。值得注意的是,没有任何一个转录本可以作为特定的泛成纤维细胞或泛壁细胞标记。例如,壁画细胞中缺失的Pdgfra在大多数(尽管不是全部)成纤维细胞亚型中表达(图 1d)。同样,成纤维细胞中缺失的Rgs5在周细胞中表达,但在某些SMC群体中缺失(图 1d)。考虑到它们之间的密切关系,缺乏区分细胞成纤维细胞类和壁细胞类的通用特异性标记可能并不完全令人惊讶,但是当选择适合通过原位表达分析区分细胞类型的标记时,相对特异性仍然至关重要。总之,理想的是从90个基因的短名单(图1f)中理想选择几个标志物组成的分子标记, 以牢固而普遍地区分成纤维细胞和壁细胞。标记物的完整列表可在补充表 1中找到。并且可以在https://betsholtzlab.org/Publications/FibroblastMural/database.html中逐个基因地进行搜索。
成纤维细胞异质性反映了不同的ECM特征
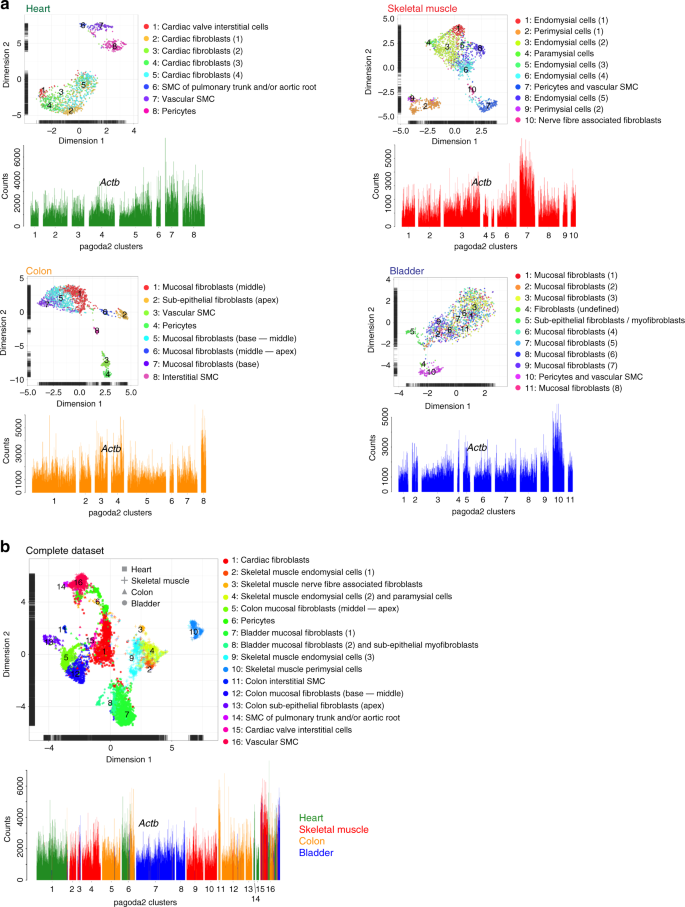
UMAP图中成纤维细胞簇的分散表明高度的成纤维细胞异质性(图 2a,补充图 3a)。这种异质性主要归因于器官特异性差异(图 2a),这一结论得到了pagoda2簇分配的支持(图 2b)。用两种方法覆盖UMAP景观顶部的16个pagoda2簇显示出一致的细胞类型分类(图 2b)。)。由于单细胞数据的聚类可能部分反映批次和细胞损伤诱导的数据偏斜,因此将聚类与标记基因表达的不同区别结合起来很重要。实际上,针对16个pagoda2簇中每个簇的前50个标记基因的分布确定了成纤维细胞亚型,反映了器官型以及器官内异质性(补充图 3b,补充数据 5)。在所有分析中,尽管壁画细胞包括两种具有明显不同的细胞解剖结构的细胞类型(周细胞和SMC),但壁画细胞似乎比成纤维细胞更为均匀(图 2a,b)。
完整数据集的 UMAP可视化,分别为各个原始器官进行颜色编码。指出了含有壁细胞或成纤维细胞的细胞云。b为原始器官或pagoda2聚类结果编码的UMAP可视化颜色。c UMAP可视化,使用受限制的基因集颜色编码,该颜色集编码为原始器官的组合或pagoda2聚类结果。指示了包含壁细胞的细胞云(另见补充数据 2)。
为了了解是否有任何特定类别的基因/蛋白质是观察到的成纤维细胞异质性的主要驱动因素,我们调查了不同基因类别对总体UMAP分散的贡献。这些类别所含转录因子11,22与所述基因本体论(GO)术语“骨架”,“细胞活化”,“细胞表面受体的信号传导途径”“细胞因子刺激的细胞应答”相关联和基因,“细胞-细胞信号”或“ ECM”,后者与Matrisome Project 23(http://matrisomeproject.mit.edu)中编译的基因互补(图 2c)。每个基因类别都包含913–2603个基因,其中590–1940个基因在我们的数据集中表达(补充数据 2)。ECM +母体基因组是成纤维细胞异质性的最有力驱动因素,如UMAP景观中的分散程度所表明(图 2c,补充图 3c;这些差异的分子细节在补充图中提供)。 。 3D和补充数据 6)。“细胞表面受体信号传导途径”和“细胞-细胞信号传导”的基因组导致细胞分散类似于使用所有基因获得的细胞分散,而“转录因子”,“细胞对细胞因子刺激的反应”和“细胞活化”导致在UMAP可视化中的散布更加有限,表明这些基因类别对观察到的成纤维细胞异质性的贡献较弱(图 2c)。“细胞骨架”基因组将SMC和周细胞的一个子集与其余细胞分开。这些细胞是α平滑肌肌动蛋白(αSMA,Acta2)阳性,这表明,与预期的一样,独特的细胞骨架成分与赋予某些收缩特性的细胞有关(图 2c,补充图 3e)。总之,强大的成纤维细胞多样性主要反映了ECM生产和维持方面的差异,这表明成纤维细胞以器官和位置特定的方式调整ECM的生产。
成纤维细胞亚型定位于不同的解剖位
单细胞成纤维细胞转录组不仅表明器官间,而且还表明器官内异质性,同样以ECM /基质为主要驱动力(图 2a–c)。因此,一个重要的问题是这些成纤维细胞亚型是否在每个器官内占据不同的解剖位,在这些位点上它们贡献了利基特异性的ECM,或者它们是否对相同的利基贡献了互补的ECM成分。为了解决这个问题,我们将成纤维细胞亚型定位在它们各自的器官内。
骨骼肌
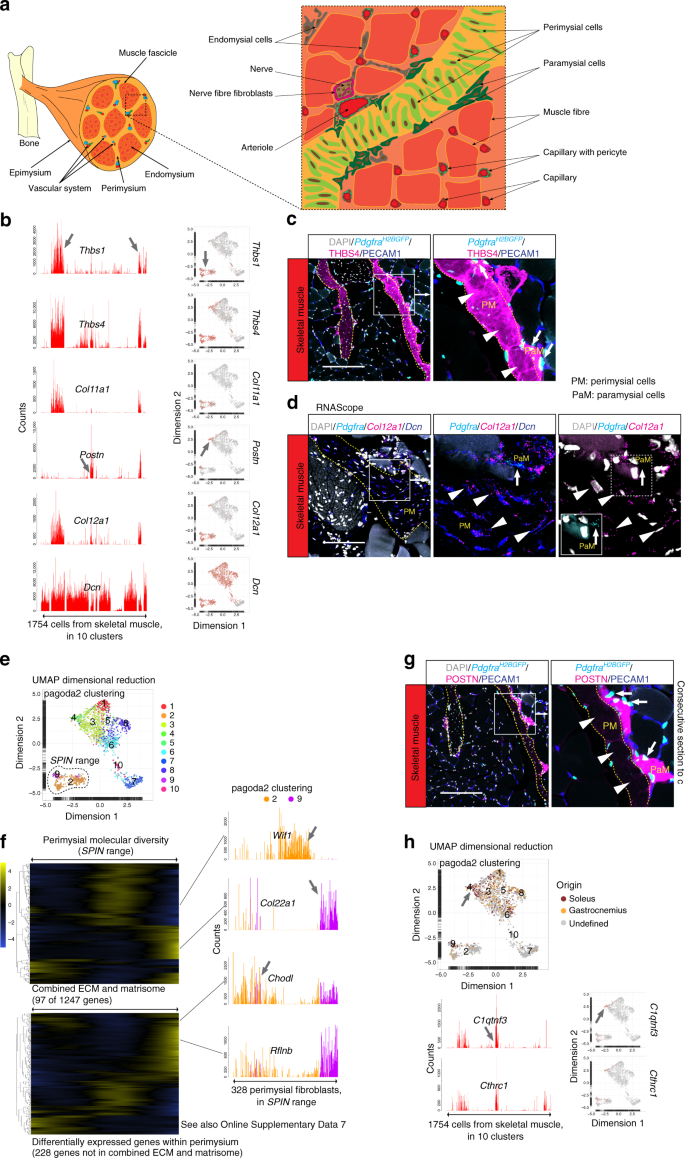
骨骼肌窝藏结缔组织和ECM的复杂布置24,25。内层肌层包围着单个的肌肉细胞(纤维),包膜层包围着成群的纤维(束),而上皮层包围着整个肌肉头(图 3a)。与肌膜内膜和肌膜上膜25相比,肌膜上膜与肌腱26是连续的,并且表现出更高的I型与III型胶原比例。但是,它不能很好地理解不同的成纤维细胞亚型是否居住在这些不同的组织层,如果是这样,什么ECM和蛋白多糖成分他们生产的27,28。
骨骼肌解剖的示意图。b条形图和UMAP可视化(灰色,低;红色,高表达)显示了具有细胞亚型特异性表达的基因的示例(箭头)。c Pdgfra H2BGFP报告基因系对THBS4和PECAM1 的骨骼肌进行免疫荧光染色。d RNAscope染色的Pdgfra,Col12a1和Dcn。È UMAP可视化pagoda2簇注释和细胞的指示与具体分析SPIN。F表达表达热图(黄土平滑(局部加权散点图平滑)值;蓝色,低;黄色高)在ECM +体细胞基因组(上部)和228个其他基因(肌层细胞SPIN范围)中见97个基因(见下)以及在线补充数据 7)。条形图显示了基于pagoda2聚类(#2、9)进行颜色编码的肌周差异表达基因(箭头;Wif1,Col22a1,Chodl和Rflnb)的示例。g POSTN和PECAM1的Pdgfra H2BGFP报告基因系的骨骼肌的免疫荧光染色(c的连续部分))。箭头:肌周细胞(PM);箭头:副肌细胞(PaM)。h UMAP可视化,根据肌肉亚型(比目鱼,腓肠肌或未定义)对细胞起源进行颜色编码,并标注宝塔2簇。箭头指示宝塔2簇4,该簇富含从比目鱼肌中特异性捕获的细胞(上图)。条形图和UMAP显示了群集四个富集基因的示例(箭头;C1qtnf3和Cthrc1)。比例尺:c,g 200 µm,d 100 µm。
骨骼肌成纤维细胞簇中的两个表现出高表达血小板反应蛋白(THBS)-1和-4,以及XI型胶原α-1(Thbs1 + Thbs4 + Col11a1 +)(图 3b)并伴有III型低表达胶原α-1(Col3a1)和Pdgfra(补充图 4a),表明这些簇代表了肌周细胞。THBS4免疫荧光主要将这些细胞定位在筋膜结构上(图 3c),证实了它们的肌周身份和有关THBS4在骨骼肌中表达的先前结果29。膜周细胞表达与肌腱和软骨发育相关的几种基因,例如Col12a1,结缔组织生长因子(Ctgf),Col11a2,腱生蛋白C(Tnc),巩膜(Scx)和腱生调节蛋白(Tnmd)(图 3b,d,补充图 4a)。有人提出,perimyiumium是异质的24。因此,我们观察到了肌周细胞簇内的分子多样性,例如Wif1(WNT途径的抑制剂),Col22a1的表达(胶原蛋白建议存在于肌腱连接处,并且对于其稳定很重要)30,Chodl(软骨素)和Rflnb(refilin B)存在于不同的周围细胞膜细胞中(图 3e,f,补充图 4b)和差异表达在肌周细胞的SPIN范围内的大量成熟和非成熟基因的表达(图 3f,补充数据 7)。这种异质性在多大程度上反映了不同的肌周细胞亚型/状态的不同解剖位置,尚待研究。除了肌周细胞,我们还发现了第二个Thbs4 +骨骼肌成纤维细胞亚型(宝塔2簇4),Thbs1 低Thbs4 + Col11a1 低,并进一步表达Pdgfra和骨膜素(Postn)(图 3b,补充图 4a)。POSTN免疫荧光法将这些细胞定位在肌层和内膜之间的界面上(图 3g),由于这种独特的定位和独特的基因表达谱,我们将这些细胞称为副肌层细胞。在实验中米。比目鱼和米 腓肠肌分别进行处理,副肌细胞(也由C1qtnf3和Cthrc1)从比目鱼支原体中捕获较多(图 3h),表明成纤维细胞亚型的丰度可能在肌肉之间有所不同。尽管副肌细胞与肌周细胞共表达几种基因(Thbs4,Col12a1,C1qtnf3和Cthrc1),但它们在UMAP中的分布更接近于肌内膜细胞(图 3b,h),形成了五个pagoda2簇(#1、3, 5、6、8)在UMAP环境中具有有限的分散性(补充图 2a))。我们预期这些簇除了包含肌内膜成纤维细胞外,还包含成纤维细胞生成祖细胞和血管周围成纤维细胞,但这需要进一步的分析。最后,我们在骨骼肌(pagoda2簇10)中发现了由Cspg4,Pdgfra和神经生长因子受体(Ngfr)的表达定义的另一种成纤维细胞亚型(补充图 2a,补充图 4a,c)。这些细胞位于通常靠近主要血管的神经纤维的边缘(补充图 4c)。总的来说,这些数据揭示了骨骼肌中特定的成纤维细胞亚型,具有明显的解剖位置。
心
心脏缺少肌层周围ECM层(图 4a)。尽管如此,我们发现了一种心脏成纤维细胞亚型(pagoda2簇1),其与骨骼肌周肌细胞具有明显的转录相似性,包括Wif1和软骨寡聚基质蛋白(Comp)的共同表达(补充图 5a)。WIF1和CYP2E1免疫荧光法和Wif1 RNAscope将这些细胞定位于心脏瓣膜及其相邻的铰链区(图 4b–d,补充图 5b)。这些成纤维细胞有可能相同的一个或多个最近描述的心脏瓣膜的间质细胞类型31,32。我们在骨骼肌周围肌和心脏瓣膜间质细胞中发现了10个普遍富集的基因,包括Thbs1,Comp和Fmod(纤维调节蛋白)(图 4e,f,补充表 2),这些相似性可能反映了与ECM抗张强度有关的常见功能。与骨骼肌内膜肌细胞相似,大多数心脏成纤维细胞分布在UMAP景观中分散有限的四个pagoda2簇(第2-5个簇)中(补充图 2a)。该主要的心脏成纤维细胞群中的假定异质性及其与骨骼肌内膜肌和血管周成纤维细胞的相似性有待进一步研究。
一个心脏解剖的示意性描绘。b条形图和UMAP可视化(灰色,低;红色,高表达),显示了细胞亚型特异性表达的示例(箭头)。c从Pdgfrb GFP报告基因行对WIF1,NG2和PECAM1进行的心脏免疫荧光染色,重点是心脏瓣膜和铰链区。d RNAscope染色PDGFRA,WIF1,和DCN,集中在心脏瓣膜区域。箭头:瓣间质细胞;箭头:周细胞;HR:铰链区,V:瓣膜小叶。比例尺:100 µm。Ë维恩图显示骨骼肌周围肌和心脏瓣膜间质细胞共富集的基因。f以柱状图和UMAP表示的共富集基因的示例(灰色,低;红色,高表达)。星号:通常富集的基因的基因清单(另见补充表 2)。
结肠
结肠粘膜缺乏绒毛,但拥有数百万规则排列的隐窝(图 5a)。因为沿着间充质隐窝-绒毛轴分子异质性在小肠绒毛被证实33,34,35,我们询问类似的间充质隐窝面轴(从底部到顶部)可以在结肠粘膜中定义。确实,我们发现结肠成纤维细胞的不同亚群在基因表达(图5b)和隐窝表面轴的定位方面有所不同 。细胞中表达TNC,但不是CD34(TNC + CD34 -)立即定位在表面上皮下(图 5c,d,补充图 6a)。相反,Tnc - Cd34 +成纤维细胞位于固有层和肌层粘膜的更深处(外层肌层中的Tnc表达可能起源于该层的SMC)(图 5e,f)。该TNC - CD34 +成纤维细胞群可能是类似于有牵连的上皮干细胞的维持最近描述隐窝基质细胞36,以及先前描述的“Wnt配体分泌的间充质-细胞37,38。的本地化 TNC + CD34 -在隐窝的顶点的成纤维细胞被白介素33受体确认(IL33R,由编码 IL1RL1)用免疫荧光共定位 PDGFRA +和COX-2 +( PTGS2)(补充图 6B)细胞之前已经显示出其位于隐窝 39的顶点。这两个主要成纤维细胞群也不同相对于BMP和WNT信号传导途径的组分,其是上皮分化重要在结肠的表达 40,41。顶点 Tnc +CD34 -成纤维细胞中特异性表达的BMP配体(BMP2,BMP5,和BMP7),而TNC - CD34 +在隐窝基底部的成纤维细胞表达的Wnt配体(Wnt2的和WNT2B)和受体; 卷曲的类受体1(Fzd1),Fzd4和分泌的可溶性可溶性卷曲的相关蛋白1(Sfrp1)(补充图 7a,b,补充数据 8)。有趣的是,先前描述的叉头箱L1(Foxl1)转录因子在肠道发育中起重要作用42,是隐窝先端成纤维细胞富集的基因之一,这是通过RNAscope原位RNA杂交证实的(补充图 7b,c)。总而言之,这些观察结果表明,成纤维细胞有助于结肠的间充质隐窝表面轴,这种间充质分化可能对上皮动态平衡至关重要 43。
膀胱
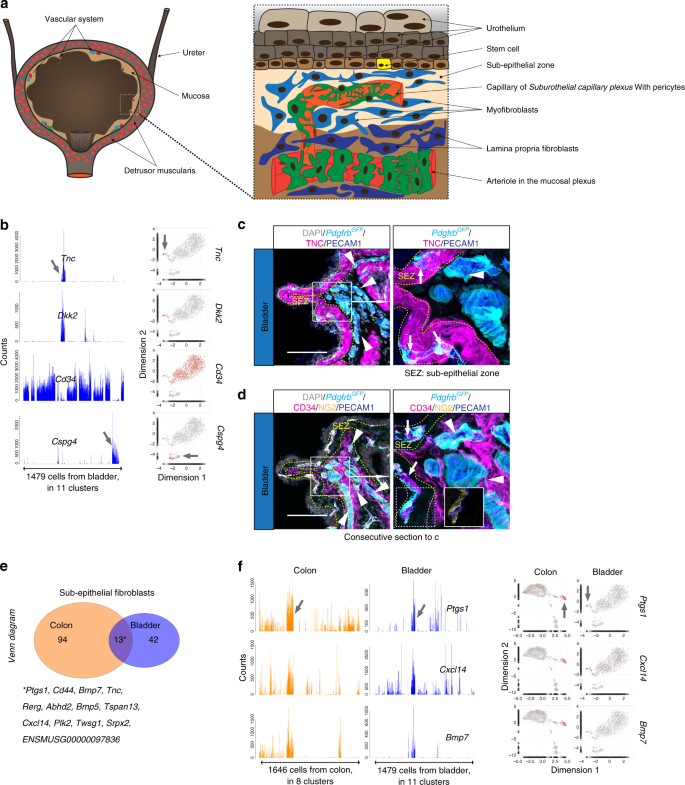
膀胱具有类似于在这个意义上,上皮细胞(上皮)细胞层驻留在含有间充质粘膜的顶结肠的解剖结构中,一起形成逼尿肌肌层的内衬44,45(图 6A)。如在结肠,膀胱粘膜还包含成纤维细胞通过定义亚型TNC + CD34 -和TNC - CD34 +签名(补充图 8A)。该TNC + CD34 -成纤维细胞位于立即下伏尿路上皮,而跨国公司- CD34 +成纤维细胞位于膀胱粘膜的更深处(图 6b-d,补充图 8b,c)。结肠和膀胱成纤维细胞亚型表现出额外的跨器官相似性。13个通常富集基因结肠和膀胱发现TNC + CD34 -成纤维细胞,包括PTGS1,BMP5,BMP7,和CXCL14(图 6E,F,补充图 8C,补充表 3)。我们还发现Col8a1在结肠和膀胱肌层以及黏膜区域表现出相似的表达模式(补充图。 8d)。尽管有这些相似之处,但结肠和膀胱成纤维细胞仍显示器官型特征。例如,膀胱但不是结肠TNC + CD34 -成纤维细胞中表达ACTA2,可能表明在生理收缩(补充图差异 8C)。此外,子尿路上皮TNC + CD34 -成纤维细胞中表达BMP2和BMP3除了BMP5和BMP7(补充图 8C)。总之,这些数据揭示了结肠和膀胱成纤维细胞之间的重要相似性和器官型差异。
一个膀胱解剖的示意性描绘。b条形图和UMAP可视化(灰色,低;红色,高表达)显示了具有细胞亚型特异性表达的基因的示例(箭头)。c,d对c TNC或d CD34,NG2和PECAM1的Pdgfrb GFP报告基因系的膀胱样品进行免疫荧光染色。箭头:上皮下区的毛细血管,被TNC +成纤维细胞包围,箭头:深层粘膜中的大垂直血管,被CD34 +成纤维细胞包围。比例尺:100 µm。连续部分用于c和d。Ë的维恩图TNC + CD34 - (皮下成纤维细胞)富集来自结肠和膀胱的基因。f常见的上皮下成纤维细胞富集基因的实例以条形图和UMAP表示(灰色,低;红色,高表达)。星号:通常富集的基因的基因清单(另见补充表 3)。
壁细胞的异质性低于成纤维细胞
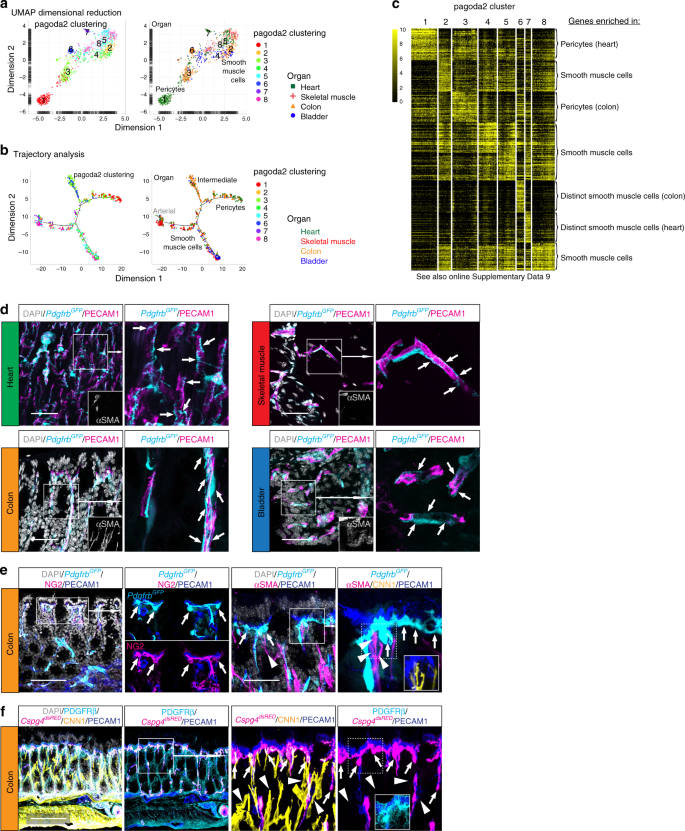
在四个被分析器官之内和之间,壁细胞的异质性都比成纤维细胞低得多(图 1c,d和2a)。所有细胞的Pagoda2聚类将壁画细胞分为四个不同的簇(图1b,c中的#6、11、14和16 ),并且进一步单独分析壁画细胞将它们分为八个簇(图 7a)。在UMAP可视化的空间分布表示从周细胞到SMC逐渐表型转化,由标记基因的表达例举ACTA2,MYH11,RGS5,和Kcnj8 46,47(图 7a中,补充图 9a,补充数据 1)。观察到较小的器官特异性聚集或空间分散,尤其是在Acta2 + SMC之间(图 7a,补充图 9a)。通过使用单片眼镜的轨迹分析,证实了由pagoda2聚类和UMAP可视化指示的周细胞和SMC之间的表型连续体(图 7b)。该分析揭示了周细胞的一个主要分支,一个可能的中间分支和两个SMC分支(图 7b,补充图 9b)。类似于UMAP,轨迹分析表明高度的跨器官壁细胞同质性。对每个簇的前50个标记基因进行的热图分析支持了周细胞(#1,3)和SMC(#2,4,5,8)簇之间的相似性,而簇6和7代表了源自壁细胞的壁细胞结肠或心脏分别显得更明显(图 7c,补充数据 9),这与它们在UMAP中的单独分布一致(图 7a)。我们发现Hhip和Rgs10在簇6的结肠细胞中特异性表达(补充图 9c)。HHIP免疫组化显示,这些细胞是Acta2阳性,而Cspg4和Pdgfra阴性,对应于位于结肠粘膜层内部的SMC(补充图 10a)。这些粘膜SMC不与血液或淋巴管相关,而是从粘膜基部延伸至其表面,类似于位于小肠绒毛48中的与乳脂相关的SMC (补充图 10a)。最后,如下所述,簇7中的心脏壁细胞是Sost + Cbr2 +(补充图 9c),并且与来自肺的SMC有关。
壁细胞数据集的 UMAP可视化,为pagoda2聚类进行颜色编码和注释(左),为原器官进行颜色编码,为pagoda2聚类进行颜色注释(右)。b为宝塔2簇(左)或起源器官(右)用颜色编码的壁画数据集的轨迹分析图。c簇富集基因的表达热图(黑色,低;黄色,高)(另请参见在线补充数据 9)。d来自Pdgfrb GFP报告基因谱系所有四个器官的样品,用αSMA和PECAM1的免疫荧光染色。箭头突出显示周细胞及其在器官特异性毛细管处的形态分布。比例尺:50 µm。ËNG2(Cspg4)和PECAM1(左图)或αSMA,CNN1和PECAM1(右图)的Pdgfrb GFP报告基因系结肠样品的免疫荧光染色。f来自Cspg4 dsRED报告基因系的结肠样品对PDGFRβ,CNN1和PECAM1的免疫荧光染色。箭头突出显示位于上皮下毛细血管环的结肠周细胞,箭头指示αSMA + CNN1 +,但Cspg4(NG2)-间质SMC。比例尺:e 100 µm(左面板f),50 µm(e右面板)。
所有四个器官中的Pdgfrb GFP高细胞均表现出典型的周细胞形态和毛细血管缔合(图 7d)。这些细胞在所有器官中清晰可见且丰富,这与毛细血管中无处不在的周细胞一致,而它们对scRNAseq分析的捕获率在各器官之间明显不同,范围从心脏和结肠的许多周细胞到只有少数(≈10个细胞)来自骨骼肌或膀胱。这些差异的可能解释包括某些器官的周细胞在组织解离过程中更加敏感并死亡,它们更牢固地粘附在内皮细胞上,并在细胞分离过程中被内皮细胞(片段)污染的反选排斥而排除在外,或者它们类似于并最终与静脉SMC聚集在一起(例如,在膀胱中-见下文)。
我们还注意到周细胞定位中的器官特异性差异。结肠周细胞的一个子集始终位于相对于表面上皮的上皮下毛细血管环的远端(图 7e,补充图 10b,补充影片 1和2)。这些周细胞对Pdgfrb GFP +和Cspg4 dsRED +呈强阳性,但对SMC标记αSMA和CNN1弱(图 7e,f)。相反,许多膀胱周细胞表达Acta2 GFP和αSMA(补充图 10c,d),可能与血管解剖学有关:例如,在心脏,骨骼肌或结肠中,膀胱粘膜毛细血管的直径(6.8±1.1 µm)远大于毛细管直径(4.3±0.2 µm)(补充图 10d,e),与这些膀胱周细胞11的静脉SMC样外观相关。两者合计,我们的数据显示,与成纤维细胞相比,周细胞显示出明显较少的跨器官内和器官内异质性,但仍具有器官型特征,如分子指纹和解剖学定位所反映。
与其他器官的比较
scRNAseq的定性性质为比较不同研究者在不同时间点收集的数据提供了可能性。为了研究间充质异质性的一般模式是否也扩展到其他器官,我们将数据与先前发表的来自脑和肺的壁细胞和成纤维细胞数据集进行了整合11。在对六个器官的这种综合分析中,成纤维细胞形成了独特的器官特异性簇,而壁细胞簇更加均一并包含来自多个器官的细胞(图 8a,补充数据 1)。重要的是,许多来自脑和肺的SMC与其他器官的SMC聚集在一起,这表明高度跨器官的SMC与血管的相似性(图 8a))。从心脏(图7和补充图 9c中描述的Sost +和Cbr2 +细胞) 获得的少量SMC 与来自肺11的血管SMC共同聚集(图 8b)。这些SMC显示了许多基因的富集表达,包括细胞通讯因子3(Nov / Ccn3),心肌肌动蛋白α-1(Actc1),弹性蛋白(Eln),平滑肌肌动蛋白γ-2(Actg2)和整合素α。 -8(Itga8)(图 8b,c,补充数据 10),并有可能从心脏的大血管网点,即肺动脉主干和主动脉代表SMC 49,50。从心脏和大脑的两个最丰富的外膜细胞群体的比较发现大量organotypicity(图 8D,补充资料 11),这与我们之前的脑和肺周细胞的比较同意11,51。
一个在心脏,骨骼肌,结肠癌和膀胱的组合分析的UMAP可视化与脑和肺数据集的间充质细胞一起11编码pagoda2簇(上左),颜色或来源的器官(右上)。显示了包含壁细胞和核心SMC的细胞云(下图)。b UMAP可视化突出显示了pagoda2聚类10的细胞(左上),肺VSMC聚类的细胞(中上),原始完整数据集聚类14的细胞(右上)或组合分析富集基因的聚类10的表达水平(Nov,Actc1,Ern和Actg2)以及Acta2(灰色,低;红色,高)。c组合分析的聚类10中富集基因的表达热图(蓝色,低,黄色,高)(另请参见在线补充数据 10)。d心脏与脑周细胞中每个50个差异最大的表达基因的表达热图(蓝色,低,黄色,高)(另请参见在线补充数据 11)。
使用其他数据集,我们测试了90基因签名(图1f)在不同器官中区分成纤维细胞和壁细胞的预测能力 。该签名证实了脑和肺11中的成纤维细胞与壁细胞之间已公开的区别(补充图 11a,补充数据 12和13)。我们接下来施加的90个基因的信号来从塔布拉缪里斯提取的数据52,并再次发现成纤维细胞和周细胞的不同预测(补充图 11B,C,补充DATAS 14 - 21)。因此,具有90个基因的特征似乎能够区分多个器官中的壁细胞和成纤维细胞。
讨论区
尽管在150多年前首次被发现,但成纤维细胞在分子组成,跨器官异质性程度以及与其他间充质细胞类型的关系方面仍保持着星状细胞4。在这里,我们以单细胞分辨率表征来自四个不同肌肉器官的成纤维细胞,并将它们与血管壁细胞进行比较(图9总结 )。我们的数据揭示了在所有器官中定义成纤维细胞的共同标志物,但也揭示了广泛的成纤维细胞器官型以及器官间异质性。虽然没有任何单一标记可以区分所有壁细胞中的所有成纤维细胞,但我们提供了90个基因的签名,能够在本文研究的所有器官以及其他公共数据集中实现这一目的52。因此,该签名可用于解析其他单细胞数据集中的模棱两可的细胞类型注释,以及使用抗体和反义探针的组织分析。
成纤维细胞在体内许多部位都是ECM的重要产生者,但如何在不同器官中产生ECM多样性尚不清楚。我们的转录组数据揭示了成纤维细胞之间广泛的器官间转录异质性,关于在基质23中表达基因的差异特别明显。母体基因表达的差异大于其他基因/蛋白质类别,表明成纤维细胞根据器官特异性生理学专门定制了ECM 53。转录因子在此分析中变化最小的观察结果可能表明表观遗传差异会促进成纤维细胞异质性,这需要进一步研究。
关于基于单细胞转录组学的细胞类型,亚型和/或状态的分类,应记住,分配的簇数在一定程度上是任意的,并且可能反映了实验伪像的引入,例如细胞活化或隔离期间损坏。然而,如本文所进行的,UMAP中的细胞分散和使用相关标记的细胞的解剖学定位的原位作图的组合,应该提供生理学上有意义的注释。例如,八个膀胱成纤维细胞簇在UMAP中形成了一个相互分散的云,这使我们得出结论,这八个簇对应于一种主要的成纤维细胞类型,但是,分子差异很小,导致了多个簇的分配。另一方面,我们还发现了集群内分区的明显迹象,该迹象通常被二维最近邻聚类方法所掩盖,因此需要进行其他分析(例如,通过SPIN)才能识别。我们在沿隐窝表面轴分布的结肠成纤维细胞种群中发现了这一点,而位于隐窝的顶点(粘膜表面)和基底(粘膜底部)的极端状态,逐渐变化和中间表型之间存在明显差异(分区)发生在沿隐窝表面轴的中间位置。
与成纤维细胞相比,血管壁细胞的跨器官异质性明显降低,而SMC表现出的异质性最低,但是,除了两个特殊的SMC群体(结肠间质SMC和进入和流出的大血管主干的SMC)外心。周细胞比SMC更具异质性,并表现出明显的器官型迹象,从而证实了先前从脑和肺中观察到的现象11。不同器官中的周细胞在转运蛋白或SMC收缩机制的组件(如Myh11,Tagln和Acta2)的表达方面有所不同。心脏周细胞显示出低水平或无法检测到的收缩成分,类似于我们先前针对脑和肺的报道11。然而,来自结肠,尤其是膀胱54的周细胞表达了几种SMC收缩标志物。周细胞在各个器官之间也表现出有趣的形态差异。在结肠上皮下毛细血管环上,它们相对于上皮内腔在毛细血管的远侧表现出定型定位,这可能表明局部形态发生提示指示周细胞分化和定位。
成纤维细胞和壁细胞的不同亚型的特征揭示了器官内异质性和跨器官相似性。在骨骼肌中,除了前面描述的肌束膜细胞24,27,我们确定了成纤维细胞的另外的细胞类型:位于的肌束膜筋膜条纹的paramysial细胞。周围和旁肌细胞在ECM成分的表达方面有所不同。在最近的一项研究中发现,肌周细胞与Scx + Tnmd +细胞群在分子上密切相关55但是,建议将其保留在骨骼肌实质中。我们将这些细胞主要映射到肌筋膜。最近在in骨肌腱56中表征的肌腱细胞显示出与肌周膜细胞相似的分子指纹,这与肌周膜与肌腱26连续的观点一致。
横器官相似由肌束膜细胞和心脏瓣膜间质细胞之间的分子相似性举例说明31,32,包括cartilage-和腱相关基因如共享表达WIF1,小样,和FMOD。因此,可以推测,心脏瓣膜钙化32,57和骨骼肌的异位骨化58具有共同的分子决定簇。另一横器官相似视为从心脏(本研究)和肺中分离的SMC的一小口11。这可能暗示了常见的解剖起源(心肺血管干)。
成纤维细胞亚型的分类也揭示了结肠和膀胱之间常见的细胞分区原理。在结肠中,TNC + CD34 -成纤维细胞在隐窝顶点位于接近表面,而TNC - CD34 +细胞位于更深的粘膜区域(隐窝基底部)。类似的区划被揭露在膀胱,其中TNC + CD34 -细胞存在于子尿路上皮间充质,而TNC - CD34 +细胞位于膀胱粘膜深处。结肠癌和膀胱之间的这种组织相似性也延伸到编码BMP和WNT信号传导途径的组分的基因37,59,60。结肠隐窝顶端的成纤维细胞与先前描述的基质细胞群相似,对化学诱导的结肠炎(Str2细胞)的反应性低41。我们发现,转录因子Foxl1,这是肠道发育和维持是重要的42,61,由这些细胞表达。这与最近的报告41一致,但与另一项报告Foxl1的研究形成对比。小肠隐窝基底部干细胞生态位周围的表达62,差异可能反映了小肠和大肠之间的差异。沿隐窝-表面轴的上皮区带得到了很好的理解,并且推测带状上皮细胞和间充质细胞池之间的串扰和相互的信号传导机制很有趣。PDGFRα阳性的间充质隐膜顶细胞在绒毛扩展过程中表现出重要的功能34,并且沿隐膜表面轴的成纤维细胞群可能参与了成年肠道的稳态,干细胞的生态位功能和反应到损伤或损害43,63。结合结合已利用的肠上皮细胞和间充质细胞对配体-受体对的数据集进行的扩展分析,可以进一步揭示在肠的上皮-间质界面起作用的内在信号传导机制以及细胞分区梯度的形成。
成纤维细胞调节异常与多种疾病有关,包括纤维化,癌症,炎症和心血管疾病64。沿着这些线,在型-XII胶原α-1(突变COL12A1)最近被鉴定为造成肌张力低下,肌肉无力,和关节过度活动65,66。我们的发现表明Col12a1在肌周和副肌细胞中高度表达,从而暗示了这些细胞在骨骼肌的结构完整性和功能中的作用。此外,Col12a1由结肠和膀胱固有层的成纤维细胞表达,提示COL12A1突变也可能在这些器官中引起ECM的病理变化。此外,最近在心肌梗塞后的梗塞边界区发现了一个活化的成纤维细胞群,其分子指纹类似于包括Wif1表达在内的肌周围细胞,67。总之,本研究中提供的数据可作为转录存储库提供,网址为[ https://betsholtzlab.org/Publications/FibroblastMural/database.html ],可为重要的但知之甚少且注释不明的间充质细胞类型提供分子身份。这些信息将有助于更好地了解这些细胞类型在健康和各种病理过程中的作用。
方法
动物
所有动物实验均根据瑞典法律和当地动物福利法规进行,并获得Linköpings动物研究伦理委员会[Linköpingsdjurförsöksetiskanämnd]的批准,批准书编号为729。所有动物均饲养在标准的单通风笼中,每笼12只光照– 12 h黑暗周期,并且可以自由饮水和食物。房屋温度保持在20±2°C,相对湿度保持在50±5%。在这项研究中,我们使用了以下小鼠品系:C57Bl6(杰克逊实验室,C57Bl6 / J,在当地动物设施保留为繁殖地),Pdgfrb GFP(Genesat.org,Tg(Pdgfrb- eGFP)JN169Gsat / Mmucd),PdgfraH2BGFP(( PDGFRA TM11(EGFP)索尔),从P.索里亚诺的礼物), CSPG4 的DsRed(杰克逊实验室,TG( CSPG4 -DsRed.T1)1Akik / J), ACTA2 GFP(杰克逊实验室,TG( ACTA2 - GFP)1Pfk), Cldn5 GFP(Tg( Cldn5 - GFP)Cbet / U)和这些菌株的组合。将所有小鼠回交至 C57B16 / J背景。在实验中,使用了10-20周龄的成年雄性小鼠。
从鼠组织中分离单细胞
以下方案适用于所有组织。通过颈脱位使小鼠安乐死,并将感兴趣的器官(心脏,骨骼肌,膀胱,结肠)切开,然后立即放入周围的磷酸盐缓冲盐水(PBS)溶液(DPBS,ThermoFisher Scientific)中。如果是骨骼肌;包括比目鱼肌在内的腓肠肌或分离的两条肌肉均被收获以进行进一步处理。在一种情况下,来自两只小鼠的比目鱼肌(一只Pdgfra H2BGFP和一只Pdgfrb GFP在解离之前将1)合并以制备单细胞悬浮液。然后将组织切成小块,并在解离缓冲液(Miltenyi的骨骼肌解离试剂盒,补充了Sigma的1 mg / ml IV型胶原酶)中于37°C孵育,并在500–800 rpm下水平摇动。从Acta2 GFP分离Acta2阳性细胞在报告小鼠中,将弹性蛋白酶(〜2.5 U / ml,Sigma)添加至解离缓冲液中。将通过移液进行的三到四个物理崩解周期以10分钟的间隔施加到样品上。之后,使细胞悬液依次通过70μm和40μm的细胞过滤器。用5 ml DMEM(ThermoFisher Scientific)洗涤70 µm细胞过滤器。通过以300× g离心5分钟沉淀细胞 ,除去上清液,并将细胞沉淀重悬于FACS缓冲液(PBS中补充有0.5%牛血清白蛋白,2 mM EDTA,25 mM HEPES)。为了进行抗体标记,将细胞悬液与各自的荧光团偶联抗体(抗PDGFRα,抗PDGFRβ和抗CD31)在室温下孵育20分钟,然后在240× g下离心3分钟。 除去上清液,并将细胞沉淀重悬于FACS缓冲液中并置于冰上。
荧光激活细胞分选(FACS)
使用装有100 µm喷嘴的Becton Dickinson FACSAria III或FACSMelody细胞分选仪分析抗体染色的细胞悬液,并将满足以下选择标准的单细胞沉积到384孔板中,其中含有2.3 µl裂解缓冲液(0.2%Triton X -100、2 U / ml RNase抑制剂,2 mM dNTP,1 µM Smart-dT30VN,ERCC 1:4×10 4稀释液)。值得注意的是,通过FACS进行的分析和细胞分选并未用于细胞类型鉴定,而是用于富集和捕获表达目的基因或蛋白质特征的细胞。Pdgfra(PDGFRα)+或Pdgfrb(PDGFRβ)+和Pecam1(CD31)-。用于单细胞分选;首先,围绕当前事件慷慨地设置前向散射区域/侧向散射区域(FCS-A / SSC-A,线性比例)的门,仅排除低值事件(细胞碎片和红细胞)。其次,使用FCS-A / FSC-height和SSC-A / SCC-height进行双重识别,但是对于事件到对角线的距离具有宽泛的阈值,以防止向圆形单元引入偏差。第三,然后分析选定事件的阳性荧光信号,同时使用“荧光减去一个”抗体染色的样品或由缺乏荧光报告基因的小鼠制备的细胞,以确保正确的门控并用作阴性对照。为了富集间充质细胞群,可以使用抗PDGFRα或抗PDGFRβ抗体染色,Pdgfra H2BGFP,Pdgfrb GFP,Acta2 GFP,Cspg4 dsRED,或将小鼠品系的组合与CD31的抗体染色一起使用,以避免细胞双重选择。从上述间充质细胞标记物中也对CD31呈阳性的细胞被排除在该类别之外。在分选之前对板进行短暂离心,同时通过将珠子测试点滴到各个板的密封件上来控制液滴在384孔板中的正确沉积(对准),并在必要时针对每个新板调整板位置板放入机器。FACS机器的样品和板架保持在4°C,分选完成后立即将板放在干冰上,随后在-80°C下保存直至下游处理。
SmartSeq2文库制备和测序
根据先前描述的Smart Seq2协议16制备单细胞cDNA文库。简而言之,使用oligo(dT)引物和SuperScript II逆转录酶(ThermoFisher Scientific)将mRNA转录为cDNA。使用模板转换寡核苷酸合成第二链cDNA。然后通过聚合酶链反应(PCR)将合成的cDNA扩增23–26个周期,具体取决于各个mRNA样品的组织来源。通过在TapeStation 4200或2100生物分析仪上使用DNA高灵敏度芯片(Agilent Biotechnologies)进行分析,对纯化的cDNA进行质量控制(QC)。当样品通过QC时,使用Tn5转座酶将cDNA片段化并标记(标记),并使用Illumina Nextera XT索引试剂盒(A–D组)对每个孔进行唯一索引。之后,
序列数据处理
如上所述,对合并的单细胞cDNA文库样品进行测序。使用Nextera索引适配器应用Illumina管道的标准参数(bcl2fastq),将信号多路分解为单单元fastq文件。那么该个体的fastq文件被映射到鼠标参照基因组GRCm38(MM10),采用与TopHat2或Bowtie1选项Bowtie2 68,69,在这里适配器序列使用修整称誉之前读取的变换去除。使用samtools软件删除了双峰。根据映射位置对生成的包含比对结果的BAM文件进行排序,并使用Subread包70中的featureCounts计算每个基因的原始读取计数。。为了进行技术控制,裂解缓冲液和作图中包含了92个ERCC RNA。
此后,将细胞合并在表达矩阵中,该矩阵显示每个单个细胞的每个基因的原始计数作为输入数据。ENSEMBLE标识符的注释是使用R-software中的org.mM.eg.db软件包(版本3.7.0)完成的,并保留ERCC计数用作数据集中的技术控制。
为了计算表达矩阵的一般属性,应用了SingleCellExperiment R软件包71。低质量细胞的过滤是逐步进行的。从数据集中删除文库大小较小(≤50,000个计数)且表达基因数量较少(≤1500个)的第一个细胞。如有必要,还应删除具有较高百分比的定位到ERCC或线粒体基因(均为> 10%)的读取的细胞。具有大量表达基因(≥10,000)的细胞被去除为潜在的双峰。非表达或低表达基因被去除;基因必须满足鉴定标准:至少在三个细胞中的基因表达计数值> 20,并且累积计数值300才能保留在数据集中。意外收集的既不表达Pdgfra的细胞或Pdgfrb然后从数据集中删除。表现出明显被污染的转录组具有例如内皮细胞或免疫细胞特异性基因特征的细胞也被从数据集中删除。这样就产生了一个最终的数据集,用于分析,该数据集由来自n = 24只不同的雄性小鼠的细胞组成(补充图 1c,补充表 4)。经过测序和质量控制后,构建了6158个单细胞转录组的数据集,包括来自心脏的1279个细胞,来自骨骼肌的1754个细胞,来自结肠的1646个细胞和来自膀胱的1479个细胞,并将其用于生物信息学分析。
该数据集组织在SingleCellExperiment R软件包71中。途径和基因组分析过度分散(pagoda2)R-软件包(https://github.com/hms-dbmi/pagoda2)17施加到执行主分量分析(PCA;使用所述属性NPCA = 100,n.odgenes = 3000)和最近的邻居聚类。对于降维可视化,应用了UMAP函数(UMAP:统一流形近似和投影)20。
为了构建条形图数据库,使用了来自pagoda2的聚类信息。在簇细胞分布SPIN算法18,19,使用每簇1000倍最差别表达的基因(/旋-i input.cef -o output.cef -f 1000 -b两者)施加。将计数值标准化为每个单元500,000个计数库大小,以条形图显示。
为了生成特定于器官的数据集,将如上所述的相同参数用于计算PCA和UMAP,以及pagoda2聚类和SPIN聚簇内细胞分布。
使用单片R软件包72进行差异基因表达分析。使用differentialGeneTest函数和基本选择标准对选定的细胞组进行成对比较:每个细胞100个计数作为基因检测的阈值,每组中≥30%的细胞表达。用于成纤维细胞和壁细胞之间的差异表达分析(图 1e,f),以及用于识别每个器官的特定成纤维细胞亚群(图 4e和图 6e),并且大于等于两倍( log 2)表达差异用于基因选择。用于肌周细胞的分子多样性分析(图 3f,补充数据 7),采用与上述相同的标准,不同的是表达差异大于等于1倍(log 2)用于基因选择。对于补充图3b和图 7c中显示的基因,将 每个聚类与数据集的其余部分进行比较,并为每个聚类选择50个差异最大的表达基因,并在热图中绘制基因(唯一)。使用VennDiagram R软件包(https://CRAN.R-project.org/package=VennDiagram)绘制的维恩图,可视化所选细胞群中差异表达基因的交叉引用。
对于基因类别限制UMAP分析,我们得到的GO-方面的基因列表从MGI服务器(http://www.informatics.jax.org),或已发表作品11,22,23。使用的术语:细胞骨架:GO_0005856,细胞活化:GO:0001775,细胞对细胞因子刺激的反应:GO:0071345,细胞表面受体信号传导途径:GO:0007166,细胞间信号传导:GO:0007267,ECM:GO:0031012 。这些基因列表用于子集SingeCellExperiment对象,以仅保留GO基因列表中表达的基因,从而创建一个新的SingleCellExperiment对象。此后,使用与以前相同的属性重新计算PCA,并使用细胞起源或pagoda2簇隶属关系的元数据进行UMAP可视化。
从MGI服务器收集了WNT(GO:0016055)和BMP(GO:0030509)信号通路基因列表(总共553个基因)。为了对结肠中的WNT和BMP信号通路基因进行分区分析,提取了成纤维细胞簇(1、2、5-7),并使用累积表达> 100的基因计算了SPIN范围。对于结肠的成纤维细胞分区分析(补充图 7b,补充数据 8),由于所有属于BMP和WNT信号通路的基因的总体表达量较低,因此使用differentGeneTest功能将应用的阈值设置为每个细胞用于基因检测的计数为30个计数,每个组中≥25%的细胞计数。此外,将累积计数值≥1000的WNT和BMP信号通路基因保存在结肠成纤维细胞数据集中(66个基因)以进行可视化。然后,使用黄土函数将基因表达计数值拟合到每个基因的平滑曲线上,并在R软件中使用默认参数,并在热图中将其可视化。
免疫荧光染色
应用了免疫染色的标准方法。简而言之,如前所述从安乐死的小鼠中收获组织,并通过在4°C下浸入4%甲醛中4-12小时固定,然后在4°C下浸入20%蔗糖/ PBS溶液中至少24小时来固定。之后,将组织包埋以进行冷冻切片,然后在CryoStat NX70(ThermoFisher Scientific)上切片,以SuperFrost Plus载玻片(MetzlerGläser)收集的14或30μm厚的切片进行切片。将切片保存在-80°C。为了染色,将切片在RT解冻。解冻后,将切片在室温下用封闭缓冲液(无血清蛋白质封闭溶液,DAKO)封闭,并用0.2%Triton X-100(Sigma Aldrich)进行封闭> 60分钟。之后, 5)根据制造商的建议。当用10 µg的Hoechst 33342(三盐酸盐,三水合物,ThermoFisher Scientific)施用含有4,6-二mid基-2-苯基吲哚(DAPI,ThermoFisher Scientific)的ProLong®Gold固定介质或不带DAPI的ProLong®Gold来固定切片。 / ml以及二抗。使用Leica TCS SP8共焦显微镜(Leica Microsystems)获得显微照片。对图像进行图形处理,并使用ImageJ / Fiji软件73调整亮度和对比度。除非另有说明,否则在图中显示获取的z堆栈的最大强度投影。
RNA原位杂交(RNAscope®)
对于原位杂交,根据制造商的规程使用RNAscope®系统(Advanced Cell Technologies)。简而言之,如前所述获得组织切片(免疫荧光染色)。脱水后,将切片与Pretreat 4溶液在室温温育30分钟。然后,将RNAscope®探针(补充表 5)在40°C下在切片上杂交2 h,然后根据制造商的建议应用荧光检测方案(Amplification-FL)。切片用ProLong®Gold固定介质固定。如上所述获取显微照片并进行处理以进行可视化(请参阅免疫荧光染色)。
毛细管直径定量
为了定量测定毛细管直径,使用了来自抗PECAM1染色的组织切片的显微照片的最大强度投影(请参见免疫荧光染色)。对于结肠,上皮下毛细血管环由于其专门的定位/特性而被排除在测量范围之外。使用ImageJ / FIJI软件中的管线工具测量毛细管直径。首先,计算每张显微照片的平均直径。其次,计算每只小鼠的平均直径,然后将其用作p值计算的一个生物学重复(n)。采用单向ANOVO与Tukey检验进行多次比较,以确定统计显着性。
|
|