皮质酮通过Mfn2介导的MAVS泛素降解影响干扰素-β反应
皮质酮通过Mfn2介导的MAVS泛素降解影响干扰素-β反应
尽管已知压力会增加病原体感染的易感性,但其潜在机制仍然难以捉摸。在这项研究中,我们报道了束缚压力显着提高了感染流感病毒(H1N1)的小鼠的发病率和死亡率,并明显加重了肺部炎症。皮质酮(CORT)是啮齿动物中的糖皮质激素的主要类型,被分泌在应激小鼠的血浆中。我们进一步发现,这种应激激素通过限制线粒体抗病毒信号(MAVS)蛋白转导的IFN-β产生而不会影响其mRNA水平,从而显着增强了病毒复制,而MAVS的缺乏则消除了小鼠应激/ CORT引起的病毒易感性。从机制上讲,CORT的作用是由蛋白酶体依赖的MAVS降解介导的,从而阻碍了体内和体外MAVS转导的IFN-β的产生。此外,RNA-seq分析结果表明,丝裂霉素2(Mfn2)参与了此过程。功能获得和功能丧失实验表明Mfn2与MAVS相互作用并募集E3连接酶SYVN1来促进MAVS的多聚泛素化。共同免疫沉淀实验阐明了Mfn2(HR1),MAVS(C-terminal / TM)和SYVN1(TM)的任何两个区域之间的相互作用。总的来说,我们的发现将Mfn2-SYVN1轴定义为蛋白酶体依赖的MAVS降解的新信号传导级联,以及对应激下流感病毒感染的抗病毒先天免疫力的“微调”。RNA-seq分析结果表明,丝裂霉素2(Mfn2)参与了此过程。功能获得和功能丧失实验表明Mfn2与MAVS相互作用并募集E3连接酶SYVN1来促进MAVS的多聚泛素化。共同免疫沉淀实验阐明了Mfn2(HR1),MAVS(C-terminal / TM)和SYVN1(TM)的任何两个区域之间的相互作用。总的来说,我们的发现将Mfn2-SYVN1轴定义为蛋白酶体依赖的MAVS降解的新信号传导级联,以及对应激下流感病毒感染的抗病毒先天免疫力的“微调”。RNA-seq分析结果表明,丝裂霉素2(Mfn2)参与了此过程。功能获得和功能丧失实验表明Mfn2与MAVS相互作用并募集E3连接酶SYVN1来促进MAVS的多聚泛素化。共同免疫沉淀实验阐明了Mfn2(HR1),MAVS(C-terminal / TM)和SYVN1(TM)的任何两个区域之间的相互作用。总的来说,我们的发现将Mfn2-SYVN1轴定义为蛋白酶体依赖的MAVS降解的新信号传导级联,以及对应激下流感病毒感染的抗病毒先天免疫力的“微调”。MAVS(C终端/ TM)和SYVN1(TM)。总的来说,我们的发现将Mfn2-SYVN1轴定义为蛋白酶体依赖的MAVS降解的新信号传导级联,以及对应激下流感病毒感染的抗病毒先天免疫力的“微调”。MAVS(C终端/ TM)和SYVN1(TM)。总的来说,我们的发现将Mfn2-SYVN1轴定义为蛋白酶体依赖的MAVS降解的新信号传导级联,以及对应激下流感病毒感染的抗病毒先天免疫力的“微调”。
介绍
流感病毒是高度传染性的疾病,其爆发已导致全球范围内严重的死亡原因。1它们的高发病率和死亡率导致巨大的经济和社会负担。2然而,众所周知,并非所有人都会在流感爆发期间受到流感病毒的感染。3宿主因素在决定流感感染的结果中起着重要作用。4,5病原体抗性可能是有效清除体内病毒的决定因素之一。而另一种可能是病原体耐受性,它可以减少或减轻宿主病毒感染引起的组织损伤。破坏任何一种病原体途径都可能破坏宿主生物的健康平衡,从而使其成为易感个体。据报道,承受压力或疲劳会使人们更容易感染流感。6紧张的经历会增加疾病的易感性和频率,延长恢复时间,并增加病毒感染后继发性健康并发症的发生率。6,7但是,决定压力如何增强宿主对流感病毒敏感性的确切机制仍然难以捉摸。
越来越多的证据表明,压力诱发的疾病易感性与免疫功能受损之间存在联系。8,9在病毒感染宿主的防御系统对维持健康依赖于固有免疫和适应性免疫成分的复杂相互作用至关重要的作用。响应流感病毒感染,先天免疫被激活以产生I型干扰素(IFN-β),从而限制病毒的复制和传播。10压力经历可能激活下丘脑-垂体-肾上腺(HPA)轴,导致压力激素(主要是糖皮质激素(GCs))升高,这些激素可以诱导免疫抑制。11,12我们以前的研究表明,压力诱发的宿主对流感的易感性与阻碍IFN-β反应有关。13,14然而,如何在流感病毒感染的需求应力影响IFN-β响应进一步解剖。
在涉及产生IFN-β的明确信号中,线粒体抗病毒信号(MAVS)蛋白依赖性途径最为重要。通过视黄酸诱导型基因I(RIG-I)识别RNA病毒后,MAVS充当衔接子,以驱动干扰素调节因子3(IRF3)磷酸化,然后进行IFN-β转录。15,16有趣的是,应力已经报道影响线粒体功能和动力学,这引起了应力抑制的IFN-β响应可能从MAVS杀毒信令的劣化干的可能性。17,18在这项研究中,我们利用束缚应激小鼠模型阐明了导致应激对流感易感性增加的潜在机制。我们的研究结果表明,应激反应导致皮质酮(CORT)的增加阻碍了IFN-β的表达,从而增强了病毒的敏感性。从机制上讲,CORT导致线粒体蛋白2(Mfn2)的蛋白水平升高,后者募集了E3连接酶SYVN1以通过蛋白酶体依赖性途径启动MAVS的降解。我们的发现为应激引起流感易感性的机制提供了新颖的见解,并将CORT途径确定为流感感染的潜在治疗目标,特别是对于那些承受压力的患者。
结果
压力增加了流感感染小鼠的死亡率和病毒复制
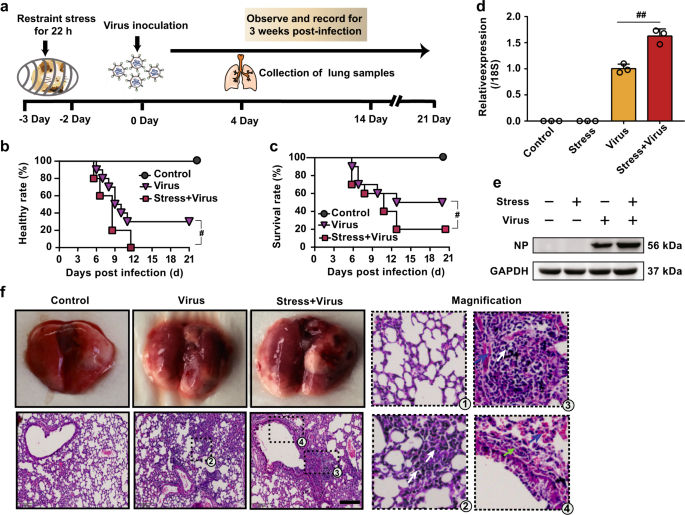
为了确定压力是否增加了小鼠对流感病毒感染的敏感性,将小鼠固定在聚丙烯限制管中22 h,并在吸入流感病毒之前进行了2天的恢复。然后记录小鼠的发病率和死亡率3周(图1a)。约束后第3天,感染病毒的应激小鼠的发病率和死亡率均显着高于非应激/病毒感染的小鼠(图1b,c),这与我们先前的报道一致。13,14
约束压力会增加流感感染小鼠的发病率,死亡率和病毒复制。a动物治疗的示意图。将小鼠固定在约束笼中22小时,然后恢复2天。然后将H1N1病毒(2×LD 50)经鼻给予小鼠。b,c当小鼠表现出典型的流感症状,包括体重减轻,驼背,毛茸茸,呼吸变化,无反应以及体重减轻(超过1 g / d)时,被认为处于病态。通过记录暴露于H1N1病毒21天或直至死亡(n = 10)而保持健康或存活的动物的百分比,检查每组的发病率和死亡率。d,ê后第4天病毒感染,NP基因和蛋白表达在通过qPCR和蛋白质印迹(肺组织评估Ñ = 3)。f病毒感染后第4天,通过H&E染色检查肺组织的组织病理学变化。比例尺,200μm。白色箭头表示存在炎症浸润。绿色箭头表示肺泡壁增厚。蓝色箭头表示出血渗出液。CORT,皮质酮。数据表示为平均值±SD。# P <0.05,## P <0.01,相对于病毒组
除了发病率和死亡率外,我们证明病毒后应激感染的小鼠中病毒核蛋白(NP)的基因和蛋白表达(病毒复制水平的指标)比未应激/非应激/感染的小鼠显着增强。感染后第4天被病毒感染的小鼠(图1d,e)。同时,在病毒感染的小鼠的肺中观察到明显的肺部炎症,在压力加病毒暴露的小鼠中进一步加剧,如肺泡壁增厚,炎性细胞浸润和出血性渗出液所证明(图。1f)。这些发现表明,束缚应激可提高感染流感病毒的小鼠的死亡率和病毒复制。
CORT与压力诱发的流感病毒易感性密切相关
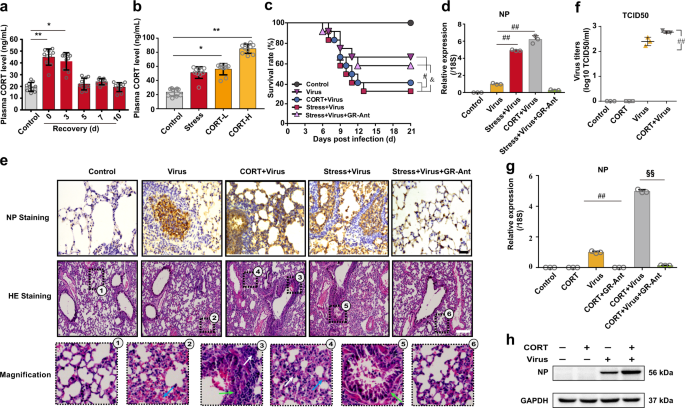
在压力下,由于HPA轴的激活,CORT释放到血液中。19因此,我们在约束后应激的指定时期检查了小鼠血浆CORT浓度。我们发现,应激后从第0天到第3天,这种应激激素显着升高,并在第5天恢复到正常的生理水平(图2a)。为了进一步探讨应激诱导的CORT溢出对病毒感染的影响,对小鼠皮下注射了CORT,以模拟束缚应激的情况。结果表明,注射1 mg / kg的CORT表现出与约束应激(第3天)等效的功效,血浆血浆水平与CORT相似(图2b))。记录注射外源CORT(1 mg / kg)的小鼠的死亡率。我们发现,CORT治疗显着降低了感染病毒的小鼠的存活率(图2c),这与约束应激小鼠模型的存活率相似。qRT-PCR(图2d)和免疫组化(IHC)染色(图2e)结果表明,束缚应激和CORT显着提高了病毒感染小鼠肺中的NP基因和蛋白质表达,这是GR拮抗剂RU486所禁止的。
CORT增强了小鼠对流感病毒的敏感性。a,b在约束后不同时间和通过皮下注射CORT(1和2 mg / kg)2 d(n = 10)的小鼠中,通过HPLC-UV方法检测到的血浆CORT浓度。c给小鼠皮下注射CORT(1 mg / kg)或GR拮抗剂RU486(25 mg / kg)2天,然后接种H1N1病毒。监测病毒感染小鼠的存活率21 d(n = 10)。d在H1N1感染后第4天,通过RT-qPCR检测肺组织中的NP基因表达(n = 3)。Ë分别通过免疫染色(比例尺,50μm)和H&E染色(比例尺,200μm)在肺切片中分析NP蛋白的表达和组织学变化。白色箭头表示存在炎症浸润。绿色箭头表示肺泡壁增厚。蓝色箭头表示出血渗出液。f A549细胞用CORT(100μM)预处理48小时,然后感染H1N1病毒(10 TCID 50)。在感染后12小时通过TCID 50测定来确定病毒滴度(n = 3)。g,h通过实时定量PCR和Western blotting检测NP基因和蛋白的表达(n = 3)。CORT,皮质酮;GR-Ant,糖皮质激素受体拮抗剂(RU486)。数据表示为平均值±SD。 与对照组相比 ,* P <0.05,** P <0.01;#P <0.05,## P <0.01,相对于病毒组; 与“压力+病毒”组相比, P<0.05;§§ P <0 。01与“ CORT +病毒”组
使用人肺上皮A549细胞在体外进一步证实了CORT对病毒敏感性的影响。细胞用CORT(100 µM)处理48小时,并暴露于H1N1病毒感染12小时。从TCID50(图2f),qPCR(图2g),蛋白质印迹(图2h)和免疫荧光(补充图S1)分析获得的数据表明,用CORT和病毒处理的细胞在病毒滴定和NP基因和蛋白质表达与暴露于病毒的细胞相比。体内和体外证据均表明CORT与压力增强的流感病毒敏感性之间呈正相关。
压力/ CORT阻碍了MAVS抗病毒信号转导
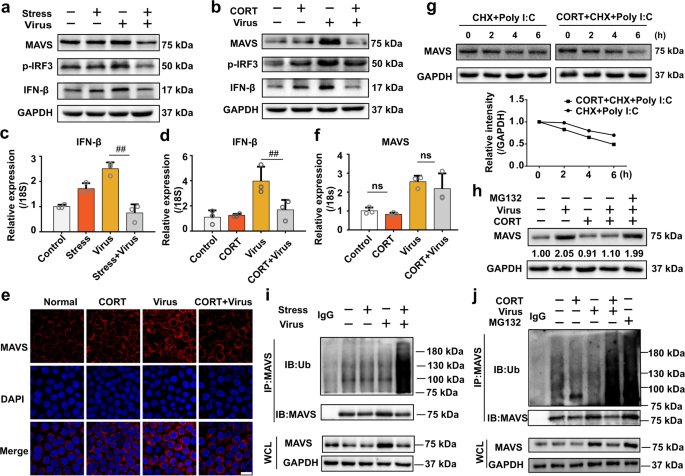
MAVS可以有效激活IRF3并传播IFN和ISG,这在防御RNA病毒感染中起着至关重要的作用。20,21,我们研究了由此应力/ CORT对MAVS抗病信号转导途径的影响。我们的研究结果表明,H1N1感染增强MAVS(图的蛋白质表达3A),和诱导的IRF3(图的磷酸化图3a)在小鼠中(蛋白在所示的肺组织和IFN-β的表达3A和基因在图3c中)。然而,病毒/病毒感染引起的MAVS /IFN-β信号转导受到压力/ CORT的抑制,其表现为MAVS,p-IRF3和IFN-β的蛋白质水平降低(图3a)以及IFN-β的基因水平下降(图3c)。此外,我们调查了CORT对感染H1N1的A549细胞中MAVS抗病毒信号的影响。我们首先确定了MAVS水平在不同时间点的变化,结果表明,在H1N1感染或RNA病毒复制产生的双链RNA模仿多聚体后,它在9和12 h升高,然后在24、36、48 h降低。 I:C)刺激(补充图S2)。选择一个增加的时间点(12小时)来评估CORT的影响。与体内结果一致,MAVS抗病毒信号转导在H1N1 / poly(I:C)处理的A549细胞中也受到阻碍(图3b,d和补充图S3)。免疫荧光染色进一步证实了CORT对降低MAVS蛋白水平的作用(图3e)。
CORT可以阻止由流感感染触发的MAVS转导的IFN-β反应。通过蛋白质印迹法在肺组织或A549细胞中确定了a,b MAVS,IFN-β和p-IRF3蛋白的表达。Ç,d IFN-βmRNA水平通过RT-qPCR(分析Ñ = 3)。将 e549细胞用CORT(100μM)预处理48小时,然后用H1N1病毒(10 TCID50)感染。在感染后12小时通过免疫染色观察到MAVS的表达。共聚焦显微镜拍摄的MAVS(红色)的代表性免疫染色图像。细胞核用DAPI染色(蓝色)。比例尺,20μm。F在感染后12 h(n = 3),通过RT-qPCR测定了感染了CORT的A549细胞中MAVS基因的表达。在CHX(100μM)或不存在CHX的情况下,用poly I:C(50μM)转染g载有CORT的细胞,并通过Western印迹检测MAVS的蛋白表达。h装载CORT的细胞用H1N1感染,然后用MG132(10μM)处理12 h。通过蛋白质印迹法(n = 3)确定MAVS蛋白表达。我,Ĵ在感染后第4天通过小鼠的肺组织中和在感染后第12小时在A549细胞中的蛋白印迹分析MAVS的泛素化水平。CORT,皮质酮;CHX,环己酰亚胺。数据表示为平均值±SD。## P <0.01 vs.病毒组。ns无意义
压力/ CORT启动泛素介导的MAVS降解
考虑到应激/ CORT降低了MAVS蛋白水平,然后通过qRT-PCR确定了其基因表达。出乎意料的是,CORT处理不能从病毒感染的A549细胞中的基因水平影响MAVS(图3f)。通过使用蛋白质合成抑制剂环己酰亚胺(CHX),我们确定了CORT促进了用聚(I:C)处理的A549细胞中MAVS的降解(图3g)。同时,蛋白酶体抑制剂MG132的治疗挽救了CORT引起的病毒暴露A549细胞中MAVS的下降(图3h))。上述结果促使我们推测约束/ CORT是否启动了蛋白酶体依赖的MAVS降解。为了检验该假设,在体内和体外对有或无应激反应的病毒感染进行免疫沉淀以测定小鼠肺组织中的泛素化水平。结果显示,约束和CORT显着提高了感染流感病毒的小鼠(图3i)和细胞(图3j)中MAVS的多泛素化水平。随后,我们利用抗K48连接的泛素抗体在体外和体内检测MAVS的K48连接的泛素化。补充图S4a和图S4b中的数据分别说明,应激和CORT均可增加病毒感染的小鼠或A549细胞中MAVS的K48连接的多泛素化水平。总的来说,应激/ CORT促进了蛋白酶依赖于MAVS的降解,从而阻止了IFN-β抗病毒信号传导并增加了流感病毒的敏感性。
除了MAVS信号传导外,还报告了病原体感染期间的IFN-β反应是由核因子κB(NF-κB)触发的。22在我们的研究中,与单独暴露于病毒的细胞相比,经CORT处理的病毒感染的A549细胞显示出NF-κB/ p65的明显增加(补充图S6)。同时,我们发现选择性NF-κB抑制剂BAY 11-7082在CORT处理和病毒感染后显着下调了IL-6和TNF-α(两种已知的NF-κB调节炎症因子)的蛋白表达。暴露的细胞(补充图S6)。然而,BAY 11-7082仅对经CORT处理和病毒感染的A549细胞中的IFN-β蛋白表达产生边际效应(补充图S6))。这些结果排除了NF-κB在CORT抑制的IFN-β反应中的作用。
在MAVS -/-小鼠中,应激/ CORT诱导的病毒敏感性降低
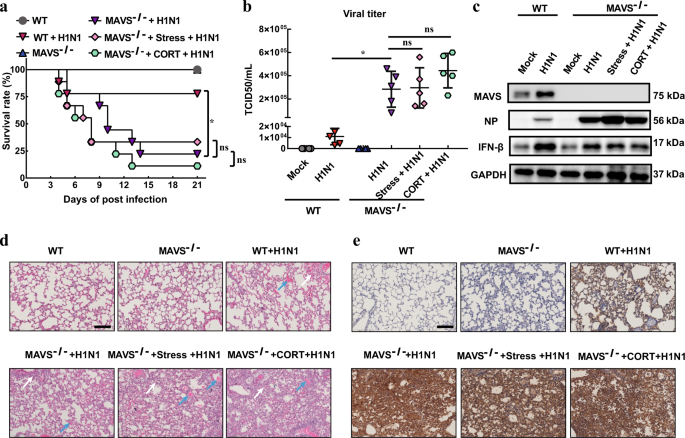
然后使用MAVS基因敲除小鼠来确认MAVS抗病毒信号在CORT /应激诱发的病毒易感性中的作用。结果表明,MAVS的丧失导致感染H1N1的小鼠死亡率增加(图4a)。然而,应激和CORT处理均对感染病毒的MAVS -/-小鼠的存活率没有显着影响(图4a)。此外,我们发现应激/ CORT与病毒滴度(图4b),IFN-β蛋白表达(图4c),组织学变化(图4d)和NP免疫染色(图4e)之间没有显着差异。非压力/非CORT组。在MAVS中获得的所有这些数据-/-小鼠与野生型小鼠的观察结果形成鲜明对比,这共同表明MAVS抗病毒信号在压力/ CORT诱导的H1N1易感性中起重要作用。
压力/ CORT诱导的病毒敏感性在MAVS -/-小鼠中受损。WT和MAVS -/-小鼠受到束缚压力或CORT治疗。恢复2天后,然后对小鼠鼻腔注射H1N1病毒(2×LD50)。在病毒感染之前,将溶于PEG-400的CORT(1 mg / kg)皮下注射给小鼠,持续2 d。a监测每组的存活率21 d(n = 9)。b感染后4 d 通过TCID 50分析确定病毒滴度(n = 4)。在感染后第4天,通过western印迹分析c MAVS /IFN-β/ NP蛋白表达。d,èH1N1感染后第4天,分别通过HE和免疫组化染色分析组织学变化和NP蛋白表达(n = 3)。白色箭头表示存在炎症浸润。蓝色箭头表示出血渗出液。数据表示为平均值±SD。* 与“ WT + H1N1”组相比,P <0.05;ns, 相对于“ MAVS -/- + H1N1”组,P > 0.05
Mfn2参与了CORT诱导的MAVS抗病毒信号传导障碍
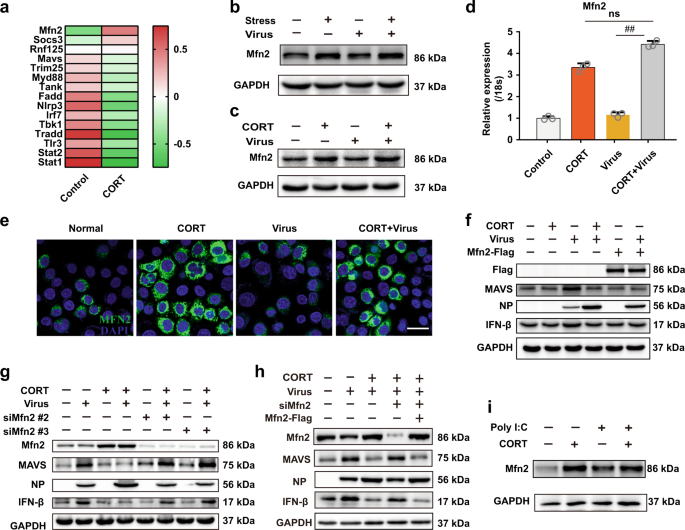
接下来,我们研究了控制MAVS降解的潜在机制。利用小鼠肺组织的RNA测序分析来测量先天免疫相关基因的变化。考虑到Mfn2在CORT处理下的显着改变,将其筛选出来(图5a)。在该实验中,我们还观察到MAVS的mRNA水平未受影响,这与qPCR先前的数据一致。此外,通过qPCR和蛋白质印迹法测量了应激/ CORT对Mfn2基因和蛋白质水平的影响。结果表明,压力和CORT分别上调了小鼠肺组织(图5b)和A549细胞(图5c中的蛋白质和图5d中的基因)中Mfn2的mRNA和蛋白水平。)是否存在H1N1感染。在聚(I:C)转染的细胞中观察到了相似的结果(图5i)。值得指出的是,仅病毒感染对体内和体外的Mfn2表达几乎没有影响,这表明CORT是引起Mfn2改变的唯一因素。
Mfn2参与CORT禁止的MAVS抗病毒信号传导。将装有 CORT的A549细胞感染H1N1,然后在感染后12小时取样进行RNA测序分析。RNA测序数据的热图显示了对照和CORT处理的细胞中抗病毒先天免疫相关基因的平均表达(n = 3)。颜色表示倍率变化水平高于(红色)或低于(绿色)对照值。b,c在感染后4天和感染后12小时在A549细胞中通过Western印迹法测定Mfn2蛋白的表达。d在感染后12 h(n = 3),通过RT-qPCR分析载有CORT的A549细胞中的Mfn2基因表达。Ë Mfn2的(绿色)的A549细胞的代表性免疫染色图像拍摄共聚焦显微镜。细胞核用DAPI染色(蓝色)。比例尺,20μm。在感染后12 h,通过蛋白质印迹分析了Mfn2过表达或Mfn2抑制的A549细胞中f – h MAVS /IFN-β/ NP蛋白的表达。我的A549细胞用或不用CORT进行处理和聚I:C 12小时,并通过Western印迹来确定Mfn2的蛋白的表达。CORT,皮质酮。数据表示为平均值±SD。## P <0.01 vs.病毒组。ns无意义
接下来,我们敲低或过度表达了A549细胞中的Mfn2,以研究Mfn2在MAVS降解中的作用。与CORT处理类似,细胞中Mfn2的过度表达降低了MAVS和IFN-β蛋白的水平,并促进了H1N1处理的细胞中病毒的复制(图5f)。相比之下,siRNA对Mfn2的消耗挽救了MAVS抗病毒信号,从而抑制了病毒复制(补充图S7a和图5g),其通过Mfn2过表达得以挽救(图5h)。以上数据解决了Mfn2在CORT介导的MAVS抗病毒信号传导抑制中的重要性。
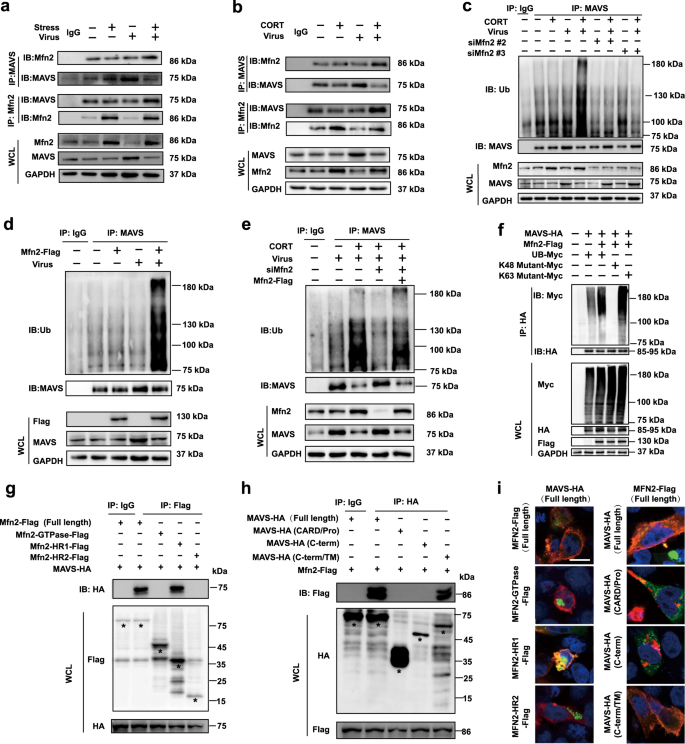
Mfn2和MAVS之间的相互作用点燃了MAVS的泛素化。安川等。据报道,Mfn2与MAVS相互作用以调节抗病毒免疫力。23本研究表明,CORT加速了MAVS降解,Mfn2在此过程中非常重要。因此,我们假设Mfn2和MAVS之间的相互作用导致了CORT引起的MAVS降解。为了验证这一假设,我们测量了在存在或不存在病毒的情况下,应激小鼠和CORT处理的A549细胞中Mfn2和MAVS之间的相互作用。结果表明,Mfn2在体内和体外均与MAVS结合,而应激/ CORT增强了它们的相互作用(图6a,b)。共聚焦图像还表明CORT促进了病毒感染的A549细胞中MAVS和Mfn2的共定位(补充图S5)。
Mfn2和MAVS之间的相互作用触发了MAVS的泛素化。a,b在感染后4 d和感染后12 h的A549细胞中,在小鼠肺组织中进行MAVS和Mfn2的免疫共沉淀测定。用附在琼脂糖凝胶上的MAVS或Mfn2抗体对整个裂解液进行免疫沉淀。通过用抗Mfn2或MAVS抗体进行免疫印迹分析全细胞裂解物(WCL)和免疫沉淀物。c – e感染后12 h,通过蛋白质印迹法检测Mfn2过表达或Mfn2抑制的A549细胞中MAVS泛素化水平。F在与pCDNA3.1-MAVS-HA,pCDNA3.1-Mfn2-Flag,pCMV-UB-Myc,pCMV-Ub(K48R)-myc或pCMV-Ub(K63R)-共转染的HEK293T细胞中测量泛素化水平myc并感染了H1N1。用连接到琼脂糖凝胶上的抗Myc抗体对HEK293T细胞的全部裂解液进行免疫沉淀。通过使用抗HA,抗Myc和抗Flag抗体进行免疫印迹分析了WCL和免疫沉淀物。g,h在病毒感染的HEK293T细胞中通过共免疫沉淀测定法分析了Mfn2的全长和截短与MAVS之间的相互作用,MAVS的全长和截短与Mfn2之间的相互作用。一世在共聚焦显微镜下观察到MAVS和Mfn2的全长和截短在病毒感染的HEK293T细胞中的共定位。CORT,皮质酮
接下来,我们探讨了Mfn2对MAVS泛素化的影响。结果显示,Mfn2的过表达增加了病毒感染的A549细胞中MAVS的多泛素化水平(图6d)。相比之下,siRNA对Mfn2的耗竭降低了泛素化水平(图6c),这通过Mfn2的过表达得以恢复(图6e)。我们进一步在病毒感染的293T细胞中用编码MAVS-HA,Mfn2-Flag和Ub-Myc的质粒转染。Mfn2-flag的过表达显着增加了MAVS的多泛素化作用(图6f)。当我们检查MAVS泛素化的联系时,我们发现Mfn2仅调控MAVS的K48,而不调控K63泛素链(图6f)。
然后探索了Mfn2和MAVS之间的相互作用区域。不同的截短的Mfn2和MAVS在HEK293T细胞中过表达,随后被病毒感染。使用Co-IP方法,发现Mfn2中的4,3个疏水性七肽重复(HR1)区(氨基酸残基369–598)为MAVS相互作用区(图6g)。截短的MAVS产生的结果表明,与Mfn2相互作用需要MAVS的C末端/ TM区(氨基酸残基201-540)(图6h)。通过在病毒感染的HEK293T细胞的免疫染色图像中观察到的Mfn2-HR1和MAVS-C-term / TM Mfn2的共定位进一步证实了该观察结果(图6i)。
SYVN1作为Mfn2介导的MAVS泛素化中的E3连接酶的鉴定
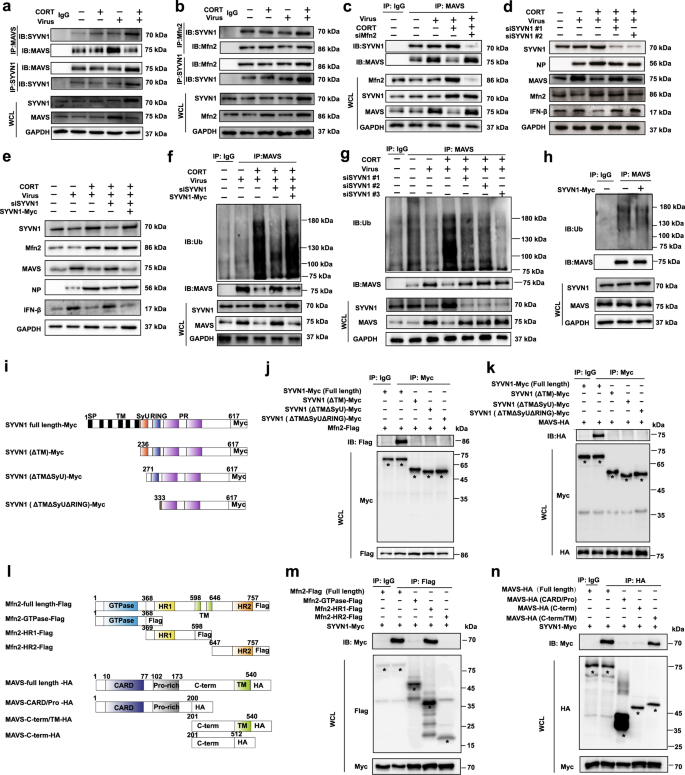
E3连接酶在泛素化过程中起着不可或缺的作用。24为了在流感病毒感染期间由Mfn2介导的MAVS泛素化中定义E3连接酶,我们最初诉诸UbiBrowser数据库做出预测,25和SYVN1被认为是得分最高的潜在E3连接酶。为了验证这一预测,在有病毒感染的A549细胞中进行了免疫共沉淀(Co-IP)。结果表明CORT分别增强了MAVS和SYVN1之间的相互作用(图7a)以及SYVN1和Mfn2之间的相互作用(图7b)。当Mfn2被siRNA击倒时,由MART和SYVN1之间的CORT相互作用减弱了(图7c)。)。集体地,在应激/ CORT-加病毒处理的小鼠或细胞中描绘了三种蛋白质,即Mfn2,MAVS和SYVN1之间的相互作用。这个有趣的发现促使我们进一步确定SYVN1在MAVS泛素化和MAVS /IFN-β信号传导中是否具有重要意义。就这一点而言,我们发现siRNA缺失SYVN1降低了NP表达,但增加了MAVS和IFN-β表达(补充图S7和图7d)。奇怪的是,当敲低SYVN1时,Mfn2的蛋白表达没有受到影响(图7d,e),排除了SYVN1作为Mfn2的E3连接酶的可能性。更重要的是,SYVN1的消耗显着降低了MAVS的泛素化水平(图7g)。进一步的损失和增益功能实验表明,SYVN1过表达可以恢复siSYVN1引起的CORT加病毒处理细胞中MAVS蛋白质和泛素化水平的变化(图7e,f)。然而,在没有病毒和CORT的情况下,单个SYVN1过表达不会对MAVS泛素化产生明显影响(图7h),间接暗示了Mfn2作为将MAVS和SYVN1结合在一起的支架蛋白的重要性。
SYVN1作为Mfn2介导的MAVS泛素化中的E3连接酶的鉴定。A549细胞中MAVS和SYVN1 的共免疫沉淀测定。感染后12小时,WCL用连接到琼脂糖凝胶上的MAVS或SYVN1抗体进行免疫沉淀。通过用抗SYVN1或MAVS抗体进行免疫印迹分析WCL和免疫沉淀物。b A549细胞中Mfn2和SYVN1的共免疫沉淀测定。WCL用附着在琼脂糖凝胶上的Mfn2或SYVN1抗体进行免疫沉淀。使用抗SYVN1或Mfn2抗体通过免疫印迹分析WCL和免疫沉淀物。c在感染后12h,通过免疫共沉淀法分析了Mfn2-敲低的A549细胞中MAVS和SYVN1的相互作用。d,ê在SYVN1击倒NP / MAVS / IFN-β蛋白的表达或过表达的在12小时后感染通过Western印迹测定的A549细胞。感染后12 h,通过蛋白质印迹分析SYVN1敲低和过度表达的A549细胞中f – h MAVS泛素化水平。i描述了带有Myc标签的SYVN1的截短变体。Ĵ,ķ截断Myc标记SYVN1的相互作用变体与Flag标记在通过共免疫沉淀测定法进行了分析病毒感染的HEK293T细胞Mfn2的或HA标记MAVS。l描述了标记有标记的Mfn2或具有HA标记的MAVS的截短变体。米,Ñ通过共免疫沉淀试验分析了Myc标签的SYVN1与Flag标签的Mfn2耗竭突变体或HA标签的MAVS耗竭突变体在病毒感染的HEK293T细胞中的相互作用。CORT,皮质酮
接下来,分别在病毒感染的HEK293T细胞中研究了具有SYVN1的MAVS或Mfn2结合区。细胞用Myc标签的SYVN1和Flag标签的Mfn2或HA标签的MAVS质粒的全长或缺失突变体共转染。转染24小时后,将细胞用H1N1感染12小时。收获细胞进行免疫共沉淀实验。蛋白复合物用抗Myc抗体沉淀的SYVN1变异变体沉淀,并使用抗Flag或抗HA抗体检测。结果,所有缺少跨膜结构域(SYVN1ΔTM)的SYVN1截短变体都无法与Mfn2或MAVS相互作用(图7i–k),表明SYVN1中TM域在与Mfn2和MAVS相互作用中的关键作用。此外,为了鉴定与SYVN1相互作用的Mfn2或MAVS区域,在病毒感染的HEK293T细胞中用全长SYVN1共转染具有Mfn2或MAVS缺失突变体的类似方法。我们发现,Mfn2的HR1区与SYVN1相互作用是必需的(图7i,m)。同时,与Mfn2相互作用所必需的MAVS的C-term / TM区域也是与SYVN1相互作用所必需的(图7i,n)。
总的来说,这些数据表明由CORT引起的Mfn2的增加募集了E3连接酶SYVN1来启动MAVS的泛素化,从而阻碍了MAVS /IFN-β反应。
讨论区
处于压力下的人的免疫力较弱,很可能在感染流感病毒后需要住院治疗,这增加了压力是流感感染的易感因素的可能性。26这一假说已被越来越多的证据支持的,13,14,27除了我们的研究。当我们试图阐明造成压力诱发的流感易感性的机制时,CORT(一种GC,一种压力反应的指标)被定义为罪魁祸首。实际上,由于其众所周知的免疫功能受损,GC与病毒感染之间的联系已引起人们多年的关注。例如,Dobbs等。报道了束缚应激诱导的CORT抑制了淋巴结和脾脏细胞的流感病毒(A / PR / 8/34)特异性产生Th1型(IL-2)和Th2型(IL-10)细胞因子。增加流感死亡率。28然而,尽管已经有有趣的报道表明GR可以与IRF3竞争GRIP1以抑制IFN-β转录,并且还可以抑制CORT对CORT对RNA病毒感染特异性MAVS抗病毒信号转导的影响,但仍需要付出更多的努力来探索CORT的影响。 STAT转录复合物激活以抑制IFN-β刺激基因的表达。29在我们的研究中,我们首次报告了我们的知识,即通过限制应力激活HPA轴而产生的CORT会干扰MVS通过Mfn2-SYVN1轴抑制先天免疫的蛋白质稳定性。
在确定CORT /应激对MAVS抗病毒信号的影响之前,我们首先检查了A549细胞中H1N1感染或多聚I:C刺激后不同时间点MAVS量的变化。我们的结果表明,病毒感染或poly I:C后,MAVS的蛋白质水平在较早的时间(9和12 h)增加,然后在较晚的时间(24、36、48 h)下降(补充图S2)。 。该时间点实验表明,在不同的感染阶段,H1N1感染对MAVS水平有不同的影响。先前的报道已经从miRNA调控的表达,30泛素化/自噬介导的降解的角度探讨了病毒感染如何在以后的时间点降低MAVS水平。31,32相反,有一些研究表明,MAVS可以在病毒感染后被去泛素化[ 33],这提示我们去泛素化修饰可能会导致MAVS蛋白水平升高,从而在感染后更早地限制了病毒的复制。正如我们所揭示的,病毒感染和poly I:C对MAVS都有相似的作用,除病毒蛋白外的dsRNA也被表明参与了这一过程。考虑到以上发现,选择增加MAVS水平的时间点(病毒感染后12小时)来评估CORT的影响。
MAVS与其他几种与MAVS相关的线粒体蛋白(例如NLRX1和Mfn2)一起位于线粒体外膜,它们可能负调控或正调控MAVS的功能并影响免疫平衡。23,34,35与先前的研究一致报道安川等人,23我们观察到Mfn2与MAVS相互作用并且也抑制了MAVS介导的抗病毒反应。具体来说,在有或没有病毒的情况下,由应激反应诱导的CORT产生会显着增加Mfn2基因和蛋白质水平。增强的Mfn2与MAVS相互作用以抑制IRF3的磷酸化和下游的IFN-β转录。此外,我们发现Mfn2严重影响MAVS的泛素降解,如体内和体外Co-IP和泛素化测定所示。有趣的是,尽管压力/ CORT暴露可以增加Mfn2的表达,但是在没有病毒的情况下,对MAVS的蛋白质水平和泛素化水平都没有影响。根据这些结果,单独的Mfn2的过表达对MAVS的蛋白质水平和泛素化水平也没有降低作用。与之形成鲜明对比的是,在病毒存在下,压力/ CORT以Mfn2依赖性方式诱导MAVS的泛素化降解。这种差异强烈表明,病毒感染需要通过Mfn2上调来使CORT诱导MAVS降解。我们推测病毒激活MAVS是Mfn2和MAVS相互作用以及由此产生的MAVS泛素化的前提。
另一个新出现的问题是Mfn2和MAVS之间的相互作用如何引发MAVS泛素化。我们确定SYVN1为应激/ CORT暴露下MAVS的E3连接酶。更有趣的是,Mfn2可以与MAVS和SYVN1相互作用,而siRNA对Mfn2的消耗消除了CORT对MAVS的多泛素化水平和随后的IFN-β反应的抑制作用。因此,我们得出结论,Mfn2充当支架蛋白,将底物MAVS和E3连接酶SYVN1聚集在一起,从而引发了多泛素化介导的MAVS降解。但是,仍有一些问题尚未解决。例如,据报道SYVN1主要位于内质网(ER)。36因此,仍然不确定如何将E3连接酶从ER转运到线粒体。它也仍然是未知的CORT是否影响其他连接酶E3 MAVS,包括AIP4,31 TRIM25,37,38 TRIM31,39 Smurf1,40和SMURF2。41阐明这些E3连接酶的作用可能有助于我们充分解决CORT引起的MAVS泛素化的机制。
总而言之,我们的研究表明CORT是应激状态下对病毒感染的响应,是MAVS依赖性IFN-β反应的重要调节剂。从机制上讲,Mfn2充当将E3连接酶SYVN1带入底物MAVS的支架蛋白,后者启动了遍在蛋白介导的MAVS降解。最后,通过一系列的免疫共沉淀实验,我们阐明了Mfn2(HR1),MAVS(C-terminal / TM)和SYVN1(TM)任意两个区域之间的相互作用。这项研究提出了一种新的见解,即对压力诱导的流感病毒敏感性的研究,并为治疗流感感染提供了创新的策略。
材料和方法
试剂种类
CORT,RU486,MG132和CHX购自Sigma(美国密苏里州圣路易斯)。乙酸乙酯,乙醚和甲醇购自山东裕旺实业有限公司(中国山东)。蛋白A-琼脂糖珠,抗磷酸-IRF3兔单克隆抗体,抗TNF-α兔多克隆抗体和抗IL-6兔单克隆抗体获自Cell Signaling Technology(美国马萨诸塞州贝弗利)。抗MAVS兔多克隆抗体购自Proteintech(Rosemont,Illinois,USA)。抗-mitofusin2(Mfn2)小鼠单克隆抗体,抗-IFN-β兔多克隆抗体和抗-Ub兔单克隆抗体购自Abcam(Cambridge,MA,UK)。抗NP兔多克隆抗体购自Genetex(美国德克萨斯州圣安东尼奥)。抗β-actin小鼠单克隆抗体和HRP标记的二抗购自杭州复德生物技术有限公司(中国上海)。除非另有说明,否则化学品是从杭州复德生物技术有限公司(中国上海)获得的。
病毒
嵌入SPF的鸡蛋由Genetimes Technology(中国上海)提供。华南农业大学兽医学院陈建新教授捐赠了A / FM / 1/47(H1N1)流感病毒(A / Monmouth堡/ 1/1947 H1N1毒株)。通过噬菌斑测定计数其病毒滴度。42经过三代传代后,该病毒株适应了小鼠的致死性,并在带有SPF胚胎的鸡蛋中繁殖(Genetimes Technology Ltd.,中国上海)。连续稀释储备液后,在小鼠中计算LD 50。LD 50的两倍在所有动物实验中均用于病毒攻击。用乙醚麻醉小鼠,然后鼻内注射35μLPBS中的A / FM / 1/47(H1N1)流感病毒,而对照小鼠则用等体积的稀释尿囊液感染。
动物与治疗
雄性无特定病原体(SPF)昆明小鼠(13-15 g)从广东省医学检验动物中心(中国广州)购买。江振有教授的研究组慷慨地提供了MAVS基因敲除的C57BL / 6小鼠(杰克逊实验室,B6.129-Mavs <tm1zjc> / J,库存号:008634)。将所有小鼠成组地关在笼子中,该笼子具有被褥,受控温度(23±2°C),光照(12 h光照/黑暗周期)和湿度(50±5%)。实验前将小鼠适应该设施1周。所有动物实验均根据美国国立卫生研究院《实验动物的护理和使用指南》(NIH第80-23号出版物,于1996年修订)进行,并得到暨南大学动物伦理委员会的批准。
在第一批动物实验中,昆明小鼠被随机分为三组(n = 10),包括对照组,病毒和“束缚压力+病毒”。为了约束压力,将小鼠在带有孔的聚丙烯约束管中进行物理约束22 h,并恢复2 d。然后,将动物麻醉,大约2×LD 50将适量的H1N1病毒(35μL)滴入鼻孔。当小鼠表现出典型的流感症状时,包括体重减轻,腰背驼背,毛茸茸,呼吸变化和无反应,以及体重下降(超过1 g / d),被认为处于病态。通过记录保持H21N1病毒至21天或直至死亡的健康或存活动物的百分比,检查每组的发病率和死亡率。在H1N1感染后第4天测定小鼠肺中的病毒NP基因和蛋白质表达。示意性协议如图1a所示。
在第二批动物实验中,昆明小鼠随机分为四组(n = 10),包括对照组,束缚应激,CORT(1 mg / kg)和CORT(2 mg / kg)。束缚应激组的小鼠束缚22 h,恢复2 d。对CORT组的小鼠皮下注射1或2 mg / kg CORT(在聚乙二醇400中,PEG-400)2 d。处死动物以收集血浆并确定CORT水平。
在第三批动物实验中,昆明小鼠被分为五组(n = 10),包括对照组,病毒,“应激+病毒”,“ CORT +病毒”,“应激+病毒+ RU486”。在病毒感染之前,将溶于PEG-400的CORT(1 mg / kg)皮下注射给小鼠,持续2 d。每次CORT治疗前两小时,将GR拮抗剂RU486(25 mg / kg)皮下注射到小鼠体内。每天记录21天或直至死亡的体重和存活率。死亡率表示为抗H1N1病毒暴露的存活动物总数占小鼠总数的百分比。
在第四批动物实验中,将昆明小鼠分组并作为第三实验。病毒感染后四天,将小鼠称重并用乙醚麻醉。收集肺组织样品用于qRT-PCR,蛋白质印迹,组织病理学分析,IHC染色和Co-IP分析。
在第五批动物实验中,采用MAVS -/- C57BL / 6小鼠确认了MAVS抗病毒信号在压力/ CORT诱导的H1N1易感性中的作用。WT和MAVS -/-小鼠分为6组,包括WT,“ WT +病毒”,“ MAVS -/- +病毒”,“ MAVS -/- +压力+病毒”和“ MAVS -/- + CORT +病毒”。通过记录每组小鼠的存活情况,在21天内检查死亡率。H1N1感染后第4天检查MAVS,IFN-β和NP的蛋白表达以及肺组织的组织学变化。
细胞培养与处理
在Dulbecco改良的Eagle培养基(DMEM; Invitrogen,Waltham,MA,USA)中培养人肺腺癌上皮A549细胞,HEK293T细胞和MDCK细胞,并在5%CO中于37°C补充10%胎牛血清(FBS)。2直到融合的80–85%。与CORT孵育48小时后,将细胞用10 TCID 50 H1N1病毒感染2小时以进行吸附,然后洗涤并再培养12小时。
质粒/ siRNA转染
将小干扰RNA(siRNA),靶向Mfn2的siRNA和SYVN1(中国广州RiboBio Co.,Ltd.)转染到A549细胞中,并将非靶向siRNA用作阴性对照。如制造商的说明书所述,使用lipofectamine 2000(Invitrogen,Waltham,MA,USA)进行转染。转染六小时后,将细胞用CORT(100 µM)处理48小时。然后,将细胞用10 TCID 50 H1N1病毒感染2 h吸附,洗涤,再培养12 h,并收集用于分析。
质粒包括pcDNA3.1-MAVS-HA,pcDNA3.1-MAVS(C-Term)-HA,pcDNA3.1-MAVS(C-Term / TM)-HA,pcDNA3.1-MAVS(CARD / Pro)-HA ,pcDNA3.1-Mfn2-Flag,pcDNA3.1-Mfn2(GTPase)-Flag,pcDNA3.1-Mfn2(HR1)-Flag,pcDNA3.1-Mfn2(HR2)-Flag,pcDNA3.1-SYVN1-myc, pcDNA3.1-SYVN1-myc,pcDNA3.1-SYVN1(∆TM)-myc,pcDNA3.1-SYVN1(∆TM∆SyU)-myc,pcDNA3.1-SYVN1(∆TM∆SyU∆RING)-myc,使用lipofectamine 2000将pCMV-Ub-myc,pCMV-Ub(K48R)-myc和pCMV-Ub(K63R)-myc转染到A549或HEK293T细胞。6小时后,用CORT处理细胞48小时,然后感染如上所述感染了10 TCID 50 H1N1病毒。
组织病理学分析
将肺部样品固定在4%多聚甲醛中并包埋在石蜡中。将肺切片切成薄片(4微米),然后安装在显微镜载玻片上。至少对每只动物3个切片和每个实验组4个动物的5-10个野外区域进行了评估。在光学显微镜下(Olympus,东京,日本)通过H&E染色检查了感染流感病毒的动物的肺组织病理学变化。
IHC染色
IHC染色用于评估肺切片中的病毒NP标记。纵向切割载玻片,在二甲苯中脱蜡(两次,每次5分钟),在100%乙醇(两次,两次,两次),95%乙醇(一次,一次)和80%乙醇(一次,一次)中再水化。通过将玻片在1 mM EDTA缓冲液(pH 8.0)中煮沸30分钟来进行抗原修复。在室温下,将玻片在1%FBS,0.4%TritonX-100中封闭1小时,然后与兔抗NP抗体孵育过夜。将切片用封闭缓冲液洗涤两次,然后与山羊抗小鼠二抗一起孵育。然后将切片用苏木精染色2分钟,然后通过显微镜检查。
测定血浆中的CORT水平
将血液以4500 × g离心 10分钟以收集血浆。从血浆中提取CORT并通过HPLC定量。将13血浆(0.5 mL)与30 µL可的松溶液(0.125 mg / mL甲醇-水60:40 v / v)混合作为内标。通过添加2mL乙酸乙酯萃取类固醇并充分混合。使用HPLC级乙腈-水(38:72,v / v)以1 mL / mL的流速平衡色谱柱(5C18,4.6×100 mm;粒径5 µm; Waters Corp.,美国马萨诸塞州米尔福德)。分钟
实时定量PCR
根据制造商的协议,使用TRIzol试剂(Invitrogen,卡尔斯巴德,加利福尼亚州)从小鼠肺组织或A549细胞中提取总RNA。通过在分光光度计(Thermo,Waltham,MA,USA)上于260 nm处的光密度测量来确定RNA浓度,并使用iScript cDNA合成试剂盒(TransGen Biotech)通过随机和寡聚(dT)引物从纯化的RNA合成cDNA。 , 中国北京)。使用SYBR green方法(Applied Biosystems)在逆转录(RT)机器(CFX Connect TM)上测量细胞内NP和IFN-βRNA水平; Applied Biosystems)和相对定量方法。通过减去18S的阈值循环值对样本进行归一化。计算出病毒RNA或先天免疫基因在模拟感染细胞或DMSO处理的对照细胞中诱导诱导水平超过诱导水平的倍数。基于A型流感病毒NP,小鼠或人的18S,MAVS,IFN-β和Mfn2的基因组序列,使用Primer Premier 5.0设计特异性引物。它们的引物序列如下:H1N1 NP(正向,5'-CAGGTACTGGGCCATAAGGAC-3';反向,5'-GCATTGTCTCCGAAGAAATAAG-3'),人IFNB1(正向,5'-CCAACAAGTGTCTCCTCCAA-3';反向,5'-ATAGTCTCATCATTCCAGCCA -GT-3'),人类Mfn2(正向,5'-GCAATGTCCCTGCTCTTCTCTCTCTC-3';反向,5'-TCTTGGCACTCCTCTTTTTTCCTCT-3'),人类MAVS(正向,5'-CTTCCCCTGTGTTCACCTTTCTG-3';反向,5'-CATTGTCCCCTCTTCG-3 -TCCTTCA-3'),
蛋白质印迹
通过皮尔斯BAC蛋白测定试剂盒(Thermo Scientific,美国)测定来自肺组织以及A549和HEK293T细胞的蛋白质。将典型的30 µg蛋白加载到10%或15%SDS-PAGE凝胶上。将电泳后的蛋白质转移到聚偏二氟乙烯膜(美国马萨诸塞州密里波利)上,分别用抗MAVS,Mfn2,NF-κBp65,NP,p-IRF3,IFN-β,TNF-α或IL-6的抗体进行探测,然后是辣根过氧化物酶(HPR)偶联的二抗(抗兔和抗小鼠IgG,美国加利福尼亚州圣克鲁斯)。使用穿孔的ECL蛋白质印迹底物(Thermo Fisher Scientific,Santa Fe,NM,USA)检测结合的二抗。
联合IP和免疫印迹分析
对于Co-IP内源蛋白,收集肺组织或A549细胞样品,并用补充有蛋白酶抑制剂混合物和磷酸酶抑制剂混合物的RIPA缓冲液溶解。通过与重组蛋白A琼脂糖孵育2小时,然后与抗MAVS,抗Mfn2,抗SYVN1,抗Myc,抗Flag或抗HA抗体在4°C孵育过夜来回收抗体。收集蛋白A琼脂糖,免疫沉淀后用裂解缓冲液洗涤四次。通过SDS-PAGE分离免疫沉淀物,并通过蛋白质印迹分析。
RNA测序
RNA测序由RiboBio Co.,Ltd.(中国,广州)使用Illumina HiSeq 2500进行。如前所述,使用领结和RSEM将RNA-seq数据与Ensembl v73转录物注释进行比对。43所有其他生物信息学分析均使用glbase进行。44
免疫荧光测定
每组细胞用4%多聚甲醛固定30分钟,然后用0.1%Triton-X100透化5分钟。用2%牛血清白蛋白封闭20分钟并用NP染色后,将细胞以4:C的1:100稀释度置于兔多克隆MAVS或Mfn2中过夜。在室温下将与1:200稀释的Alexa Fluor 488抗小鼠IgG偶联的二抗和在1:200稀释的555偶联山羊-兔IgG的二抗在室温下应用50分钟。细胞核用DAPI复染色,并使用共聚焦激光扫描显微镜对细胞进行可视化和分析。
数据分析
所有数据均表示为平均值±SD。使用单向方差分析(ANOVA)对各组之间的统计差异进行评估(SPSS,版本15,美国),并与Tukey post hoc检验进行多次比较以确定统计学显着性。使用Kaplan–Meier方法估算生存曲线,并使用GraphPad Prism5(GraphPad Software,La Jolla,CA)使用对数秩检验评估组差异。在P <0.05时,差异被认为是显着的。所有统计检验都是双面的。
资料可用性
研究人员一旦发表所有数据和资料。
|
|