在MYC蛋白阴性伯基特淋巴瘤病例中从MYC到MYCN表达的分子转换
在MYC蛋白阴性伯基特淋巴瘤病例中从MYC到MYCN表达的分子转换
摘要
MYC是人类癌症中最易改变的癌基因,属于一个大家族基因,包括MYCN和MYCL。最近,在评估侵袭性B细胞淋巴瘤中MYC基因重排与MYC蛋白表达之间的相关程度时,我们观察到少数Burkitt淋巴瘤(BL)病例尽管涉及MYC基因易位,但缺乏MYC蛋白表达。因此,在本研究中,我们旨在更好地描述此类情况。我们的研究结果确定了MYC蛋白阴性BL的两个亚组:一个亚组缺乏可检测的MYC蛋白表达,但呈现MYCN mRNA和蛋白表达。第二个特征是缺少MYC和MYCN蛋白,但显示MYCmRNA。有趣的是,这两个亚组表现出影响MYC基因家族成员的SNV的不同模式,这可能导致从MYC转换为MYCN。特别是,表达MYCN的病例显示相互作用界面上的MYCN SNV使与MYC功能丧失相关的蛋白质稳定。这一发现突出表明MYCN在这种情况下是可靠的诊断标记。然而,由于两个亚组的临床,形态和免疫组化(MYC和MYCN蛋白表达除外)重叠,根据世界卫生组织的现行标准,所述病例代表了真正的BL。
介绍
MYC,原癌基因位于染色体8q24,是在人类癌症中常见的癌基因改变最1,2。编码蛋白(MYC)是一种多功能的核磷蛋白,在细胞周期进程,细胞凋亡,细胞分化和代谢3中起关键作用。它起着转录因子的作用,它通过结合增强子序列(E-box)和募集组蛋白乙酰转移酶(HATs)来调节约15%的人类基因3的表达。除其作为经典转录因子的作用外,MYC还通过在富含基因的区域和远离已知基因的位点修饰组蛋白乙酰化来调节整体染色质结构4。通过在多个水平上控制MYC的表达,即在转录,翻译以及mRNA和蛋白质的稳定性上,在生理上可以对MYC的表达进行严格的检查。MYC属于一个大基因家族,在人类中也包括MYCN和MYCL1 5。尽管MYC家族成员在表达方式上显示出显着差异,但它们以相似的方式起作用并具有相似的基因组结构。特别是MYC和MYCN基因座的组织类似,两个基因都包含三个外显子。大部分的第一外显子和第三外显子的3'部分的含有携带转录或转录后调控序列的非翻译区5,6。因为,它们呈现高度同源性在它们的序列和蛋白结合位点并在很大程度上分享它们的靶基因,就可以补偿和在生理和病理条件下相互替代5,6,7,8。先前的研究表明MYC家族成员的交叉调控表达。特别地,已经表明,MYC和MYCN通过调节循环和通过在限定的启动子位点抑制彼此相互控制其表达9,10,11,12。
关于人类淋巴瘤,MYC通常在Burkitt淋巴瘤(BL)中表达,这是t(8; 14)(q24; q32)易位或其变体的结果。此外,可变比例的成浆细胞淋巴瘤(PBL),弥漫性大B细胞淋巴瘤(DLBCL),套细胞淋巴瘤(MCL)和浆细胞骨髓瘤表达MYC 13。相反,迄今为止,尚未在淋巴样肿瘤中系统研究MYCN表达。最近显示,MYC和MYCN都是造血干细胞(HSC)增殖,代谢生长,分化,长期自我更新活性和存活所必需的14。此外,MYCN在表示自我更新,静态干细胞,还包括造血那些切换到更高的表达MYC过境放大祖细胞进一步分化14,15,16。
有趣的是,在先前关于免疫组织化学(IHC)对MYC蛋白表达进行标准化及其与荧光原位杂交(FISH)在BL和DLBCL中与MYC基因重排的相关性的研究中,我们发现了少数携带MYC蛋白表达但没有MYC蛋白表达的BL病例。易位涉及MYC基因17。
因此,在本研究中,我们旨在(1)更好地表征缺乏MYC蛋白表达的BL病例,(2)评价BL中是否还存在MYC基因家族成员之间的串扰,以及(3)探索遗传BL病例子集的概况。
材料和方法
病例选择,免疫表型和FISH
我们研究了92例形态学和免疫表型典型的BL病例(82例儿科和10例成人;中位年龄:12岁(范围3-79))。所有病例均已根据世界卫生组织(WHO)对造血和淋巴组织肿瘤的最新分类12进行了诊断。这些病例是从四个机构的档案中检索到的,这些机构分别是锡耶纳大学医院(意大利,n = 8),柏林病理诊断实验室(德国,n = 4),内罗毕大学(肯尼亚,n = 50)和莫伊大学,埃尔多雷特(肯尼亚,n = 30),并考虑到其区域派生定义包括12个零星样本和80个地方性样本。在将这些病例纳入本研究之前,他们由专业的血液病理学家(LL,HS)进行了重新评估,并通过苏木精和曙红(H&E)或吉姆萨染色的组织切片的形态学以及免疫表型确定了诊断。补充表1总结了我们队列的主要临床特征。Benchmark Ultra(Ventana,蒙扎,意大利)使用扩展的抗原回收和DAB作为色原,对每种病例的代表性石蜡切片自动执行所有程序。通过利用克隆Y69(Ventana and Epitomics,德国)18进行MYC检测。。对于MYCN,我们使用了ab198912(Abcam,英国剑桥)。两种抗体均产生严格的核染色。作为阳性对照,使用高表达MYC蛋白并通过FISH分析以MYC基因重排为特征的BL病例。对于MYCN,将人脑组织用作对照。通过用非免疫小鼠血清替代两种抗体来提供阴性对照。由两名血液病理学家(MRA和SL)分别评估MYC和MYCN的染色强度和阳性肿瘤细胞的百分比,并根据先前发表的数据进行评分17。如果存在染色,则评估在染色强烈的核和热点区域的得分19。MYC的 FISH分析在所有情况下(ZytoLight SPEC MYC双色断裂探针,Bio-Optica,德国),均按照制造商的说明进行基因重排。此外,我们按照制造商的说明,在MYC易位阴性样品和MYC蛋白质阴性样品中使用了双融合探针(ZytoLight SPEC MYC / IGH双色双融合探针,Bio-Optica,德国)。通过IGK-MYC和IGL-MYC探针进一步评估了IGH-MYC阴性病例(补充表1)20。还如前所述进行了针对MYCN扩增的2p24 / CEP2染色体染色体的FISH分析[Vysis LSI MYCN(2p24)Spectrum Green / Vysis CEP2 Spectrum Orange探针,美国雅培] 21。应用MYCN分离FISH分析,包含四个克隆,它们位于MYCN基因的侧面,RP11-105P20(光谱绿色),RP11-422A6(光谱绿色),RP11-355H10(光谱橙色)和RP11-744F11(光谱橙色) 。对于每个标本,在配备DAPI,SpectrumGreen,SpectrumOrange滤光片的Leika DM 600B(瑞士Leica Microsystems,瑞士)或Zeiss荧光显微镜上,手动分析至少100个完整的非重叠无核。从细菌克隆的DNA制备和荧光标记遵循最近描述的协议(补充表1)22。使用适当的阴性和阳性对照22。原位杂交(ISH),用于Epstein-Barr病毒编码的RNA,(EBER)中各样品中如先前所述进行5毫米厚的部分23,24,25。对照玻片是从石蜡包埋的组织块中制备的,该组织块在每次杂交过程中均在淋巴结中含有转移性鼻咽癌。
该研究得到提交病例的机构的伦理委员会的批准,并且根据赫尔辛基宣言在获得样本之前已经获得了书面许可和知情同意。
RNA提取
根据制造商的说明,使用FFPE RNA Easy试剂盒(加利福尼亚州Qiagen)从原发肿瘤和反应性淋巴结的FFPE切片中提取RNA,并使用RNA Easy Kit(加利福尼亚州Qiagen)从细胞系中提取RNA。通过使用Nanodrop分光光度计(Celbio,意大利米兰)测量260 nm处的OD以及260/230和260/280的比值来评估RNA的数量和质量。还使用Bioanalyzer 2100(美国加利福尼亚州安吉伦特)检查RNA的质量。
RNAscope检测原位检测MYC和MYCN mRNA
进行RNA ISH研究在mRNA水平上MYC基因家族成员的表达。按照制造商的说明,使用RNAscope 2.5 HD红色检测试剂盒(Advanced Cell Diagnostics,美国加利福尼亚州海沃德)和MYC和MYCN mRNA的RNAscope探针(Hs-MYC,目录号311761; Hs-MYCN,目录号417501)。26。简而言之,将福尔马林固定石蜡包埋(FFPE)的组织切片在使用前于60°C烘烤1 h。脱石蜡和脱水后,将组织风干并用过氧化物酶阻断剂处理,然后在预处理溶液中煮沸10分钟。然后在40°C下应用蛋白酶30分钟。将目标探针在40°C杂交2小时,然后进行一系列信号放大和洗涤步骤。探针被杂交,然后是一连串的信号放大,增强了存档样品和部分降解样品中存在的低表达基因和mRNA的信号。杂交信号通过使用Fast Red的显色反应检测。mRNA染色信号被鉴定为细胞质和核红色点状点。PPIB mRNA。阴性对照背景染色通过使用对细菌dapB基因有特异性的探针进行评估。所有病例在肿瘤组织中均未显示任何信号,因此将其包括在分析中。
逆转录定量PCR(RT-qPCR)
在原发性肿瘤,的表达MYC已经通过RT-qPCR使用两种不同的方法研究:通过使用设计用引物-BLAST服务(补充表的帮助下引物2),并通过使用特定的Taqman探针为MYC基因检测所有三个MYC基因外显子(目录号4331182,ThermoFisher Scientific,美国)。这种方法旨在排除由于这些情况下的剪接变体而导致的可能的技术故障。从所有测定中获得的测量值用于计算MYC mRNA的平均值。因此,生成的MYC表达是研究的所有外显子的合并。根据制造商的说明,使用特制的Taqman探针(目录号4331182,ThermoFisher Scientific,美国)检查了MYCN mRNA。实验中包括四个内源性对照(次黄嘌呤-鸟嘌呤磷酸核糖基转移酶,HPRT;磷酸甘油酸激酶,PGK;β-2-微球蛋白,b2m; TATA-Box结合蛋白,TBP)。考虑到HPRT管家基因在我们所有情况下均显示出更高且更恒定的表达,因此我们选择了它作为每个靶基因的相对定量。
反应性淋巴结已用作对照,相对表达表示为2- ΔΔCt。
下一代测序(NGS)
根据制造商的规程,使用IonAmpliSeq综合癌症专家组(Thermo Fisher Scientific,USA)对40 ng肿瘤DNA进行409个癌症相关基因的靶向NGS。使用Ion Reporter 4.4(美国Thermo Fisher Scientific)进行比对,变异调用和过滤。使用了以下过滤器链:“中的位置utr_3,splicesite_3,exonic,splicesite_5,utr_5中的位置”,“止损,无意义,遗漏,移码插入,非移码插入,非移码块替换,移码删除,非移码” -frameshift删除,移码块替换。基本覆盖率最小为60.80%,最大为70.36%,平均等于65.71%。> Q20的读取平均值等于92.59%。
桑格测序
为了进一步探索MYCN基因座,设计了引物以扩增覆盖MYCN基因所有外显子的200bp片段。纯化PCR产物,并在两个反应中进行Sanger测序,一个反应带有正向引物,一个反应带有反向引物(Thermo Fisher Scientific,USA,目录号A15629,A15630)。
功能性体外研究
使用人类BL细胞系Namalwa(ATCC CRL-1432)和人类B淋巴母细胞系(LCL; GK-5(ATCC®CRL-183))进行体外实验。Namalwa的特征在于MYC重排和MYC mRNA的强表达。已对LCL进行了研究,以更好地了解MYC沉默的影响。两种细胞系均为EBV阳性。简而言之,将细胞在补充有10%胎牛血清(FBS),1%1-谷氨酰胺,1%青霉素/链霉素(CARLO ERBA试剂,意大利米兰)和5%CO 2的 RPMI-1640培养基中培养。,在37°C下。按照Amaxa Nucleofector设备(Lonza,科隆,德国),程序A23和溶液V(Lonza,科隆,德国),按照制造商的说明,通过核转染进行瞬时转染。用0.5和1μg靶向MYC的小干扰RNA(siRNA),esiRNA人类MYC(MISSION esiRNA Human MYC(esiRNA1),Sigma Aldrich,St.Louis,USA)或1μg靶向RLUC(esiRNA1)的esiRNA转染5×106细胞。 )用作基因抑制剂的阴性对照(MISSION esiRNA RLUC(esiRNA1),Sigma Aldrich,St.Louis,USA); 转染溶液用作模拟物。转染2μgpmaxGFP并通过流式细胞仪检测荧光和细胞活力,评估转染效率;核转染后48和72 h提取RNA。MYC和如上所述,通过RT-qPCR检查MYCN表达。
统计分析
使用IBM SPSS Statistics 20.0(IBM,Armonk,NY,美国)和Prism(GraphPad Softwares,La Jolla,CA,美国)进行统计分析。方差分析,不成对的T检验和线性回归用于连续变量分析。卡方用于非连续变量分析。所有计算均使用双面测试。所有分析的显着性极限定义为p <0.05。
建模预测效果
我们通过Ensembl Variant Effect Predictor(VEP)27注释了MYCN和MYC规范氨基酸序列上的SNV,并通过棒棒糖软件28图形显示。我们使用ELM(http://elm.eu.org/)29来预测线性动机的突变效应,而我们使用Mechismo(http://mechismo.russelllab.org/)30,使用默认设置31来预测突变效应。在3D交互界面。与我们之前的研究32相似,我们在MYC外显子2中分析了SNV磷酸位点区域富集基因,被认为是靠近磷酸位点残基的− / − 4个氨基酸的窗口。将在磷位点中观察到的SNV的频率除以在磷位点区域中观察到的SNV的数目(对于MYCN阳性和MYCN阴性分别为12和9)的长度(n = 78),而将预期频率除以总数即可的外显子2个SNV(34和31,分别地)用于它的长度(ñ = 252)(补充表3,4)。为了进行统计分析,进行了Fisher的精确检验。
结果
尽管MYC基因易位,但罕见的BL病例缺乏MYC表达
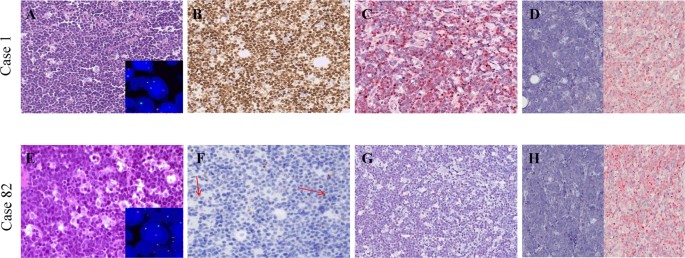
在92例病例中,有92例(98%)表现出可通过FISH分析检测到涉及MYC基因的易位(补充表1)。在免疫组织化学研究中,在92例病例中,有83例(90%)确实在80%以上的肿瘤细胞中表现出强烈的弥散性核MYC蛋白表达(图1a),其中包括2例缺乏可识别的MYC基因易位的病例由商业探针,提示存在MYC并置到未测试轻链基因座或MYC激活的替代手段之一,像的隐蔽插入MYC成Ig基因座20,33,34,35,36。
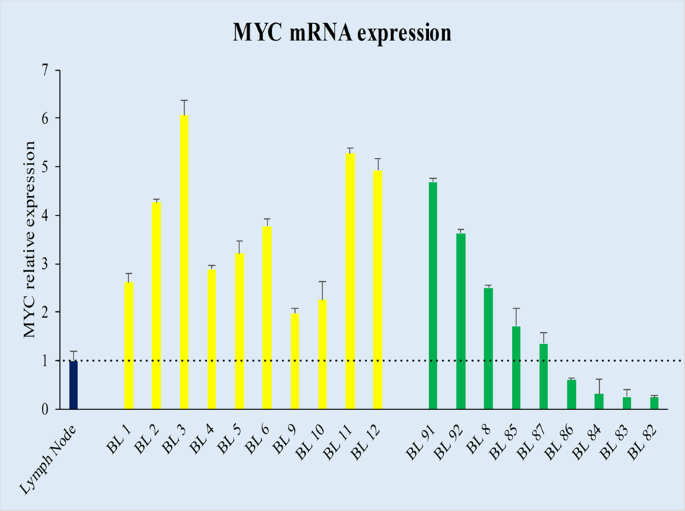
值得注意的是,携带MYC基因易位的9/90(7个地方性BL-eBL,2个零星BL-sBL)病例在蛋白质水平上不表达MYC,仅在0-5%细胞中显示弱阳性(图1b;图1b)。表1)。9例病例均表现出通过断裂探针进行的MYC基因易位,9例中有7例显示MYC / IGH融合。通过IGK和IGL探针测试了2个IGH / MYC融合探针未显示MYC与IGH并列的情况,揭示了涉及轻链λ基因位点的易位(表1)。评价在9/90例MYC患者中是否观察到缺乏MYC蛋白断点与转录或转录后问题有关,通过RNAscope和RT-qPCR研究MYC mRNA。在以免疫组织化学为特征的MYC蛋白明显表达为特征的BL病例中,检测到呈点状红点信号形式的MYC mRNA的强表达(图1a),而没有MYC蛋白的病例表现出MYC mRNA的异质染色,很少情况几乎完全是负面的(图1b)。这些发现与RT-qPCR结果(图2)重叠,后者显示MYC蛋白阳性BL病例的异质MYC mRNA水平在1.98到6.06之间,而MYC蛋白阴性标本的异种MYC mRNA水平在0.24到4.68之间(图2)。
一小部分BL病例表现出MYCN表达
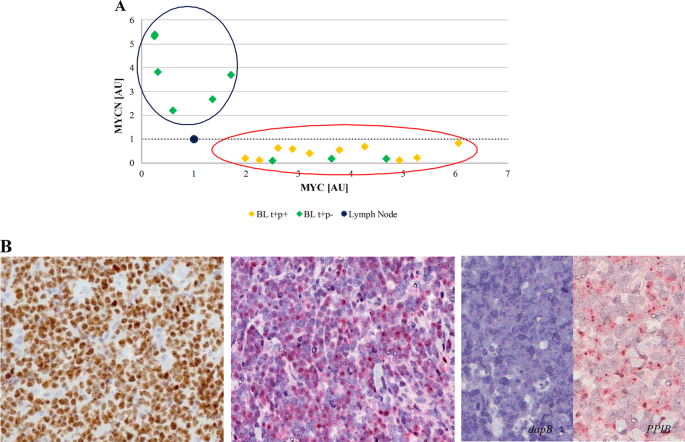
在我们的队列中,MYC mRNA和蛋白水平的异质表达提出了一个问题,即缺乏MYC mRNA和/或蛋白的病例如何才能维持完整的BL表型。以前的研究已经证明中的调节环路MYC基因家族成员,具体而言,之间MYC和MYCN 9,10,11,12,37。因此,我们评估了此类BL患者的MYCN mRNA和蛋白表达。有趣的是,我们通过RNAscope和RT-qPCR检测了我们系列中两个基因在mRNA水平上几乎相互排斥,其中表达MYCN mRNA的病例缺少MYC mRNA,反之亦然(p = 0.0003,Student'st测试,未配对)。回归分析确定了两个不同的簇:一个由六例MYC mRNA水平非常低而MYCN mRNA表达较高的病例组成。第二个簇包含所有其他情况,包括典型的BL和那些MYC蛋白阴性但显示MYC mRNA的情况(图3a)。然后,我们通过评估MYCN蛋白表达在蛋白水平上验证了我们的结果。在六个MYCN mRNA阳性样品中,在近90%的肿瘤细胞中检测到强MYCN核染色(图3b)),而其余仅显示MYC mRNA的病例在蛋白水平上不表达MYCN。在这种情况下,我们调查了造成MYCN过表达(即扩增,易位和前病毒插入)的所有机制38。具体地,通过FISH分析染色体2p24 / CEP2,未检测到MYCN基因的扩增或易位。另外,MYCN基因的测序没有提供可能的前病毒插入(通过EBV,巨细胞病毒,HHV8)的证据,这可以解释MYCN的增强在没有增加拷贝数的情况下进行转录。我们还通过应用EBER-ISH分析研究了与EBV的关联。73例(70 eBL,3 sBL)导致EBV阳性,而19例(10 eBL,9 sBL)阴性。统计分析未显示MYCN阴性(69%EBV阳性)病例和MYCN阳性(66%EBV阳性)病例之间存在显着差异。
在mRNA和蛋白质水平上,MYC和MYCN之间几乎互斥。具体而言,在MYC基因/蛋白质阴性病例中,几乎只能检测到MYCN转录物。a比较MYC(x轴)和MYCN(y轴)mRNA 表达的回归分析确定了两个不同的簇:一个由六例MYC mRNA水平非常低而MYCN mRNA表达较高(蓝色圆圈)的病例组成;第二个包含所有其他病例,包括MYC易位阳性/蛋白阳性样品,且MYC易位阳性/蛋白阴性但在mRNA水平表达MYC的病例(红色圆圈)。阈值用黑色虚线表示。b免疫组织化学评估和RNA显微镜检测MYCN蛋白和mRNA表达表明,仅在六个MYCN mRNA阳性样品中,近90%的肿瘤细胞中强烈的MYCN核染色分别被识别为棕色和红色核信号。检测dapB和PPIB的探针分别用作阴性和阳性对照。
基因组分析支持取决于MYCN表达的BL两个子集的存在
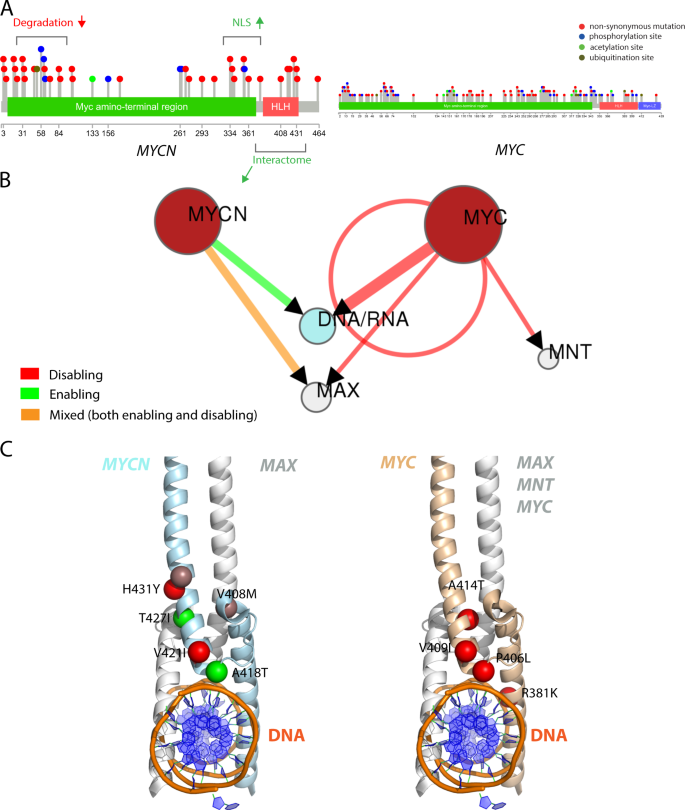
然后,我们针对9个MYC蛋白阴性病例中的8个,通过针对409个癌症相关基因的超深测序分析,获得了足够的DNA,从而探究了其遗传情况。因为我们发现,影响以前在BL和其他淋巴瘤报道基因个SNV 39,40,41,42,43,44,45,46,我们决定将我们的注意力集中的突变景观MYC家族基因。值得注意的是,在缺少MYCN表达的情况下,我们仅在MYC中鉴定了SNV基因; 具体来说,我们在编码MYC的N末端域(NTD)的区域内检测到SNV。特别是,我们报道了MYC基因中的SNV,导致第27位的氨基酸发生了变化(chr8:128,750,543A> C,p.Y27S; chr8:128,750,543A> G,p.Y27C; chr8:128,750,542T> G,p。 MYC蛋白(Y27D)(补充表S3)。这些SNV与N11多态性相邻且位于Y69目标表位内,可能会干扰抗体结合并解释MYC蛋白阴性染色。
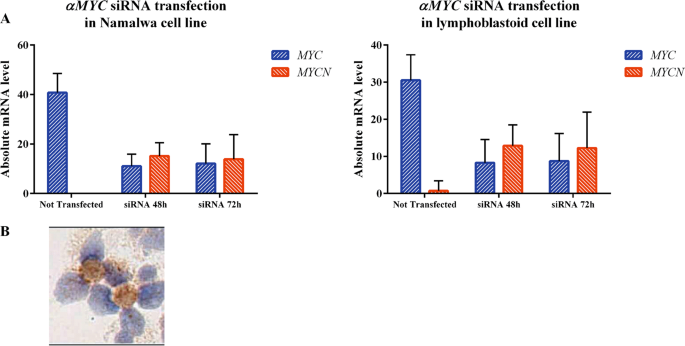
另一方面,MYCN阳性样品携带MYCN SNV,这些SNV集中在MYC氨基末端区域的N和C末端以及螺旋-环-螺旋(HLH)域(图4a),它们可能会干扰蛋白质的调节或功能动机。的确,虽然第一个区域(aa 20–90)对于翻译后修饰(PTM)和结合事件(例如GSK3,p38 MAPK,WW结合域和FBXW7)重要,导致MYCN降解47,但第二个区域(aa 大约300-370位氨基酸),包含核定位序列(NLS)(图4a;http://elm.eu.org/)。由MYCN中的非同义突变引起的总体静电电荷转换,其中近40%的SNV导致正电荷增加(补充表3),很可能会影响这些动机介导的结合和信号传导特性。沿着这条线,与在总体上被禁用的MYC相比,在这些情况下,影响C端HLH域的SNV预计会积极影响MYCN相互作用组(图4b,c)。综上所述,通过最终干扰降解信号,同时增强核定位和介导的相互作用,可以预测表达MYCN的病例中的MYCN突变导致其活性的总体稳定。有趣的是,我们发现MYC中没有显着增加SNV的外显子2 phosphosite区域(Supplemetary表3,4),这是MYC的上调在零星BL的标志32。最后,为进一步支持BL中MYC和MYCN之间串扰的假设,我们通过shRNA 沉默了BL Namalwa和LCLs细胞系中的MYC基因,并在48和72 h后评估了MYCN mRNA和蛋白表达。我们发现,MYC基因的沉默导致MYCN mRNA和蛋白质的更高表达(图5a)。特别是,siRNA核转染后,Namalwa细胞系中的MYC mRNA水平从40.79任意单位(AU)降至48小时的11.03 AU和72 h的12.11 AU,而MYCN在48小时从0增加到15.2,在72小时从13.89增加(p <0.0001)。在LCL细胞系中,MYC在48小时时从30.5下降到8.28,在72时下降到8.75,而MYCN从0.75上升到12.9和12.26(分别为48和72小时)。一致地,通过RT-qPCR转染后记录了MYCN蛋白的表达(图5b)。
在蛋白质一级序列上标注的突变(红色棒棒糖)带有有关翻译后修饰(PTM)和域组成的其他信息。线性主题注释已从ELM(http://elm.eu.org/cgimodel.py?fun=smartResult&userId=QiKSrcdQR9&EXPECT_CUTOFF=100&r=1&bg=on)获得。MYC突变已定位到典型的(来自Swissprot的亚型1,ID:P01106)蛋白亚型。仅显示MYCN阳性病例的突变。b通过Mechismo(http://mechismo.russelllab.org/)在3D交互界面上预测效果的网络表示。预测的禁用,启用和混合效果由红色,绿色和橙色箭头指示。C扰动交互界面的突变的3D卡通表示(PDB ID:1NKP)。球形着色与B中的箭头相同。对于MYC,我们显示的突变编号既涉及规范氨基酸序列,也涉及同工型2。
讨论区
在本文中,我们描述了罕见的BL病例亚群,其特征在于缺乏MYC蛋白表达和MYCN蛋白的存在。尽管FISH分析表明MYC基因易位至一个免疫球蛋白基因座,但这些罕见病例缺乏MYC蛋白表达,并表达了另一个MYC家族成员MYCN。值得注意的是,我们观察到MYC和MYCN在mRNA和蛋白质水平上的表达呈负相关。先前已经证明,MYCN能够在神经母细胞瘤细胞系和原发性肿瘤,以补偿活动MYC,相互调节环路彼此之间的现有7,8,9,10,11,12,13。NGS分析显示,在mRNA和蛋白质水平上表达或不表达MYCN的病例中,MYC家族基因的突变指纹不同。具体而言,MYCN阴性病例在位于NTD编码区域内的MYC基因中呈现SNV 。可以想象,这种SNV阻止了有效的抗原抗体反应,如最近报道的[ 34],从而确定了免疫组织化学的阴性结果。相比之下,在MYCN阳性样本中,以线性动机和相互作用界面对MYCN SNV的分析表明,可以通过降解信号的扰动,核定位的增强或相互作用组的稳定来对蛋白质活性的总体稳定产生收敛作用。另一方面,影响MYC的多个体细胞突变表明总体功能丧失表型,不同于散发的BL,后者的SNV聚集在外显子2磷酸位点区域,导致MYC上调32。令人惊讶的是,在各自的情况下,MYC和MYCN中存在的SNV 可能会激活并开启MYCN基因并通过诱导其调控环同时关闭MYC基因48。有趣的是,我们发现MYC基因的沉默导致MYCN mRNA和蛋白质的更高表达。特别地,在siRNA核转染后,MYC mRNA水平下降而MYCN mRNA水平上升,并且在细胞系中可检测到MYCN蛋白表达。
总之,可以想到,由于转录调控,MYCN决定了类似于MYC在BL细胞中发挥的分子作用,这是由于两个基因之间的相互作用,涉及MYC和MYCN 9共有的大量靶标,10,11,15,16。什么是在神经母细胞瘤细胞系和原发性肿瘤已经知道这个反射镜,其中MYC和MYCN的表达是相互排斥的9,11,15,16。值得注意的是,我们仅在小儿年龄段的MYC易位阳性BL中和仅在eBL中检测到了从MYC到MYCN表达的转换。然而,肿瘤的遗传组成表明这种转换是在存在的情况下发生的,并且可能随后发生在IG-MYC易位的情况下。因此,考虑到这些MYC蛋白阴性/ MYCN蛋白阳性MYC易位肿瘤的临床表现,形态学外观和免疫组化特征与MYC蛋白阳性BL并无不同,我们认为这并不影响诊断工作。根据世界卫生组织当前的标准13可以轻易地将病例诊断为BL 。
|
|