IGF2R的上调通过组织蛋白酶的运输逃避了溶酶体功能障碍诱导的宫颈癌细胞的凋亡
IGF2R的上调通过组织蛋白酶的运输逃避了溶酶体功能障碍诱导的宫颈癌细胞的凋亡
摘要
宫颈癌是世界上最常见的妇科恶性肿瘤。然而,晚期和复发性宫颈癌患者的存活率仍然很差。多面蛋白胰岛素样生长因子2受体(IGF2R)具有各种配体,表示为IGF-2和甘露糖6-磷酸(M6P)标记的蛋白。关于作为IGF1R信号的拮抗活性,IGF2R目前,“环糊精”被认为是抑癌基因,但其作为M6P受体的意义仍不清楚。在这里,根据TCGA和GEO开放数据集的转录组分析,我们显示IGF2R被上调并且与宫颈癌的不良预后相关。使用宫颈癌细胞系的几个实验表明,IGF2R耗竭会诱导细胞凋亡,降低细胞活力并增加对某些抗癌药物顺铂的敏感性。与它对IGF1R信号传导的影响微不足道相反,IGF2R的丧失破坏了M6P标签组织蛋白酶的高尔基体到溶酶体运输,导致溶酶体活性下降,它们的异常积累以及自噬和线粒体吞噬功能异常,从而导致溶酶的积累。蛋白质折叠错误并产生活性氧。在一起
介绍
宫颈癌是世界上最常见的妇科恶性肿瘤。2018年,约有311,000名受影响的患者死亡,占全球癌症相关死亡人数的7.5%1。细胞学检查和HPV疫苗在一些发达国家,构成一个成功的预防方案,但覆盖面仍然较低全球2,3。当前推荐的早期宫颈癌患者的治疗选择是手术或放射疗法,两者在全球范围内均能达到良好的临床效果3。尽管有5年生存率仍然很差,但已建立有/无基于顺铂的同时化疗的放射疗法已被确立为晚期宫颈癌患者的标准治疗方法3。因此,通过对患者的恶性肿瘤和治疗抗性的分子理解来发现治疗患者的新方法是最紧急的。
不依赖阳离子的甘露糖6-磷酸/胰岛素样生长因子2受体(CI-M6P / IGF2R,以下称为IGF2R)是一种1型跨膜糖蛋白,由大的N端胞外结构域组成,可使其与蛋白结合各种各样的配体的4,5,6,7。它具有两种主要的配体类型:胰岛素样生长因子2(IGF-2)和甘露糖6磷酸酯(M6P)标记的糖基化蛋白,它们在哺乳动物的正常发育和体内稳态中具有独特但重要的作用。许多研究支持这样的想法,即通过清除细胞外IGF-2 8,质膜上的IGF2R间接抑制了胰岛素样生长因子1受体(IGF1R)信号传导。。此外,一些证据表明,IGF2R与M6P标记的蛋白质结合,可以将合成的新蛋白质转运至溶酶体。在一些癌症中,在IGF2R基因座失杂(LOH)的高频已经报道8,9,10,11。此外,在一些癌症中,IGF2R抑制肿瘤的生长的异位表达12,13,而在拦截的相反的表型受体的结果14,15。因此,目前认为IGF2R是肿瘤抑制基因。然而,关键地抑制肿瘤的受体的配体仍有待确定。
在这里,我们将IGF2R鉴定为宫颈癌患者的不良预后生物标志物,并表明它具有致癌功能,与先前有关其他癌症的报道相反。IGF2R敲低会导致溶酶体酶向溶酶体的转运不足,进而触发降解活性低的异常溶酶体的积累。因此,自噬和线粒体功能的丧失会引起有害的活性氧(ROS)的积累,并且细胞中聚集的蛋白质会导致细胞凋亡。通过抑制酪蛋白激酶2(CK2)可以观察到类似的效果,据报道酪蛋白激酶2(CK2)使IGF2R的细胞质尾磷酸化,这对于高尔基体到溶酶体的运输功能是必需的。据我们所知,这是IGF2R作为治疗靶标的首次报道,
结果
IGF2R是宫颈癌患者预后不良的生物标志物
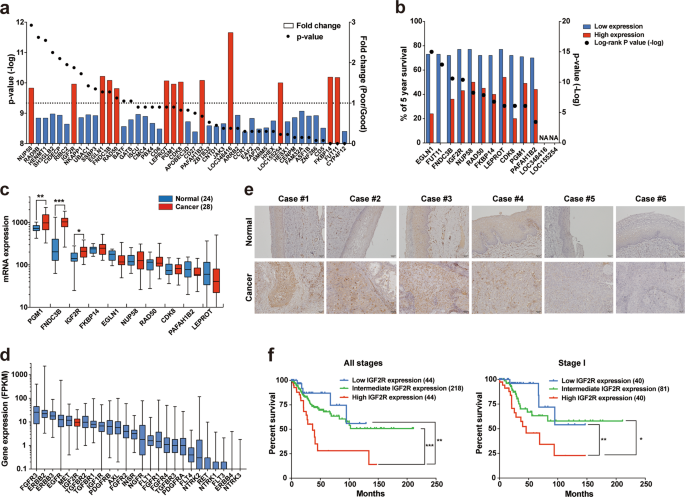
相对于好幸存者,鉴定出十三个候选基因在贫穷幸存者中高表达(图1a)。总体生存分析证实了13个候选基因中的11个是宫颈癌的独立不良预后因素(图1b)。公众可用的DNA微阵列数据集显示,三个候选(的PGM1,FNDC3B和IGF2R)在相对于正常组织子宫颈(图宫颈癌组织中异常表达1C)。最后,我们集中研究了IGF2R基因,因为它的mRNA表达高于宫颈癌组织中的其他致癌受体(图1d)。)。与DNA芯片分析结果一致,免疫组织化学染色显示宫颈癌组织中IGF2R表达较高(六分之四),而在其相应的正常宫颈组织中仅观察到弱染色(图1e)。多元组学分析表明,IGF2R中的遗传变异倾向于相互排斥,而不是胰岛素受体(INSR)或其配体中的遗传变异(补充图S1a)。但是,相关分析表明它们的mRNA表达水平之间没有关系(补充图S1b)。)。为了从这些受体的分析中获得有意义的总体结果,根据患者每个基因的中位mRNA表达水平及其标准差将患者分为三类(补充图S1c)。IGF2R高表达的患者显示宫颈癌的预后显着恶化(图1f)。相反,在IGF1R或INSR中未观察到这种趋势(补充图S1d)。值得注意的是,IGF2R的高表达也不利于I期宫颈癌患者(图1f),表明其在早期诊断过程中作为预后指标的临床用途。总体生存分析还表明,IGF2R的高表达不仅对于宫颈癌而且对于乳腺癌和卵巢癌都是不良的预后因素。此外,IGF2R的高表达与肾癌和黑色素瘤的预后良好相关。但是,对于后者,这并不重要(对数秩检验;补充图S1e)。在宫颈癌中,IGF2R的表达与临床分期相关,但与远处转移或主要治疗结果无关(表1)。实际上,治疗前后IGF2R mRNA表达没有变化(补充图S1f)。考虑到IGF2R高表达患者的无进展生存期较短(未显示),该受体可能在宫颈癌患者的复发中起作用。
a鉴定预后不良患者中表达降低或增加的基因。每个点和条分别指示p值和倍数变化。倍数变化值由短期存活者(在诊断后2年内死亡; 43例)的平均表达除以长期存活者(在诊断后4年以上; 52例)的平均表达来计算。红色和蓝色条分别表示短期幸存者与长期幸存者相比的高表达和低表达。候选基因按升序排列。b患者生存率与短期生存者中表达增加的基因的mRNA表达水平之间的相关性。每个点表示对数等级p-值。蓝色和红色条分别表示相应基因低表达水平和高表达水平的患者组中5年总生存率。不适用,数据不可用。c正常子宫颈(24例,蓝色框)和宫颈癌(28例,红色框)样品之间的差异基因表达。d主要受体酪氨酸激酶的基因表达。将每个mRNA表达水平均归一化为FPKM值。框和条分别表示从第一到第三四分位数和从最小到最大的范围。e正常宫颈和宫颈癌组织中IGF2R的免疫组织化学。比例尺,50μm。F通过IGF2R mRNA表达分类的宫颈癌患者群体的总体生存分析。*,**和***分别表示p <0.05,p <0.01和p <0.001。
IGF2R的丢失诱导子宫颈癌细胞凋亡和药物敏感性
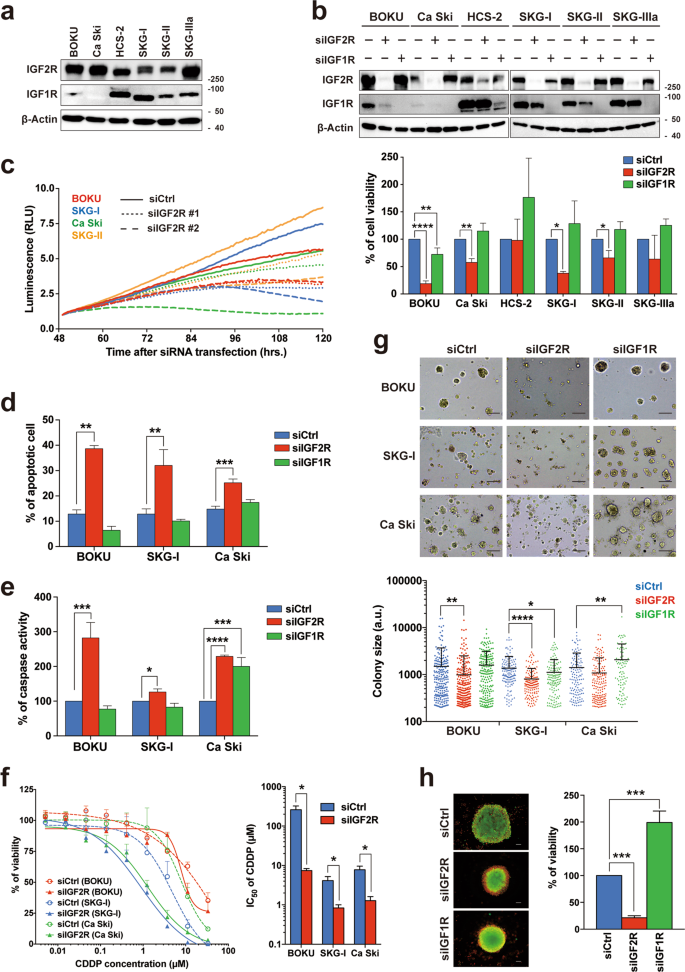
为了研究IGF2R和IGF1R在宫颈癌细胞中的生物学意义,我们使用基因敲低分析了六种宫颈癌细胞系。在每个基因中,mRNA表达水平与蛋白质表达水平呈正相关(补充图S2a)。与宫颈癌组织的RNAseq数据集的相关分析一致(补充图S1b),IGF2R和IGF1R蛋白表达之间没有关系(图2a)。尽管IGF2R敲除会随着时间的推移显着降低四个中的四个细胞系的细胞活力,但是在IGF1R敲除后,未观察到对细胞活力的正面或负面影响(图2b,下图和图2c))。尽管IGF2R和IGF1R敲低都不能改变子宫颈癌细胞的细胞周期状态(补充图S2b),但只有凋亡细胞和胱天蛋白酶活性被IGF2R敲除显着增加(图2d,e和补充图S2c)。有趣的是,IGF2R的敲低还增强了细胞对顺铂的敏感性(图2f),表明IGF2R有助于化疗的难治性。相反,对细胞迁移和侵袭的抑制作用可忽略不计(补充图S2d,e)。最后,IGF2R的敲低同时降低了菌落和球体的形成能力(图2g,h)。IGF1R似乎受IGF2R敲低的影响,尤其是在BOKU细胞系中。用几种IGF2R siRNA进行的蛋白质印迹显示,在大多数IGF2R组合式转染情况下,IGF1R的表达不受影响(补充图S2f)。我们选择了IGF1R表达没有降低的siIGF2R#2,并验证了细胞活力(补充图S2f和图2c)。siIGF2R#2对IGF2R的抑制作用还降低了BOKU细胞中的集落形成能力并增强了细胞对顺铂的敏感性(补充图S2g,h)。因此,IGF2R的丢失会诱导宫颈癌细胞中caspase依赖性凋亡和药物敏感性。
一对宫颈癌细胞系IGF2R和IGF1R的Western blot分析。b宫颈癌细胞中IGF2R和IGF1R的瞬时敲低。siRNA转染后144小时,分别通过蛋白质印迹分析和细胞生存力分析来分析基因的敲低水平(上图)和细胞生存力(下图)。c在IGF2R抑制下细胞生长的时程分析(siIGF2R#1:s7219和siIGF2R#2:HSS105256)。d具有IGF2R或IGF1R抑制的细胞的凋亡状态。通过流式细胞仪分析siRNA转染后144 h的凋亡细胞群(膜联蛋白V-FITC +)。点图显示在补充图S2c中。ËsiRNA转染后144 h,IGF2R-或IGF1R-knockdown细胞的caspase 3和7的总活性。f IGF2R组合式细胞对顺铂的敏感性。siRNA转染后48小时,将细胞进一步暴露于各种浓度的顺铂96小时。左面板和右面板显示了顺铂(CDDP)的剂量反应曲线和IC 50值。g在siRNA转染后第12天进行基于Matrigel的三维培养测定。菌落和菌落大小的代表性图像分别显示在顶部和底部面板中。au:任意单位。HsiRNA转染后第12天在非粘附板上培养的细胞的球状形成能力通过活着和死去染色来检测(左图)。绿色和红色分别表示活细胞和死细胞。培养的球体的细胞活力通过监测其ATP水平进行验证(右图)。所有误差条代表三个独立实验的标准偏差。* p < 0.05,** p < 0.01,** * p < 0.001,**** p < 0.0001; 使用Welch校正和Dunnett多重比较测试进行t检验。比例尺代表100μm。
IGF2R的致癌功能独立于IGF1R信号传导
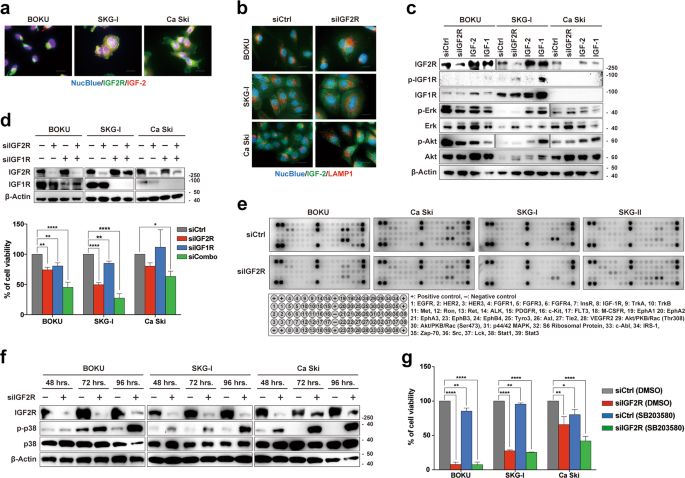
由于IGF2R被广泛接受为可激活IGF1R信号传导的IGF-2清除剂,因此我们验证了IGF2R敲低诱导的细胞凋亡是否可归因于IGF1R信号传导的改变。免疫细胞化学分析显示,如先前报道的,IGF-2与宫颈癌细胞和其他癌细胞上的IGF2R结合(图3a)。但是,IGF2R的敲低并没有抑制IGF-2向溶酶体的转运(图3b)。IGF2R敲低或IGF-2添加均未激活IGF1R信号传导途径(图3c)。此外,IGF1R敲低不能挽救由IGF2R敲低引起的细胞死亡(图3d)。这表明IGF-2–IGF1R信号在宫颈癌细胞中并不特别重要。除了IGF1R,主要的受体酪氨酸激酶信号转导途径并未因IGF2R的抑制而改变(图3e)。进一步的信号分析表明,IGF2R敲低以时间依赖性方式激活了应力激活的丝氨酸/苏氨酸蛋白激酶,p38丝裂原活化的蛋白激酶(图3f),而抑制该激酶并不能挽救IGF2R敲低诱导的细胞死亡(图3g),提示与细胞死亡有关的间接信号激活。因此,我们认为在宫颈癌中可能存在新的致癌IGF2R机制。
在宫颈癌细胞中IGF2R(绿色)和IGF-2(红色)的共定位。b IGF2R对IGF-2降解的影响。在IGF2R敲低后96小时,细胞用抗IGF-2(绿色)和抗LAMP1(红色)抗体染色。c激活宫颈癌细胞中的IGF1R信号通路。通过蛋白质印迹分析来分析IGF1R及其下游激酶的磷酸化。除了siRNA转染后24小时的IGF2R敲除样品外,还分析了在其配体刺激后15分钟后回收的其他样品(IGF-1和IGF-2)。dIGF2R和IGF1R组合对细胞活力的综合影响。通过Western印迹分析证实了每个受体的敲低(上图)。底部小图显示在144小时的细胞在转染后的生存能力ë主要的RTK在siRNA转染后72小时在IGF2R敲低细胞中信号的磷酸化的轮廓。完整的目标图显示在底部面板中。f IGF2R敲低后p38 MAPK磷酸化状态随时间的变化。h p38 MAPK抑制对IGF2R敲低诱导的细胞死亡的挽救作用。将转染了siRNA的细胞进一步暴露于1μMSB203580(p38 MAPK抑制剂)中96小时,然后测量其活力。所有误差条代表三个独立实验的标准偏差。*p < 0.05,** p < 0.01,**** p < 0.0001; Dunnett的多重比较测试。比例尺代表20μm。
IGF2R敲低下调以高尔基体为中心的囊泡运输
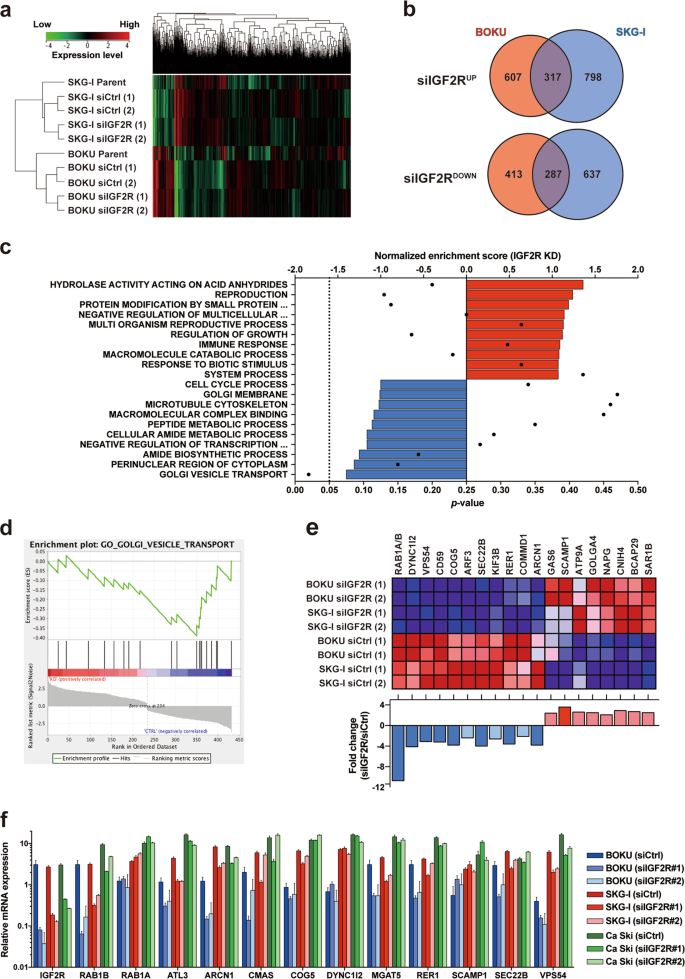
在IGF2R敲减型子宫颈癌细胞中进行转录组分析(图4a),分别确定了317和287个基因通常通过IGF2R敲除而上调或下调(图4b,补充表S1和GEO登录号:GSE137998)。尽管基因集富集分析确定了正向富集和负向富集的候选基因(图4c),但是与高尔基体中囊泡运输有关的基因集是其中唯一的重要结果。总的来说,IGF2R的抑制降低了该基因集中11个基因的表达(图4d–f),表明该受体参与了高尔基体中小泡运输的调节。
一个无监督基于基因表达的分级聚类。一式两份分析了来自siRNA转染细胞的相同总RNA(即(1)和(2))。b子宫颈癌细胞中IGF2R调控的基因。通过IGF2R抑制表达增加(顶部)或减少(底部)的探针的维恩图。圆圈中显示了每组中探针的数量。补充表1中显示了细胞系中常见的探针列表。c探针集的基因集富集分析(GSEA),通常在IGF2R敲低后会改变其表达。图中显示排名最高的基因本体术语。条形图表示归一化的富集得分和p每个基因本体项的-值。垂直虚线表示p = 0.05。d基因本体术语“ GOLGI VESICLE TRANSPORT”的富集图,这是GSEA中唯一具有显着p值的基因集。e(d)中包含的基因中包含的19个基因的表达谱。siRNA转染的样品中基因的mRNA表达水平以热图显示(上图)。红色和蓝色列分别代表基因表达的增加和减少。(c)中各组之间的倍数变化值显示在底部面板中。F(d)中设定的基因中mRNA表达水平的定量。使用了两种靶向IGF2R的siRNA(#1和#2)。误差棒描述了标准误差。
IGF2R通过调节溶酶体稳态来维持自噬和线粒体吞噬
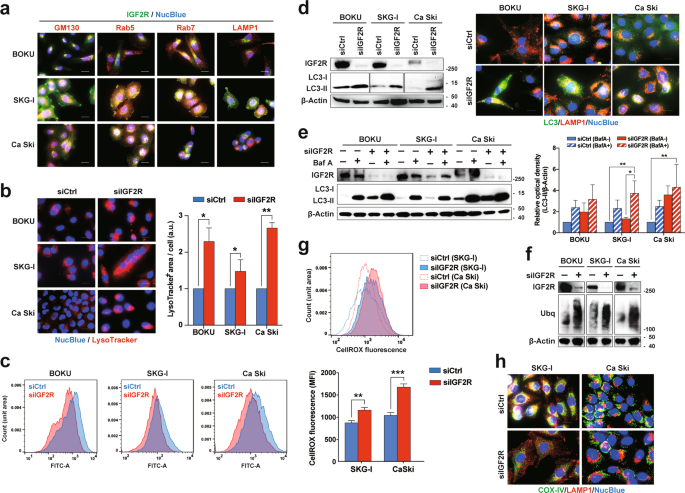
IGF2R与M6P标记的蛋白质结合,并通过水泡转运系统16将它们从反高尔基网络(TGN)转运至溶酶体。此外,该受体的超过90%的周围局部化细胞内细胞器,例如高尔基体装置和晚期内涵体17,18。与这些发现一致,大多数IGF2R位于细胞内,并与高尔基体和早期/晚期内体共定位,而与溶酶体共定位(补充图S3a和图5a))。接下来,我们验证了IGF2R敲低细胞中的溶酶体功能,因为溶酶体被认为是受M6P标记的溶酶体酶递送不足影响最大的细胞器。在IGF2R敲低的细胞中观察到酸性和LAMP1阳性细胞器的时间依赖性积累(图5b和补充图S3b,c),表明该受体维持了溶酶体稳态。溶酶体膜通透性(LMP)的增加通过将溶酶体酶释放到细胞质中诱导凋亡。然而,在图19中,IGF2R敲低没有诱导LMP(补充图S3d)。相比之下,溶酶体酶的活性会因IGF2R的消耗而降低(图5c和补充图5。S3e)。溶酶体与各种类型的自噬密不可分,例如自噬和线粒体20。在这里,IGF2R组合式促进了自噬体的形成(图5d)。如通过三个独立实验的光密度法分析所证实的,考虑到IGF2R敲低并不能增强bafilomycin A诱导的LC3-II转化,该敲低具有自噬抑制作用(图5e)。因此,观察到多泛素化蛋白在IGF2R耗尽的细胞中积累(图5f)。此外,IGF2R的敲低大大降低了线粒体膜电位,表明受损的线粒体在细胞中积累(补充图3f)。)。结果,在IGF2R敲低细胞中ROS产生增加(图5g)。免疫细胞化学分析显示,IGF2R敲低细胞中有丝分裂小体丢失(图5h),表明IGF2R对于自噬和线粒体吞噬至关重要。
IGF2R在亚细胞区室中的分布。GM130,Rab5,Rab7和LAMP1分别是高尔基体,早期内体,晚期内体和溶酶体的标记。b siRNA转染后96小时,IGF2R组合式细胞中酸性细胞器的积累。测量细胞中的LysoTracker +面积,并通过细胞核数目进行归一化。c IGF2R敲低细胞中的溶酶体酶活性。使用自淬灭荧光团标记的肽探针评估活性,该探针可响应溶酶体酶裂解产生绿色荧光。siRNA转染后96小时的探针处理细胞的流式细胞仪分析。d通过损失IGF2R诱导自噬体形成。siRNA转染后96小时,细胞中LC3-I和LC3-II状态的蛋白质印迹分析(左图)。在相同条件下,细胞中自噬体和自溶酶体的免疫细胞化学分析(右图)。抗LC3和抗LAMP1抗体分别用于检测自噬体(绿色)和溶酶体(红色)。e自噬通量对IGF2R敲低的影响。Western印迹分析显示,在经过siRNA转染的细胞中,LC3-I转化为LC3-II(96小时),然后用溶酶体酸化抑制剂Bafilomycin A1处理24小时(左图)。来自三个独立实验的光密度分析(右图)。FsiRNA转染后72 h,IGF2R敲低细胞中泛素化蛋白的蛋白质印迹分析。g具有IGF2R抑制作用的细胞中活性氧(ROS)的产生。用CellROX试剂分析细胞内ROS的量,该试剂通过氧化产生荧光。流式细胞仪的代表性直方图(上图)及其平均荧光强度(下图)。h IGF2R丧失的细胞中的吞噬活动。转染后96 h,在IGF2R敲低下的细胞的代表性图像。用抗COX IV(绿色)和抗LAMP1(红色)抗体分别染色细胞中的线粒体和溶酶体。所有误差条代表三个独立实验的标准偏差。* p < 0.05,** p < 0.01,** * p < 0.001;使用Welch校正和Tukey多重比较测试进行t检验。比例尺代表20μm。
IGF2R在组织蛋白酶有效运输到溶酶体中起主要作用
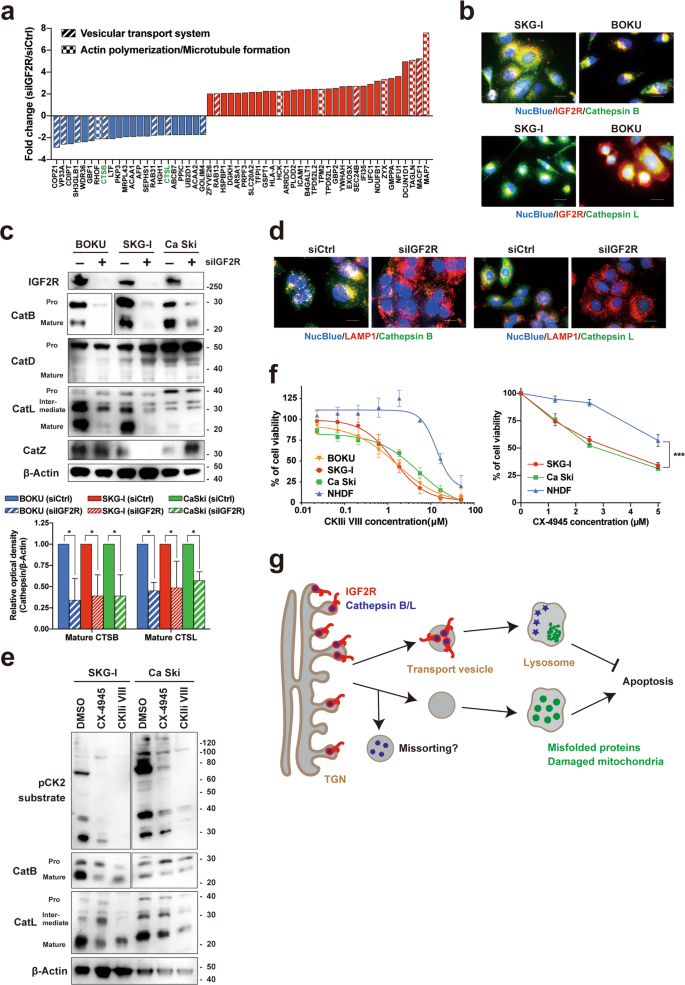
基于质谱的综合蛋白质组学分析表明,IGF2R的下调可下调许多与囊泡转运系统相关的蛋白质,与转录组分析一致(图6a)。值得注意的是,两种M6P标记的溶酶体酶(组织蛋白酶B和L)通过IGF2R敲低而下调。在正常条件下,组织蛋白酶B和L在宫颈癌细胞中均与IGF2R部分共定位(图6b)。对外部RNAseq数据的分析表明,组织蛋白酶家族的四个成员(CTSD,CTSB,CTSZ和CTSL)的表达相对较高(补充图S4a)。)。此外,蛋白质组学数据显示,在IGF2R敲低的细胞中所有组织蛋白酶均被下调(补充图S4b)。当与高CTSB和CTSZ表达相关时,RNAseq数据还显示宫颈癌患者的生存期明显较差(补充图S4c)。IGF2R的mRNA表达水平与组织蛋白酶的mRNA表达水平之间没有相关性(补充图S4d)。组织蛋白酶的mRNA表达不受IGF2R的损失影响很大(补充图S4e)。相比之下,组织蛋白酶B和组织蛋白酶L的蛋白表达水平通过IGF2R敲低而显着降低(图6c,d)。值得注意的是,IGF2R的缺失下调了成熟组织蛋白酶的蛋白表达,但对它们的mRNA表达却显示出较低的影响,表明这些蛋白从TGN到转录酶的转录后细胞内转运失败。考虑到IGF2R敲低抑制了溶酶体活性,这些组织蛋白酶的不完全转运可能是IGF2R耗竭诱导的细胞凋亡的主要原因。细胞内蛋白质的异常释放是细胞凋亡的另一个可能原因,因为大多数溶酶体水解酶被分泌到M6P受体缺陷细胞中的细胞外区域16。但是,IGF2R敲低细胞的分泌因子并未抑制细胞生长(补充图S4f)。阳离子依赖性甘露糖6磷酸受体(CD-M6PR,以下称M6PR)也已被报道为主要的M6P受体21。我们进一步研究了宫颈癌细胞中IGF2R和M6PR之间的关系。DNA芯片分析表明,M6PR在宫颈癌组织中未异常表达(补充图S4g)。此外,M6PR的mRNA表达水平不影响宫颈癌患者的预后(补充图S4h)。与IGF2R相比,M6PR敲低不影响细胞内组织蛋白酶,蛋白质泛素化或宫颈癌细胞的存活(补充图S4i,j)。
siRNA转染后96 h对IGF2R敲低细胞(SKG-1和CaSki)的蛋白质组学分析。通过数字化从质谱获得的峰强度来计算每个倍数变化值。当前已知的M6P标记的蛋白质为绿色。b组织蛋白酶和IGF2R在宫颈癌细胞中的共定位。亲代细胞与抗组织蛋白酶B / L(绿色)和抗IGF2R(红色)抗体共同染色。c IGF2R敲低(72小时)对组织蛋白酶的蛋白表达和加工的影响。Western印迹(上图)和来自三个独立实验的成熟组织蛋白酶B和L表达的光密度分析(下图)。d IGF2R敲低后(72小时)组织蛋白酶的细胞内分布变化。e CK2抑制剂对组织蛋白酶的蛋白表达和加工的影响。通过蛋白质印迹分析了CK2抑制剂处理的细胞(72小时)中的蛋白表达。f CK2抑制剂对子宫颈癌细胞和正常人皮肤成纤维细胞(NHDFs)的细胞活力的剂量反应作用。处理后96小时检测到活细胞。g IGF2R在宫颈癌细胞中的生物学意义示意图。所有误差条代表三个独立实验的标准偏差。* p < 0.05,*** p < 0.001; 使用Welch校正和Dunnett多重比较测试进行t检验。比例尺代表20μm。
CK2的阻滞抑制了IGF2R介导的转运并诱导癌细胞死亡
CK2磷酸化IGF2R和M6PR的胞质尾,这是至关重要的,以形成具有网格蛋白衔接蛋白的复合体,并且这之后是贩卖22,23,24。为了阐明CK2对IGF2R的抑制作用,我们分析了CK2抑制剂CX-4945(silmitasertib)和CK2抑制剂VIII对IGF2R的亚细胞定位的调节。如所预期的,用这些化合物进行的治疗增加了IGF2R在高尔基体中的定位,并降低了其在晚期内体中的定位(补充图4l)。与IGF2R抑制相似,在CK2抑制剂处理的细胞中,成熟的组织蛋白酶B和L的蛋白表达水平降低,有效抑制了CK2的活性(图6e))。此外,观察到酸性细胞器的剂量依赖性积累(补充图S4k),其具有与IGF2R敲低细胞相同的表型。值得注意的是,与正常人皮肤成纤维细胞(NHDFs)相比,CK2抑制剂选择性抑制宫颈癌细胞的存活(图6f)。这些结果表明,CK2的药理抑制作用可调节子宫颈癌细胞中IGF2R的致癌功能。然而,这项研究没有显示出IGF2R和CK2的直接相互作用(例如,CK2使IGF2R磷酸化)。为了开发基于CK2-IGF2R轴的治疗策略,还需要进一步的研究。
讨论区
发现新的生物标志物和治疗目标以实现分层和精密药物变得越来越重要。不幸的是,在宫颈癌中,使用常规的肿瘤标志物如SCC,CEA和CA-125仍然是主要的做法25。最近的综合组学方法表明,子宫颈癌患者可以通过其基因组和蛋白质组学特征(例如,PI3K途径的激活)分为临床相关的亚组26。当前的临床试验表明,对PI3KCA突变型宫颈癌患者使用PI3K或mTOR抑制剂是有效的27。这些先前的报告有力地支持了宫颈癌个体药物的光明前景。但是,目前可用的生物标记物数量有限。
在这里,我们确定了IGF2R是宫颈癌患者预后不良的新型生物标志物。而IGF2R是在人体组织中广泛表达28,染色体基因座的LOH和蛋白表达的减少在各种类型的癌症中常常观测到8,9,10,11,29。该证据支持了目前对IGF2R作为肿瘤抑制基因的共识。但是,对于宫颈癌,IGF2R在癌组织中的表达增加(图1c,e),而IGF2R高表达的患者预后较差(图1f)。)。IGF2R表达已与原发性胶质母细胞瘤肿瘤中复发相关的预后相关30。因此,在某些癌症中,IGF2R可能不是作为肿瘤抑制基因,而是作为癌基因。这也是表示从生存分析:高IGF2R表达在数种类型的癌症的预后不良相关,而IGF2R威力功能如在癌症中的肿瘤抑制,其中高IGF2R表达与良好预后(补充图相关S1E)。令人惊讶的是,我们的RNAseq数据分析表明,IGF2R还是早期宫颈癌的不良预后因素(图1f),提示其在肿瘤复发中的作用。除了最近的外科手术发展,对于早期子宫颈癌,辅助治疗的临床效果最近也得到了改善。因此,先发制人的医疗服务可能对IGF2R高表达的早期宫颈癌患者产生临床益处。
我们的基因敲低研究表明,IGF2R对于细胞存活是必不可少的,并且细胞活力会随着时间而降低(图2b,c)。SKG-IIIa和HCS-2的细胞活力不受IGF2R敲除的显着影响,这可能是由于HCS-2中IGF2R的敲除不足所致。同时,IGF2R敲低并不明显,但倾向于降低SKG-IIIa细胞的活力。IGF1R的表达也受IGF2R敲低的影响,特别是在BOKU细胞中(图2b)。但是,验证分析表明,单个IGF2R敲低足以降低细胞活力和集落形成并诱导对顺铂的敏感性,而IGF1R表达却没有变化(补充图S2f–h)。此外,IGF2R的缺失会诱导caspase介导的宫颈癌细胞凋亡(图2d,e)。有趣的是,这些观察结果与非小细胞肺癌研究31相矛盾。同时,另一项研究报道了IGF2R诱导的血管瘤细胞凋亡的丧失32。因此,IGF2R的两面性状可能取决于细胞类型。由于目前的RNAseq数据分析显示,IGF2R的高表达与某些妇科癌症的预后不良有关(补充图S1e),因此需要进一步的研究来阐明IGF2R在这些癌症中的致癌功能。
IGF2R的主要生物学功能是通过剥夺细胞外IGF-2配体来抑制IGF1R信号传导。一些研究通过其对致癌IGF-2–IGF1R信号轴的负调控来解释IGF2R的肿瘤抑制功能33。但是,我们的研究表明,在宫颈癌细胞中,IGF2R的丢失并没有改变主要受体酪氨酸激酶的途径(图3c,e)。在某些细胞系中,Akt和S6核糖体蛋白的磷酸化作用似乎减少了。然而,这些变化不是普遍的,并且通过蛋白质印迹分析在不同细胞系中Akt磷酸化的模式不均匀(图3c)。考虑到IGF1R敲低不会增加细胞凋亡(图2d),IGF-2–IGF1R信号对于宫颈癌细胞的存活不是必需的。或者,IGF2R抑制可诱导蛋白水解活性较低的异常溶酶体的积累(补充图S3c和图5c))。因此,IGF2R通过维持高尔基体到溶酶体的运输,在溶酶体稳态中起关键作用。溶酶体与自噬有着不可分割的联系,自噬是细胞内组分降解和循环的重要过程。从自噬通量分析来看,IGF2R敲低并不能增强bafilomycin A诱导的LC3-II转化,表明这种敲低具有自噬抑制作用。同时,bafilomycin A增强了IGF2R敲低背景中LC3-II的表达,表明IGF2R敲低的自噬抑制作用不如bafilomycin A强(图5e)。多聚泛素化蛋白和ROS的积累也支持了这一观点,这些蛋白本应受到自噬和线粒体吞噬的调节(图5f)。)34,35。这些连续的失败可能导致宫颈癌细胞中凋亡介导的细胞死亡。这些要点表明,对细胞生存力的影响需要时间才能显现。因此,我们决定在siRNA转染后144小时检测细胞活力。
在溶酶体酶中,组织蛋白酶是参与溶酶体细胞器系统的关键酸水解酶。它们几乎参与与溶酶体有关的所有过程,例如自噬。组织蛋白酶被合成为无活性的前蛋白酶,然后通过糖基化进行翻译后修饰。在此过程中,M6P对于通过与IGF2R 36的相互作用转运至溶酶体是必需的。我们的IGF2R敲低实验清楚地诱导了组织蛋白酶表达的损失,尤其是组织蛋白酶B和L的缺失(图6c)。已经发现组织蛋白酶在M6P受体缺陷型细胞被细胞外分泌16,37。因此,IGF2R耗竭可能会切断未成熟的组织蛋白酶对溶酶体的成熟供应,通过与M6PR介导的运输不同的机制(例如,分泌途径)将积累的未成熟的组织蛋白酶释放到细胞外空间。由于缺少它们,成熟和未成熟的组织蛋白酶均减少。我们试图通过使用cDNA和慢病毒载体或下拉测定法,通过IGF2R过表达来显示IGF2R和组织蛋白酶的直接相互作用;但是,我们失败了,这可能是由于IGF2R的大小(275 kDa)和缺乏合适的抗体所致。尽管已知M6PR可以运输M6P标记的货物,但在M6PR敲低的细胞中均未观察到组织蛋白酶表达的降低或细胞存活率的降低(补充图S4i,j)36。因此,IGF2R阻断对宫颈癌细胞可能至关重要,而这种高尔基体到溶酶体转运系统的阻断可能是潜在的治疗靶点。
据报道,IGF2R在其胞质尾部具有四个磷酸化位点,这对于IGF2R介导的运输是必不可少的36。磷酸化后,网格蛋白衔接蛋白被招募的磷酸化位点,通过网格蛋白介导的机械从TGN终于崭露头角的21,22,23。重要的是,这种磷酸化是由CK2,丝氨酸催化/苏氨酸激酶24,38。还已知CK2调节细胞周期和几种信号传导途径,例如Wnt途径39。在宫颈癌中,与正常角质形成细胞相比,HPV永生化细胞系中的CK2活性更高,并且受HPV E7病毒癌蛋白40调节。。实际上,CK2抑制剂可杀死子宫颈癌细胞。已发现CK2抑制剂CIGB-300可抑制子宫颈癌细胞的增殖并显示与紫杉醇和阿霉素的协同作用41。我们的研究表明,两种CK2抑制剂(CX-4945和CKII抑制剂VIII)均抑制了IGF2R从TGN 向内体的转运(补充图S41)。此外,如在IGF2R敲低细胞中观察到的,这些抑制剂还诱导了酸性细胞器的积累以及成熟组织蛋白酶B和L的下调(补充图S4k和图6e)。)。siIGF2R和CK2抑制作用使“ pro”和“中间”组织蛋白酶的表达略有不同。“ pro”和“中间”组织蛋白酶在IGF2R抑制细胞中下调,但在CK2抑制细胞中影响不大。但是,这些表达方式也因CK2抑制剂的类型而不同。CK2抑制剂不仅可能影响IGF2R,还可能影响另一种M6PR,这些差异可能是由于CK2受到阻滞或对“前”和“中”组织蛋白酶的贩运具有抑制剂特异性作用的结果。考虑到本研究中证明的IGF2R功能,抑制剂的选择性杀伤能力可能归因于IGF2R功能的抑制(图6f,补充图S4k,l)。我们试图通过检测CK2抑制剂对IGF2R的直接磷酸化和CK2敲低来显示CK2和IGF2R之间的直接关系。然而,由于难以检测其磷酸化并敲低整个CK2,因此未能实现。或者,我们研究了IGF2R敲低和CK2抑制的相似性,以显示间接CK2-IGF2R轴。CX-4945和CIGB-300已经在临床试验中的几个过去和现在的癌症研究,包括子宫颈癌42,43。我们的结果表明,CK2抑制剂是有前途的药物,不仅针对细胞周期和几种信号通路,而且还靶向IGF2R介导的M6P货物运输,因此有必要进行更具挑战性但有益的研究。
总之,我们已经表明,IGF2R的高表达与宫颈癌的不良预后相关。IGF2R具有与目前公认的抑制肿瘤作用相反的作用,并且其作为M6P货物转运蛋白维持溶酶体稳态的功能在宫颈癌细胞中很重要(图6g)。因此,靶向IGF2R本身,带有M6P标签的货物或通过CK2抑制剂转运高尔基体到溶酶体可能是潜在的治疗策略。此外,IGF2R的表达可用作宫颈癌患者的预后生物标志物。
材料和方法
临床样本
宫颈癌组织样品是从庆应义Hospital大学医院(日本东京)进行手术的患者中获得的。所有六名患者均已获得庆应义University大学伦理委员会批准的研究方案的书面知情同意书(第2007-0081号,2013-0336号)。根据批准的指南对组织样本进行实验。
外部数据分析
可从The cBioPortal for Cancer Genomics网站(cBioPortal,http://www.cbioportal.org/)下载归一化的RNA序列数据(RNA Seq V2 RSEM)及其子宫颈鳞状细胞癌和宫颈内膜腺癌的相应临床信息。)。网站使用相同的数据集执行了基因突变,拷贝数变化和mRNA表达的整合分析(OncoPrint),以及目的基因(GOI)的共表达分析。在每个GOI中,均按FPKM值对样品进行分类,并使用Kaplan-Meier方法和对数秩检验分析每组的总生存期。在某些GOI中,上述数据集中的样本数量有限(291例),所有这些样本都可以从The Human Protein Atlas网站(Protein Atlas(https://www.proteinatlas.org/)用于生存分析。从20%到80%的所有FPKM值都用于对数秩检验来分类和检查总体存活率的显着差异。其中,对数秩p值最低的组用于本研究。GOI在另外16种癌症中的总体存活率也可以从Protein Atlas网站上下载进行分析。通过Gene Expression Omnibus网站(https://www.ncbi.nlm.nih.gov/geo/),下载了包括正常宫颈(24例)和宫颈癌(28例)样本的DNA微阵列数据集(GDS3233),并分析了GOI的标准化mRNA表达值。还可以从ArrayExpress(GEOD-27678,https://www.ebi.ac.uk/arrayexpress/ )下载IGF2R的标准化mRNA表达数据,其中包括接受放疗前后(20例)或放化疗(19例)。
细胞系和细胞培养
人宫颈癌细胞系(BOKU,SKG-I,SKG-II,SKG-IIIa,HCS-2和Ca Ski)和主要的NHDFs分别购自日本研究生物资源细胞库和细胞系统公司。BOKU,SKG-I,SKG-II和SKG-IIIa细胞在Ham's F12(和光,大阪,日本)中培养;在EMEM(Wako)中培养HCS-2;Ca Ski在RPMI-1640(Wako)中培养;NHDFs在含有10%胎牛血清(FBS)(Gibco,Waltham,MA,USA)和100 U / mL青霉素-链霉素(Gibco)的DMEM(Wako)中培养。将所有细胞系维持在37℃,5%CO 2的条件下。为了避免交叉污染和不正确的身份验证,所有细胞系均在购买后的4年内用于实验。
药物和抗体
本研究中使用的化合物包括顺铂(Wako),巴氟霉素A1,CX-4945(AdipoGen,CA,Switzerland),CKII抑制剂VIII(Merck Millipore,Burlington,MA,USA)和SB2035801(Cayman Chemical,Ann Arbor,美国密歇根州)。抗组织蛋白酶D(C-5),抗组织蛋白酶Z(F-6)和抗泛素(F-11)抗体获自Santa Cruz Biotechnology(美国德克萨斯州达拉斯)。抗IGF2R(D8Z3J),抗IGF1R(D23H3),抗磷IGF1R,抗Rab5(C8B1),抗LAMP1(D4O1S),抗LC3A / B(D3U4C),Alexa Fluor 488偶联抗COX IV(3E11),抗组织蛋白酶B(D1C7Y),抗p44 / 42 MAPK(137F5),抗磷酸p44 / 42 MAPK(Thr202 / Tyr204,D13.14.4E),抗Akt(C67E7),抗磷酸化Akt(S473,D9E),抗p38 MAPK(D13E1),抗磷酸化p38 MAPK(Thr180 / Tyr182,D3F9),抗CK2底物[(pS / pT)DXE] MultiMab混合物,和β-actin抗体购自Cell Signaling Technology(Danvers,MA,USA)。抗IGF-2,抗GM130,抗Rab7(EPR7589)和抗M6PR(EPR7691)抗体购自Abcam(英国剑桥)。抗组织蛋白酶L抗体购自Proteintech(Rosemont,IL,USA)。抗IGF2R抗体(用于免疫组化分析)购自Sigma-Aldrich(美国密苏里州圣路易斯)。Alexa Fluor 647偶联的抗LAMP1抗体购自Biolegend(美国加利福尼亚州圣地亚哥)。Alexa Fluor 488结合的抗兔IgG和Alexa Fluor 594结合的抗兔IgG购自Invitrogen(Waltham,MA,USA)。HRP标记的抗兔免疫球蛋白抗体获自Dako(Santa Clara,CA,USA)。和抗M6PR(EPR7691)抗体购自Abcam(Cambridge,UK)。抗组织蛋白酶L抗体购自Proteintech(Rosemont,IL,USA)。抗IGF2R抗体(用于免疫组化分析)购自Sigma-Aldrich(美国密苏里州圣路易斯)。Alexa Fluor 647偶联的抗LAMP1抗体购自Biolegend(美国加利福尼亚州圣地亚哥)。Alexa Fluor 488结合的抗兔IgG和Alexa Fluor 594结合的抗兔IgG购自Invitrogen(Waltham,MA,USA)。HRP标记的抗兔免疫球蛋白抗体获自Dako(Santa Clara,CA,USA)。和抗M6PR(EPR7691)抗体购自Abcam(Cambridge,UK)。抗组织蛋白酶L抗体购自Proteintech(Rosemont,IL,USA)。抗IGF2R抗体(用于免疫组化分析)购自Sigma-Aldrich(美国密苏里州圣路易斯)。Alexa Fluor 647偶联的抗LAMP1抗体购自Biolegend(美国加利福尼亚州圣地亚哥)。Alexa Fluor 488结合的抗兔IgG和Alexa Fluor 594结合的抗兔IgG购自Invitrogen(Waltham,MA,USA)。HRP标记的抗兔免疫球蛋白抗体获自Dako(Santa Clara,CA,USA)。抗IGF2R抗体(用于免疫组化分析)购自Sigma-Aldrich(美国密苏里州圣路易斯)。Alexa Fluor 647偶联的抗LAMP1抗体购自Biolegend(美国加利福尼亚州圣地亚哥)。Alexa Fluor 488结合的抗兔IgG和Alexa Fluor 594结合的抗兔IgG购自Invitrogen(Waltham,MA,USA)。HRP标记的抗兔免疫球蛋白抗体获自Dako(Santa Clara,CA,USA)。抗IGF2R抗体(用于免疫组化分析)购自Sigma-Aldrich(美国密苏里州圣路易斯)。Alexa Fluor 647偶联的抗LAMP1抗体购自Biolegend(美国加利福尼亚州圣地亚哥)。Alexa Fluor 488结合的抗兔IgG和Alexa Fluor 594结合的抗兔IgG购自Invitrogen(Waltham,MA,USA)。HRP标记的抗兔免疫球蛋白抗体获自Dako(Santa Clara,CA,USA)。
瞬时基因敲低
本研究使用的所有siRNA均购自Thermo Fisher Scientific(美国马萨诸塞州):IGF2R(s7219,HSS105256,s7217,s7218,HSS105257和HSS105258),IGF1R(s7211)和M6PR(s8375)。根据制造商的说明,使用转染试剂DhamaFECT1(GE Healthcare,Chicago,IL,USA)进行转染。简要地说,将siRNA和DharmaFECT1悬浮在OptiMEM(Gibco)中,然后添加培养的细胞至终浓度10 nM。培养24小时后,将培养基与正常培养基交换,并将细胞用于下游测定。在组合siRNA转染实验中,将10 nM siCtrl和10 nM目标siRNA混合以调节组合siRNA混合物的总siRNA量(第一个siRNA的10 nM和第二个siRNA的10 nM)。
活力测定
细胞活力的终点检测主要使用Cell Counting Kit-8(Dojinkagaku,Kumamoto,日本)或CellTiter-Glo 2.0 Assay(Promega,WI,USA)来实现。通过Synergy H1酶标仪(BioTek,Winooski,VT,USA)测量450nm处的吸光度(A 450)或发光度。根据说明,使用RealTime-Glo MT细胞活力检测试剂盒(Promega)随时间监测细胞活力。加入RealTime-Glo试剂后,将细胞在Synergy H1酶标仪中于37°C和5%CO 2培养,每30分钟检测一次化学发光。
3D文化
在这项研究中,在两种不同的3D培养测定法中检测到了细胞生长和/或死亡:分别使用Matrigel(美国康宁,康宁,纽约州)和低附着板。如Lee等人报道,基于Matrigel的3D培养法是根据3D顶部检测法的规程进行的。44。将siRNA处理的细胞重悬于浓度为2×10 5细胞/ mL 的含10%基质胶的冰冷生长培养基。然后将混合物的样品(250μL)添加到预先涂有250μLMatrigel的Matrigel预涂24孔板中,并在37°C和5%CO 2下培养96小时。使用ImageJ软件对基质胶中的菌落进行拍照并计数。使用低粘附力平板进行第二次3D培养测定。简要地说,1×10将4个siRNA转染的细胞重新接种到EZ Bind Shut II(圆底96孔板)中(IWAKI,静冈,日本),并在5%CO 2的 37°C下培养12天。根据供应商的规程,通过LIVE / DEAD生存力/细胞毒性试剂盒(Thermo Fisher Scientific)同时观察球体中的活细胞和死细胞。此外,根据制造商的方案,使用CellTiter-Glo 3D细胞活力测定法(Promega)检测球体的细胞活力。
凋亡检测
通过FITC Annexin V细胞凋亡检测试剂盒(BD Bioscience,CA,USA)检测细胞凋亡。简而言之,将细胞重悬于膜联蛋白V结合缓冲液中,并在室温下与FITC-AnnexinV和7-AAD共染色15分钟。然后通过BD FACSVerse(BD Biosciences)分析细胞,并以早期凋亡(AnnexinV 高 / 7-AAD 低)和晚期凋亡(AnnexinV 高 / 7-AAD 高)的总和来计算凋亡细胞。)细胞群体。类似地,还使用Caspase-Glo 3/7测定系统(Promega)根据制造商的方案检测了培养的细胞中caspase 3和7的活性。在将Caspase-Glo 3/7试剂添加到不透明的96孔板中培养的细胞后,使用Synergy H1酶标仪测量每个样品的化学发光强度。
伤口愈合测定
将细胞以高密度(4×10 5个细胞/孔)接种到6孔板中,然后进行siRNA转染并培养过夜。使用CELL Scratcher(Asahi Technoglass,静冈,日本)线性刮擦汇合的单层细胞。用PBS洗涤细胞后,将它们在正常生长培养基中培养48小时。拍摄细胞划痕,并通过ImageJ软件测量划痕区域。
入侵检测
BD BioCoat基质胶侵袭室(BD Bioscience)用于验证细胞侵袭能力。将水合的侵袭室置于装有10%FBS的生长培养基的24孔陪伴板(BD Bioscience)上。然后将siRNA转染的细胞重悬于无FBS的生长培养基中,并以1×10 5个细胞/孔的密度将400μL悬浮液添加到腔室中。培养48小时后,使用Diff-Quick固定剂固定室的膜,然后用Diff-Quick溶液1和2(SYSMEX,兵库县,日本)染色各2分钟。用PBS洗涤细胞后,通过显微镜拍摄膜上的染色细胞,并使用ImageJ软件计数。
细胞周期分析
将培养的细胞重悬于冰冷的80%乙醇中,然后在−30°C下孵育过夜。在PBS中洗涤细胞后,将它们在PI / RNase染色缓冲液(BD Bioscience)中在冰上孵育1 h,并使用BD FACSVerse分析其细胞周期特征。
磷酸激酶阵列
根据制造商的说明,使用基于三明治免疫测定的PathScan RTK Signaling抗体阵列试剂盒(Cell Signaling Technology),验证了培养细胞中生物学上重要的受体酪氨酸激酶(28种激酶)及其下游分子(11个节点)的磷酸化。最后,使用ImageQuant LAS 4000 mini系统(GE Healthcare)检测每个点的发光信号。
蛋白质印迹分析
在含有350 mM DTT和1%蛋白酶抑制剂混合物(Sigma-Aldrich)的1X Laemmli样品缓冲液(Bio-Rad Laboratories,Hercules,CA,美国)中提取蛋白质。通过蛋白质定量测定法(Macherey-Nagel,Nordrhein-Westfalen,德国)测量每个样品的蛋白质浓度。NovexWedgeWell 4–20%Tris-甘氨酸凝胶(Thermo Fisher Scientific)在225 V下电泳约30–30μg蛋白质和MagicMark XP Western蛋白标准品(Thermo Fisher Scientific)。然后使用Trans-Blot Turbo印迹系统(Bio-Rad Laboratories)将蛋白质在100 mA下转移至Immobilon-P PVDF膜(Merck Millipore)40分钟。将膜与含有5%膜封闭剂(GE Healthcare)的PBS(封闭缓冲液)孵育2小时,然后在4°C下与最佳浓度的一抗反应过夜。将膜在含0.05%Tween 20的PBS(PBST)中洗涤后,将其与相应的HRP标记的二抗反应1小时。为了减少抗体的非特异性结合,在某些情况下,可以使用Can Get Signal免疫反应增强剂溶液(东大阪市,日本大阪)溶解第一级/第二级抗体,以替代封闭缓冲液。在PBST中洗涤蛋白质后,使用Pierce Western印迹底物plus(Thermo Fisher Scientific)通过ImageQuant LAS 4000 mini系统(GE Healthcare)和FUSION系统FX6.EDGE(VILBER LOURMAT,法国Collegien)对膜上的蛋白质进行可视化。 。
定量RT-PCR
使用ISOGEN(日本基因,东京,日本)从培养的细胞中分离总RNA,然后进行基于异丙醇沉淀的纯化。然后根据制造商的说明,使用SuperScript IV VILO Master Mix(Thermo Fisher Scientific)合成cDNA。实时PCR分析是由IQ SYBR Green Supermix(Bio-Rad Laboratories)在CFX96实时PCR检测系统(Bio-Rad Laboratories)上进行的。本研究中使用的引物的详细信息在补充表S2中进行了描述。
芯片分析
通过GeneChip人类基因组U133 Plus 2.0阵列(Affymetrix,美国加利福尼亚州圣克拉拉)对总RNA进行了分析,该阵列包括54,675个探针组,用于分析来自38,500个特征明确的人类基因的大约47,000个转录本和变异体的mRNA表达水平。根据供应商的规程进行靶标杂交,洗涤和信号放大染色的程序。用GeneChip Scanner 3000(Affymetrix)扫描阵列,并在GeneChip Analysis Suite 4.0版软件(Affymetrix)中计算阵列每个特征的强度。将每个实验中的平均表达值标准化为1,000,以可靠地比较多个阵列。分析中排除了其中90%的样本的值低于500的实体。使用已过滤实体的表达数据,使用GeneSpring(Agilent Technologies,Santa Clara,CA,USA)进行分层聚类。为了确定对照组和治疗组之间的mRNA表达水平不同的基因,我们选择了2倍变化的实体,并使用不配对的方法进一步过滤了结果t检验(p < 0.05)。使用如上所述选择的实体,由GSEA v2.06(从Broad Institute网站http://software.broadinstitute.org/gsea/index.jsp下载)执行了GSEA 。在分析中,使用包含5917个基因的GO基因集(C5集合)作为基因集数据库。
质谱分析
全面蛋白质组学数据通过液相色谱和质谱法(2DICAL)鸟枪蛋白质组学分析的二维图像转换的分析而获得,如先前所述45,46。
免疫细胞化学
在24孔板中用各种试剂(例如siRNA或药物)处理后,将细胞重新接种在8孔非包被的玻片槽(日本东京松浪玻璃)中,并培养特定的测定时间(24-144小时) )。细胞用PBS洗涤,在室温下用4%甲醛固定10分钟,然后在室温下用含PBS的0.5%Triton X-100透化5分钟,或用100%冰冷的甲醇固定并透化。在-30°C下放置15分钟。然后在室温下用BlockAid封闭溶液(Thermo Fisher Scientific)封闭细胞1小时,并在4°C下与一抗(用BlockAid封闭溶液最佳稀释)反应过夜。用PBS洗涤细胞后,将荧光团标记的第二抗体溶液添加到细胞中,并将混合物在室温下孵育1小时。然后按照制造商的规程,将细胞在PBS中洗涤,并用带有NucBlue染色剂(Thermo Fisher Scientific)和/或Actin-stain 555鬼笔环肽(Protoong-Stain 555 Phalloidin)(Proxong Glass Antifade Mountant)的染色剂,按照制造商的操作规程进行染色,并盖上盖玻片。使用荧光显微镜(BZ-X710; Keyence,大阪,日本)采集所有荧光图像,并通过BZ-X Analyzer软件(Keyence)对荧光面积,共定位和核数进行定量。
活细胞成像
使用LysoTracker(Thermo Fisher Scientific)和a啶橙(Sigma-Aldrich)分析siRNA处理的细胞中酸性细胞器和溶酶体膜通透性的状态。为了监测酸性细胞器的定位,将处理过的细胞在37°C下用含有50 nM LysoTracker深红色的生长培养基染色1小时。在正常条件下培养用PBS洗涤的细胞,并通过BZ-X710荧光显微镜或流式细胞仪(BD FACSVerse)使用660/10 nm带通滤光片激发640 nm来检测其荧光。分别地,为了验证溶酶体膜的通透性,将细胞与5μM含a啶橙的生长培养基在37°C下孵育15分钟。通过胰蛋白酶消化后,
线粒体膜电位测定
活细胞中线粒体的膜电位通过MitoProbe JC-1分析(Thermo Fisher Scientific)进行分析。将细胞在含2μMJC-1的生长培养基中于37°C,5%CO 2培养30分钟,然后通过胰蛋白酶消化进行恢复。细胞用PBS洗涤后,通过流式细胞术(BD FACSVerse)使用527/32 nm和586/42 nm带通发射滤光片对488 nm激发进行分析。
ROS检测
使用细胞可渗透的荧光探针CellROX Green试剂(Thermo Fisher Scientific)监测细胞的氧化应激。简而言之,将培养的细胞在含5μMCellROX Green的生长培养基中于5%CO 2下于37°C孵育1或2 h 。胰蛋白酶消化后,将回收的细胞用7-AAD染色,并使用BD FACSVerse流式细胞仪进行分析。将细胞内ROS计算为7-AAD阴性人群中FL1通道的平均荧光强度。
溶酶体酶活性测定
用溶酶体细胞内活性测定试剂盒(BioVision,Milpitas,CA,USA)检测活细胞中内源性溶酶体酶的活性。简而言之,将培养的细胞与自淬灭底物(BioVision)在含0.5%FBS的生长培养基中,在5%CO 2下于37°C反应1 h 。然后通过胰蛋白酶消化回收细胞,并用7-AAD染色。使用流式细胞仪(BD FACSVerse),活细胞的活动(7-AAD -分数)由FL1通道的荧光强度进行检测。类似地,也使用荧光显微镜(BZ-X710)获取荧光图像。
免疫组织化学
将组织固定在福尔马林中,然后包埋在石蜡中。将组织切片(4μm厚)在二甲苯中脱蜡并在乙醇中水合。通过在10 mM柠檬酸钠缓冲液(pH 6.0)中煮沸1小时来回收抗原。内源性过氧化物酶在3%H 2 O 2中失活在室温下将甲醇含甲醇5分钟。在室温下用BlockAid封闭溶液(Thermo Fisher Scientific)封闭切片30分钟,然后在4°C下与一抗(用BlockAid封闭溶液最佳稀释)反应过夜。然后将载玻片在PBS中洗涤,并与EnVision + Dual Link System-HRP(Dako)在室温下反应30分钟。用PBS洗涤载玻片后,用DAB底物缓冲液(Dako)对其进行染色,并用Mayer's苏木精复染。然后将它们在乙醇和二甲苯中脱水,并盖上盖玻片。所有图像均使用立式显微镜(BX63;奥林巴斯,东京,日本)采集。
统计分析
所需的样本量是根据以前有关类似实验的经验估算的。从三个独立的实验中获得平均值±SD值。使用GraphPad Prism 7(GraphPad Software,CA,USA)进行分析。使用不配对的两尾t检验和Welch校正,Dunnett或Tukey多重比较检验确定统计学差异。对数秩检验用于Kaplan–Meier生存曲线。配对t检验应用于配对样本。通过非参数相关系数分析(spearman)探索了两个变量之间的关联强度和关系的方向(* p < 0.05,** p < 0.01,*** p < 0.001,**** p < 0.0001)。
|
|