Dickkopf-1有助于肝细胞癌肿瘤发生通过激活/β-catenin Wnt信号通路
Dickkopf-1有助于肝细胞癌肿瘤发生通过激活/β-catenin Wnt信号通路
摘要
失调dickkopf-related蛋白1 (DKK1)表达式已经报道在多种人类癌症。 我们以前报道,DKK1是调节肝细胞癌(HCC)。 然而,DKK1在肝癌中的作用尚不清楚。 本研究旨在探讨DKK1在肝细胞癌的临床意义和生物功能。 DKK1的表达在肝硬化和肝细胞癌组织进行免疫组织化学和定量实时聚合酶链反应(存在)。 DKK1是沉默还是在肝癌细胞株,并进行了体外和体内研究。 免疫组织化学显示DKK1是弱表达肝硬化组织(8/22,36.4%),但调节肝细胞癌组织中(48/53,90.6%,队列1)。重要的upregulation DKK1观察到57.6%(19/33,队列2)肝癌组织中存在,和DKK1的表达与肿瘤大小有关(P= 0.024)和肿瘤号码(P= 0.019)。 遗传损耗DKK1受损的增殖、克隆形成能力,入侵,肿瘤形成肝癌细胞(HepG2和HUH-7)。 相反,被迫表达DKK1增加扩散,克隆形成能力,和入侵HepG2 HUH-7细胞体外和增强体内肿瘤形成。 事后调查发现HepG2的DKK1-mediated核扩散和致瘤性和HUH-7细胞是依赖于/β-catenin Wnt信号通路。 这些发现表明,DKK1具有致癌作用激活/β-catenin Wnt信号通路在肝细胞癌。
介绍
肝细胞癌(HCC)是全球最常见的肿瘤相关性死亡的原因。1如肝切除术治疗过程和肝移植只能提供大约1/3的肝癌患者和高复发率相关联。2至关重要阐明肝癌进展的根本机制为了发展对肝癌治疗药物有效。 分子可能作为诊断/预测生物标记或抑制肝癌进展必须确定。3.
Dickkopf-related蛋白1 (DKK1)是一种分泌蛋白,显然已经认定为直接抑制Wnt /β-catenin信号通过LRP5/6 coreceptor卷曲的蛋白质。4,5,6越来越多的证据支持的介入DKK1在人类癌症。 然而,DKK1在肿瘤生物学的作用仍不清楚。7DKK1的表达被报道在大肠癌癌和肺癌细胞表达下调。8,9,10积累武藏rna结合蛋白1 (MRP-1)在肝癌细胞显著促进细胞增殖,形成肿瘤,细胞周期进展通过DKK1沉默。11相比之下,upregulation DKK1被发现在多种人类癌症,如胆管癌和胰腺癌、食道癌、乳腺癌、肾癌等。12,13,14,15,16,17在肝脏,DKK1是表达下调的表达在人类肝细胞癌,肝癌和upregulation DKK1是能抑制肝癌细胞的入侵。18然而,陈和他的同事们19报道,DKK1提高肝癌细胞通过MMP-7入侵信号通路。 超表达DKK1是与人类肝细胞癌预后不良有关。20.此外,DKK1可以用作诊断HCC血清生物标志物。21,22据报道,与频率增加肝癌的发展在乙型肝炎病毒表面抗原(HBsAg)转基因小鼠。23我们以前报道,DKK1是调节HBsAg小鼠肝组织和在人类肝细胞癌。24最终,具体DKK1在肝癌中的作用仍存在争议。 在这项研究中,DKK1的表达在肝硬化和肝细胞癌组织进行免疫组织化学和定量实时聚合酶链反应(存在)。 DKK1的生物功能研究肝癌细胞系(HepG2和HUH-7)使用扩散,入侵,细胞周期,集落形成,异种移植肿瘤形成化验。
材料和方法
病人特点、免疫组织化学、细胞系建立和细胞培养、定量rt - pcr,免疫印迹分析,分析细胞增殖,细胞集落分析、细胞周期分析,细胞入侵分析、和皮下异种移植在裸小鼠进行化验所描述的补充材料和方法。
酶联免疫吸附试验
酶联免疫吸附试验(ELISA)进行调查DKK1的表达与人类肝癌细胞的上清液DKK1酶联免疫试剂盒(Elabscience,中国)。 简单地说,一个96孔板与反预镀DKK1抗体,与上层清液样本稀释样品稀释缓冲和添加到井。 板是孵化为90分钟37°C。 DKK1绑定到井后的固定化抗体,液体被从每个好,生物素化的反DKK1抗体立即被添加到井和孵化在37°C 1 h。 洗后三次,HRP-conjugated链霉亲和素添加删除后的生物素化的抗体。 井再次清洗,三甲衬底的解决方案是补充道。 最后,吸光度测量用ELISA板阅读器在450海里。 根据标准曲线由人类DKK1系列稀释重组,生成的可溶性DKK1水平每个上层清液样本计算。
病毒生产和转导
慢病毒载体(pGLV3 / H1 / GFP /雪茄烟,pGHGV)表达shRNA针对人类DKK1β-catenin或负控制成分(补充表中列出3.)从GenePharma购买(上海,中国)。 所有成分受到基本的局部比对序列搜索工具(爆炸)的分析来确认没有任何其他已知的编码序列的同源性。 完整的人类DKK1 cDNA PCR扩增,HA标记,插入到慢病毒载体(pCDH /巨细胞病毒/ GFP /雪茄烟,pCMGV)上游的内部核糖体进入(IRES)网站。 DKK1片段被孤立不我消化和插入到DKK1逆转录病毒载体(pCMGV / DKK1)。 HepG2 HUH-7细胞被感染pGHGV / shRNA-DKK1, pGHGV / shRNA-β-catenin pCMGV / DKK1或pCMGV向量经过10人口倍增,如前所述。25嘌呤霉素选择后,损失或增加DKK1β-catenin经中存在和免疫印迹分析,建立了稳定的细胞系。
共焦显微镜分析
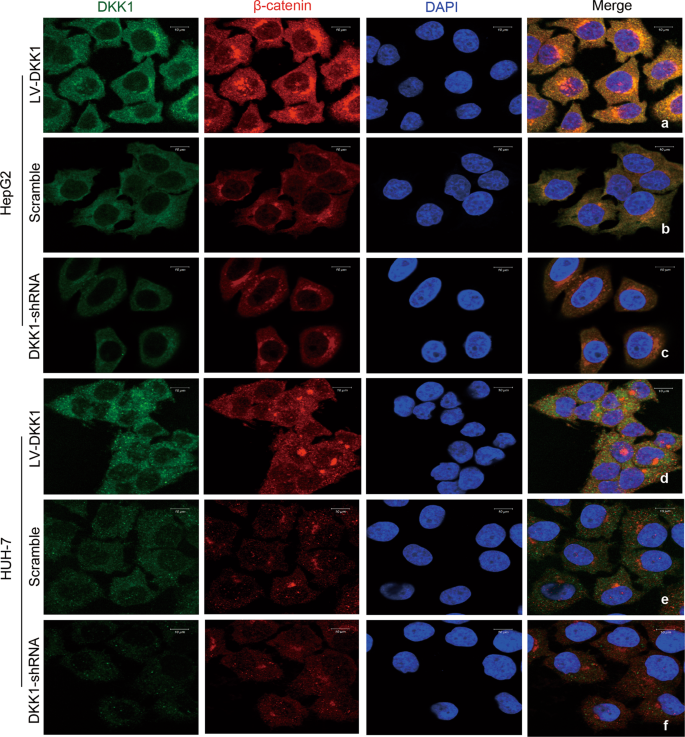
HepG2 HUH-7细胞增长到50%融合在24-well板玻璃盖玻片。 治疗后,细胞被固定为4% PFA,与PBS洗两次,阻止了30分钟的PBS包含10%的山羊血清和0.1%的皂苷(DSP)。 主要抗体特定DKK1和β-catenin DSP被添加在室温下同时为2 h。 与PBS洗涤三次后,在DSP添加二级抗体在室温下2 h。 盖玻片和PBS又洗了三次,然后被安装在幻灯片与DAPI缓慢消退。 代表照片被收购的徕卡TCS SP5共焦显微镜油浸物镜60×放大。 代表图像显示为增强使用ImageJ软件。 主要的抗体和二次抗体补充表中列出1。
TCF / LEF记者分析
HepG2和镀HUH-7细胞密度2×104细胞/在48-well板块和转染pGL3-blast或pGL3-LEF / TCF使用Lipofectamine(从MssBio购买、广州)TM3000年根据制造商的协议。 荧光素酶活性评估使用Dual-Luciferase记者分析系统(美国WI Promega,麦迪逊)根据制造商的指示。 使用的引物序列扩增TCF / LEF补充表所示4。
统计数据
所有Windows使用SPSS统计分析(17.0版本; 美国SPSS、芝加哥、IL)。 所有实验培养细胞进行了至少三次独立实验一式三份。 所有数据都表示为意味着±标准差(SDs),除非另有指示。 我们确定的意义人类肝癌的差异数据使用确切概率法,在体外用学生的数据t以及,在使用Mann-Whitney体内数据U以及。 在所有情况下,P< 0.05的值被认为是具有统计学意义。
结果
DKK1表达式是调节人类肝细胞癌组织
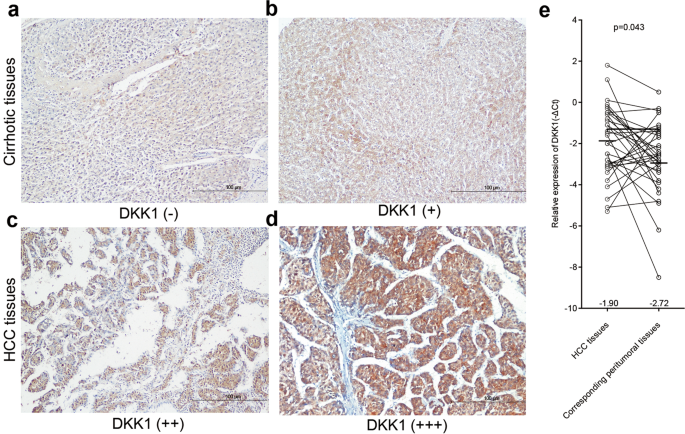
免疫组织化学显示阳性染色的DKK1蛋白在肿瘤细胞的细胞质。 一般来说,DKK1是弱表达(DKK1−, 14/22, 63.6%; DKK1 +,在22个人类肝硬化组织(8/22,36.4%)无花果。1 a, b)。 相比之下,调节DKK1表达式(DKK1 + +或+ + +)是人类肝细胞癌肿瘤样本中观察到48 53(90.6%)(图。1 c, d),而弱DKK1表达式(DKK1−或+)被发现在其他五个人类肝细胞癌肿瘤样本(9.4%)。 调查执行中存在的表达DKK1 33个配对HCC和相应的瘤旁组织。 如无花果所示。1 e,重要的upregulation DKK1被发现在57.6%(19/33,队列2)的肝细胞癌组织标本与相应的瘤旁组织标本。 这些发现表明DKK1可能参与人类肝癌进展。
HCC-related DKK1表达与肿瘤大小和数量有关
如表所示1,存在显示调节DKK1表达与肿瘤大小有关(P= 0.024)和肿瘤号码(P= 0.019)。 然而,DKK1表达并不与年龄(P= 0.116)、性别(P= 0.142),荚膜入侵(P= 0.292),肿瘤门静脉血栓(P= 1.000),胆管肿瘤血栓(P= 0.424),淋巴转移(P= 1.000),肿瘤阶段(P= 0.238),组织学分级(Pα= 0.531),血清胎蛋白水平(P= 1.000),血清CA19-9级别(P= 0.698),血清CA125水平(P= 0.707),或肝外转移(P= 0.620)。
转染DKK1-shRNA抑制增殖、克隆形成能力,细胞周期进展,入侵HepG2 HUH-7细胞体外
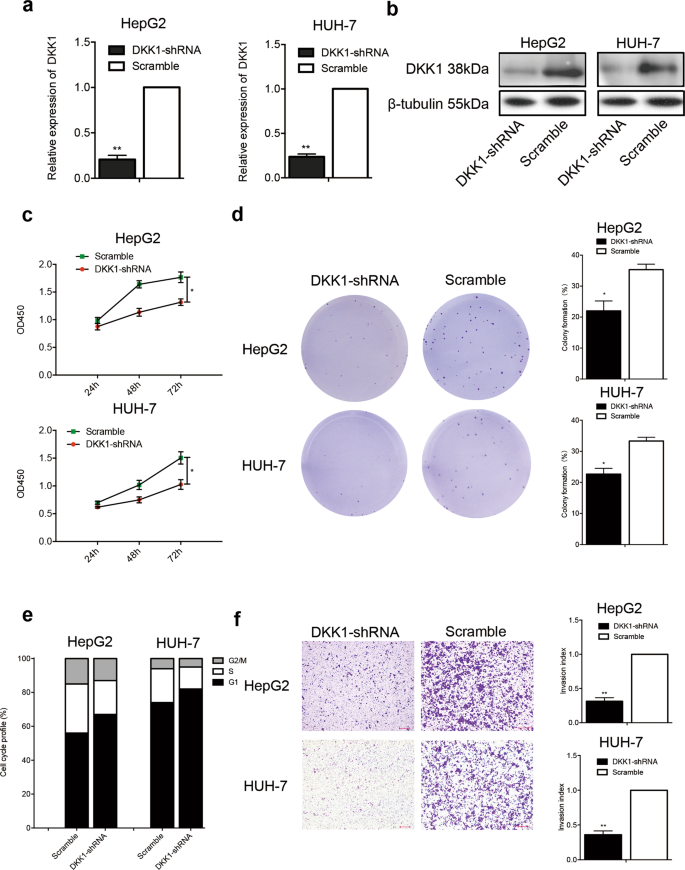
存在和西方墨点法进行分析在DKK1-short DKK1发夹RNA的表达水平(成分)肝癌细胞(HepG2和HUH-7)。 如无花果所示。2 a, bDKK1是有效和功能抑制的DKK1-shRNA评估HepG2和HUH-7细胞。 功能验证DKK1是沉默的成分,我们利用ELISA的表达水平来衡量DKK1上层清液的肝癌细胞。 ELISA结果显示DKK1水平下降的上层清液培养稳定DKK1-shRNA HepG2 HUH-7细胞(补充图。1 a, b)。 我们进一步检查是否减少DKK1表达式HepG2和HUH-7细胞的生物活性的影响。 CCK-8(细胞计数Kit-8) DKK1的差别分析结果显示,对这些DKK1-shRNA显著抑制HepG2的扩散和HUH-7细胞(图。2摄氏度)。 集落形成试验结果显示,更少的殖民地被发现在DKK1-shRNA-treated HepG2 HUH-7细胞比相应的控制细胞(无花果。二维)。 此外,流式细胞仪分析细胞周期进展分析结果显示,DKK1抑制HepG2的数量和降低HUH-7细胞S期(无花果。2 e)。 细胞入侵检测结果表明,HepG2的数量和HUH-7细胞迁移通过Transwell过滤器DKK1-shRNA组明显低于对照组(无花果。2 f)。 总的来说,这些数据表明,抑制DKK1不仅抑制扩散,而且减少HepG2的入侵和HUH-7细胞体外。
被迫表达DKK1增加扩散,克隆形成能力,细胞周期进展,入侵HepG2 HUH-7细胞体外
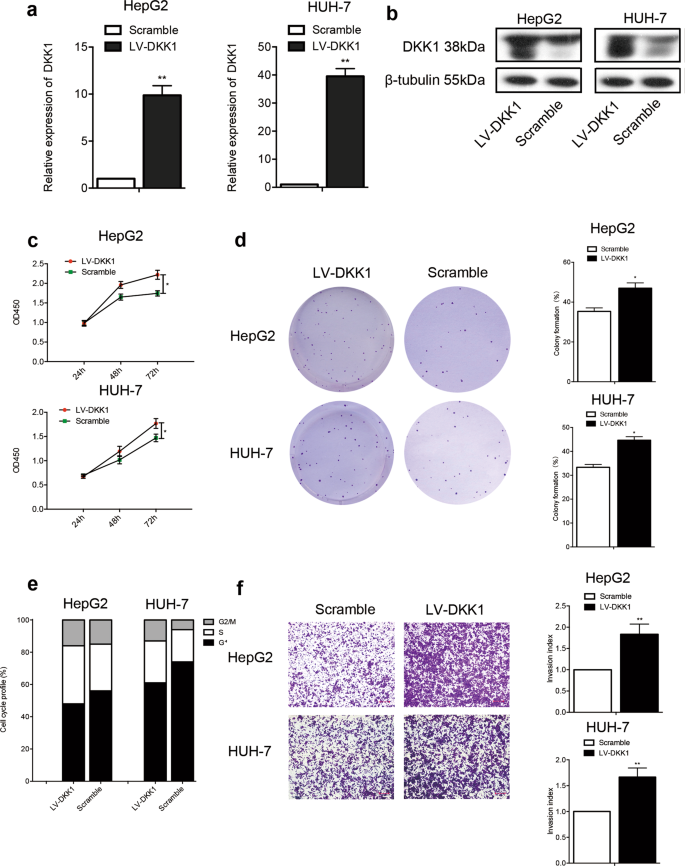
探讨DKK1对肝癌细胞的影响,pCMGV / DKK1-derived逆转录病毒被用来转换HepG2 HUH-7细胞与稳定建立肝癌细胞株迫使DKK1的表情。 存在和免疫印迹分析结果显示,DKK1表达功能有效地诱导细胞HepG2和HUH-7而控制细胞(无花果。3 a, b)。 此外,ELISA结果显示DKK1水平提高的上层清液培养HepG2 HUH-7细胞稳定被迫表达DKK1(补充图。1 a, b)。 CCK-8和集落形成化验结果显示强迫DKK1的表达显著增加扩散(无花果。3 c(图)和克隆形成能力。3 d)细胞HepG2和HUH-7与相应的控制单元。 此外,细胞周期分布分析结果显示的数量显著增加细胞S期后被迫表达DKK1 HepG2 HUH-7细胞(无花果。3 e)。 此外,HepG2的数量和HUH-7细胞迁移通过Transwell过滤器被迫DKK1表达式组明显高于对照组(无花果。3 f)。 综上所述,这些数据表明,被迫表达DKK1提高HepG2的增殖和侵袭性属性和HUH-7细胞体外。
强迫DKK1提高HepG2的致瘤性的表达和HUH-7细胞体内
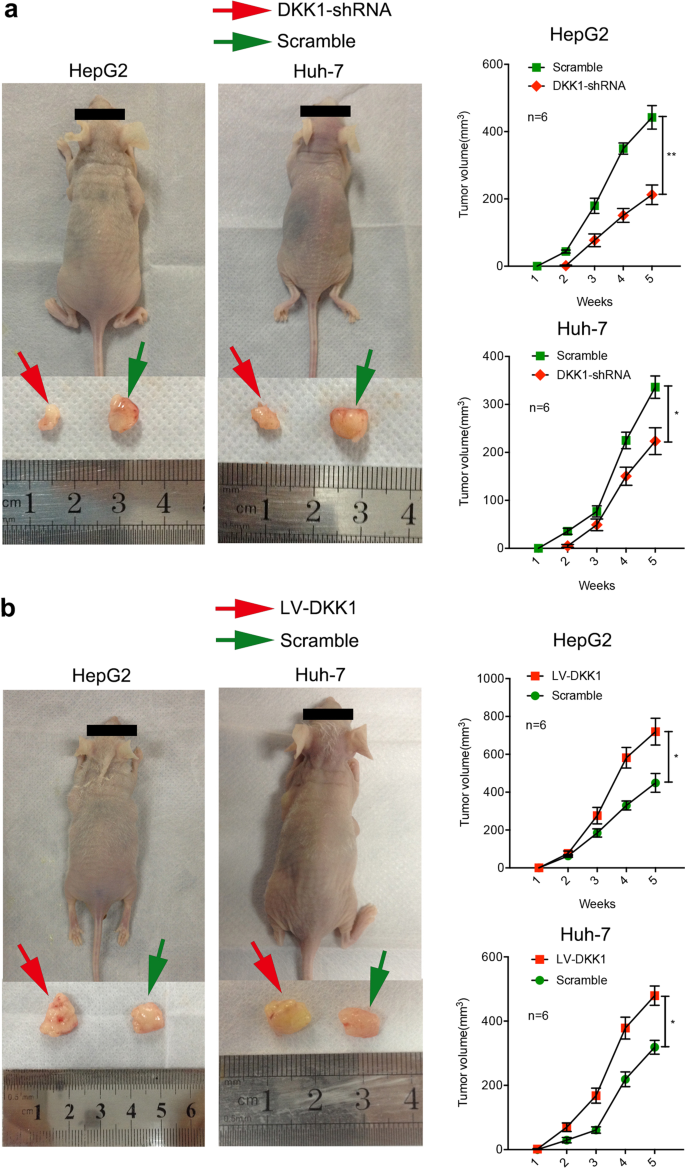
因为体外研究表明DKK1扮演监管角色在HepG2 HUH-7细胞增殖和入侵,这些结果的生物学意义是进一步评估肝细胞癌的体内模型。 为此,异种移植肿瘤形成试验进行调查DKK1的效果。 如无花果所示。4的差别,对这些DKK1受损HepG2和HUH-7细胞的致瘤性裸体小鼠。 炒shRNA-treated HepG2 HUH-7细胞生成大肿瘤右边侧翼的裸体小鼠(绿色箭头)。 左边的小肿瘤观察侧翼的老鼠注射DKK1-shRNA-treated HepG2 HUH-7细胞(红色箭头)。 被迫表达DKK1 HepG2和HUH-7细胞导致显著增强体内肿瘤生长在左边侧翼的裸体小鼠(红色箭头),而与肿瘤的生长控制细胞在右边侧翼的裸体小鼠(绿色箭头)(无花果。4 b)。 这些数据证实了体外观察和支持这个想法,迫使表达DKK1增强HepG2和HUH-7细胞体内的致瘤性,表明DKK1可能函数作为癌基因。
被迫表达DKK1促进肿瘤形成HepG2和HUH-7细胞体内。 DKK1 HepG2的差别与控制条件相比,对这些基因和HUH-7细胞显著减少体内肿瘤形成。 控制HepG2 HUH-7细胞转染和炒shRNA生成大肿瘤右边侧翼裸体小鼠(绿色箭头),而较小肿瘤观察左边侧翼的老鼠注射DKK1-shRNA-transfected HepG2 HUH-7细胞(红色箭头)(一个左面板)。 肿瘤的老鼠的数量(所示一个右面板)。 被迫在肝癌细胞中表达DKK1产生显著增强体内肿瘤生长在左边侧翼的裸体小鼠(红色箭头),而与肿瘤小鼠注射控制细胞的两翼(绿色箭头)(b左面板); 肿瘤的老鼠的数量(所示b右面板)。 *P< 0.05
/β-catenin Wnt信号通路被激活的DKK1肝癌细胞株
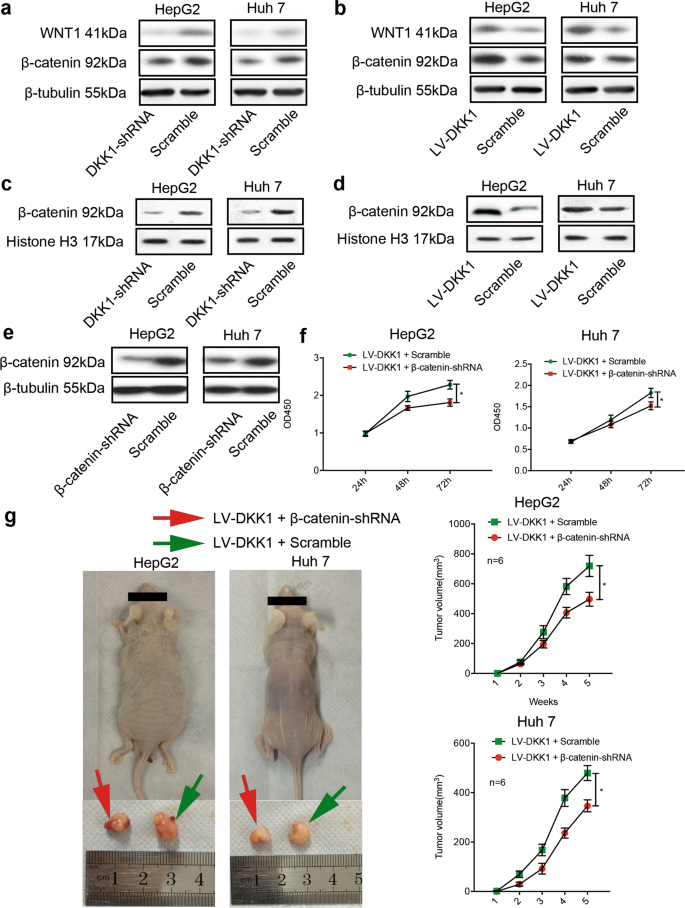
接下来,我们研究一个潜在机制的影响DKK1肝癌细胞增殖和肿瘤的形成。 DKK1是良好的关键调节器/β-catenin Wnt信号通路。7DKK1表达增加与胞质/核β-catenin HCC患者的积累。20.因此,我们调查DKK1能否激活/β-catenin Wnt信号通路。 荧光标记anti-DKK1和anti-β-catenin抗体被用于共焦显微镜分析。 共焦显微镜显示,强制表达DKK1 HepG2和HUH-7细胞增加了核表达β-catenin(无花果。5 a, d)在体外。 HepG2的DKK1差别相比之下,对这些HUH-7细胞受损的核表达β-catenin(无花果。5和2 c、f)体外。 检测/β-catenin Wnt信号通路的活动,我们使用荧光素酶记者分析。 肝癌细胞转染pGL3-TCF / LEF Wnt /β-catenin信号通路的评估。 如补充图所示。2 a, b,抑制DKK1 HepG2 HUH-7细胞荧光素酶活性下降,反之亦然。 此外,免疫印迹分析结果显示,抑制DKK1 HepG2 HUH-7细胞的蛋白表达减少WNT1和β-catenin(无花果。6)。 此外,迫使DKK1增强WNT1表达和β-catenin表达HepG2 HUH-7细胞与相应的控制细胞(无花果。6 b)。 事后调查发现强制表达DKK1增强核β-catenin(图的表达。6 c, d)。 这些发现表明,DKK1促进β-catenin核易位和Wnt /β-catenin DKK1信号通路被激活的人肝癌细胞株。 WNT1β-catenin可能重要的下游DKK1级联的目标。
DKK1-mediated增殖和肿瘤的形成依赖于/β-catenin Wnt信号通路在人类HepG2和HUH-7细胞。 WNT1的蛋白质含量、β-catenin和核β-catenin HepG2 HUH-7细胞被免疫印迹分析测量。 DKK1的抑制这些细胞减少WNT1表达和β-catenin (一个)和核β-catenin的积累(c)。 被迫表达DKK1 WNT1表达的增强和β-catenin (b)和核β-catenin的积累(d)与相应的控制细胞相比,这些细胞。 β-Catenin-shRNA慢病毒载体是用来消耗β-catenin DKK1-overexpressing肝癌细胞,然后β-catenin损耗是证实了免疫印迹(e)。 击倒β-catenin显著地抑制扩散(f)和致瘤性(g左面板)DKK1-overexpressing肝癌细胞。 肿瘤的老鼠的数量(所示g右面板)。 *P< 0.05
Downregulationβ-catenin受损肝细胞的增殖和致瘤性与强迫DKK1的表情
放松管制的Wnt /β-catenin信号通路是癌症的一个特点,包括肝细胞癌。 β-Catenin是主要功能的蛋白质/β-Catenin Wnt信号通路。26,27,28然而,β-catenin是否参与肿瘤的形成肝癌细胞与强迫DKK1 (DKK1的表情高肝癌细胞)仍不清楚。 调查β-catenin的角色,β-catenin-shRNA慢病毒载体是用来消耗β-catenin DKK1表达式高HepG2β-catenin HUH-7细胞,建立稳定低DKK1高HepG2和HUH-7细胞株(无花果。6 e)。 如无花果所示。6 f在DKK1β-catenin击倒高明显抑制肝癌细胞增殖与体外控制条件。 与这个结果一致,β-catenin低DKK1高HepG2 HUH-7细胞表现出显著减少体内肿瘤形成与DKK1-DKK1相比(红色箭头)高HepG2 HUH-7细胞(绿色箭头)(无花果。6克)体内。 这些发现表明,DKK1增强通过β-catenin在肝癌细胞增殖和肿瘤的形成。
讨论
我们以前报道,DKK1是肝细胞癌中。24然而,具体DKK1在肝癌中的作用仍有待确定。 据报道,DKK1促进肝癌细胞入侵和DKK1表达增加与HCC患者的不良预后相关。19,20.这些数据表明,DKK1可能参与肝细胞癌的进展。 在此,我们证明了DKK1是调节在肝细胞癌组织和与大肿瘤大小和多个肿瘤肝细胞癌患者。 这些发现表明,DKK1可能参与肝细胞癌的进展。 此外,损耗的DKK1肝癌细胞受损的细胞增殖,集落形成,细胞周期进展,细胞体外入侵能力。 相比之下,被迫表达DKK1大大增强扩散,克隆形成能力,细胞周期进展,肝癌细胞的入侵。 综上所述,这些数据表明,DKK1起着至关重要的作用在肝癌细胞在体外的增殖和入侵。
DKK1在HCC肿瘤形成的功能,没有检查。 这里,体内化验的结果提供了第一个证据,植入HepG2和HUH-7细胞表达DKK1被迫裸体小鼠导致增强的肿瘤形成,表明DKK1扮演了一个重要的角色在体内肝细胞的致瘤性。 总的来说,这些结果表明,DKK1函数作为肝癌肿瘤癌基因。 在目前的研究中,可能的机制DKK1介导肝细胞癌增殖和肿瘤的形成进行了调查。 WNT-induced信号,经常参与癌症恶化,可以抑制DKK1。6,29,30.,31此外,DKK1激活已被证明是在多种肿瘤的进展,包括肝细胞癌。7此外,Yu et al。20.报道,增加表达DKK1与胞质/核β-catenin HCC患者的积累。 似乎DKK1是参与调节Wnt /β-catenin肝癌细胞。 在这里,我们发现WNT1表达水平和β-catenin大幅度增加在HepG2 HUH-7细胞和强迫DKK1的表情。 击倒的肝癌细胞的DKK1 DKK1-shRNA大大受损WNT1和β-catenin的蛋白表达。 此外,删除DKK1 TCF / LEF活动减少。 最重要的是,发现共焦显微镜和免疫印迹分析还表明,被迫表达DKK1促进β-catenin HepG2和HUH-7细胞的核易位。 综上所述,这些数据表明,Wnt /β-catenin DKK1信号通路被激活的肝细胞在体外。 WNT1和β-catenin DKK1可能重要的下游目标。
β-Catenin是关键功能的蛋白质/β-Catenin Wnt信号通路。26,32据报道,β-catenin把从细胞质到细胞核和对肿瘤发生至关重要。33,34然而,DKK1是否参与β-catenin在肝癌细胞的规定尚不清楚。 因此,β-catenin-shRNA慢病毒载体是用来消耗β-catenin表达细胞HepG2和HUH-7 DKK1迫使表达式。 我们发现击倒β-catenin明显抑制肝癌细胞的体外增殖和体内致瘤性与强迫DKK1与相应的控制细胞的表达。 这些发现暗示DKK1可能增强通过β-catenin肝癌细胞的增殖和致瘤性。
总之,DKK1有助于HCC肿瘤发生通过激活/β-catenin Wnt信号通路,从而为我们提供一个潜在的治疗选择肝细胞癌在临床实践中。
|
|