细胞培养
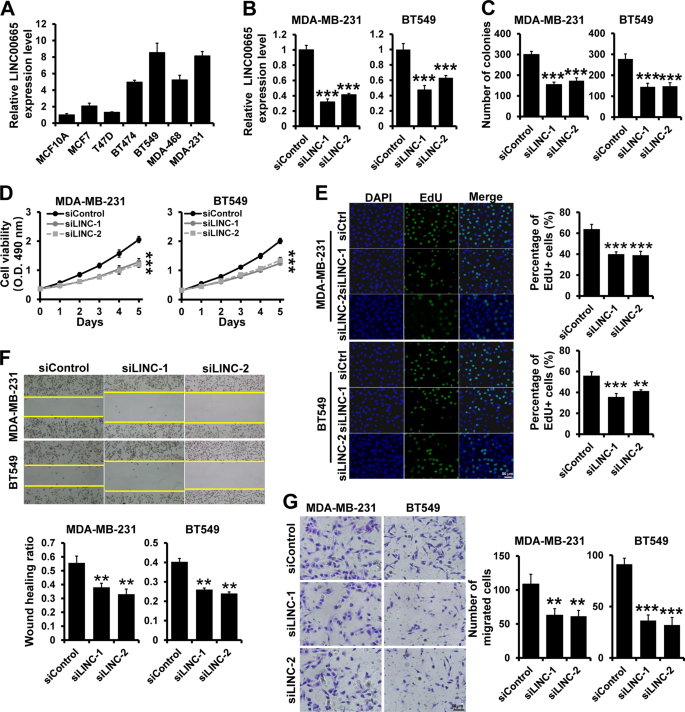
从中国科学院细胞库(上海)获得正常人乳腺上皮细胞系MCF10A、人胚肾细胞系293 FT和乳腺癌细胞系mcf 7、bt 474、bt 549、mda-mb-231、mda-mb-468和t47d。16。所有细胞株均经STRDNA分析证实为支原体阴性。
质粒、miRNAs和抗体
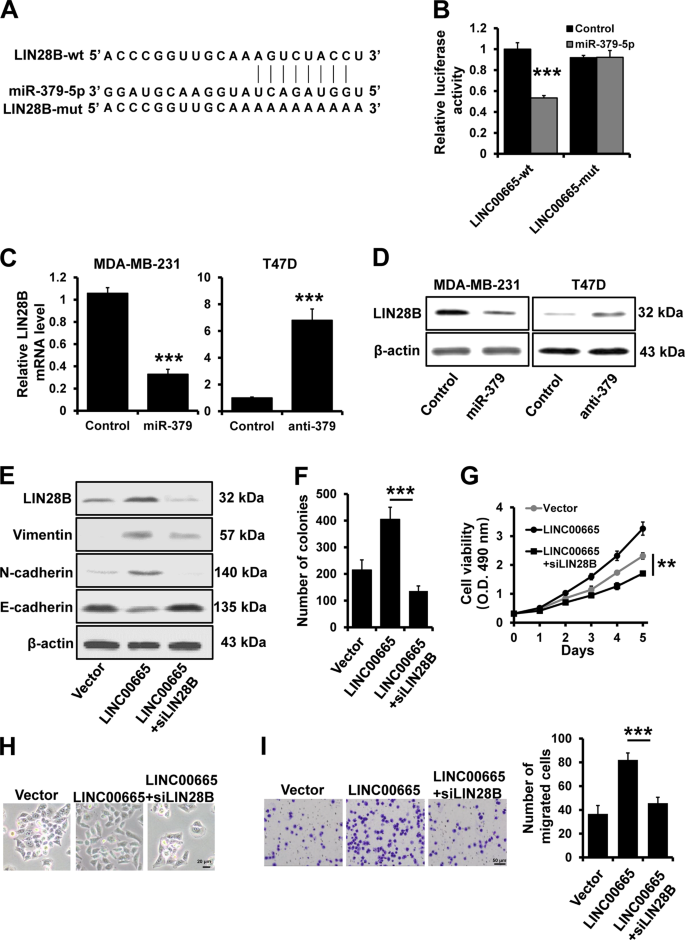
MIR-379-5P抑制剂,miR-379-5P模拟物,并以广州RiboBio为对照。合成了含有miR-379-5p结合位点的Lin28b和LINC 00665的3个ʹ-UTRs,并将其亚克隆到psiCHECK 2载体(Promega,Madison,WI,USA)中,分别构建了Lin28b-wt和LINC 00665-wt结构。利用QuikChange站点定向突变试剂盒(转基因,中国北京),根据制造商的指示,生成Lin28b3ʹ-UTR突变体(Lin28b-mut)和LINC 00665-mut报告载体。合成了全长LINC 00665,并将其克隆到pcDNA3.1表达载体中。抗Vimentin抗体(D21H3)、抗N-cadherin(13A9)、抗E-cadherin(24E10)、抗-Lin28b(D4H1)和抗β-actin(8H10D10)。
稳定的LINC 00665-高表达细胞株的转染与构建
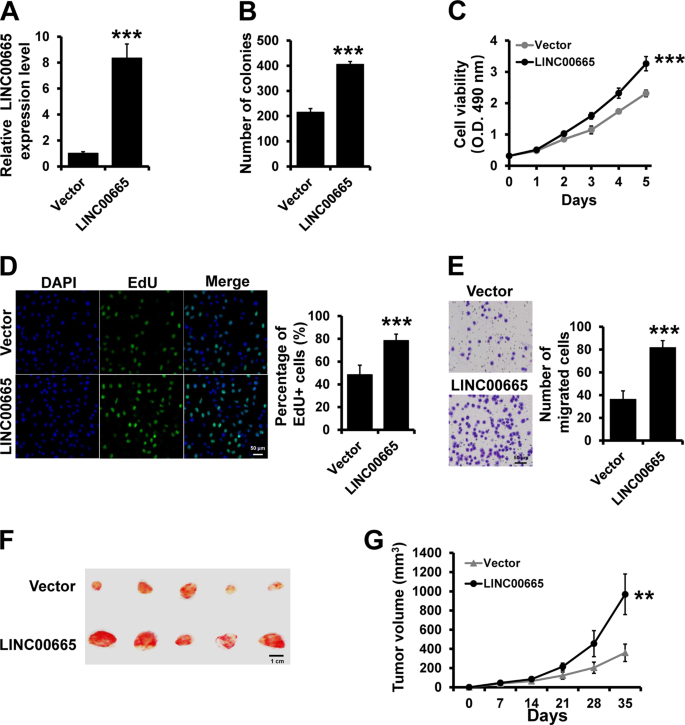
质粒或miRNAs分别按照制造商的指示,使用快速转染试剂(Promega)或FuGENE HD转染试剂(Promega)转染到不同的细胞系中。为建立过表达LINC 00665细胞株,将pcDNA3.1-LINC00665或空载体μg转染T47D细胞。细胞在含1000μg/mL G 418(Sigma-Aldrich,St.Louis,MO,USA)的培养基中培养3周。用有限稀释法获得单克隆耐药细胞,并在添加500μg/mL G 418的培养基中保存。
WESTERNBLOTTING
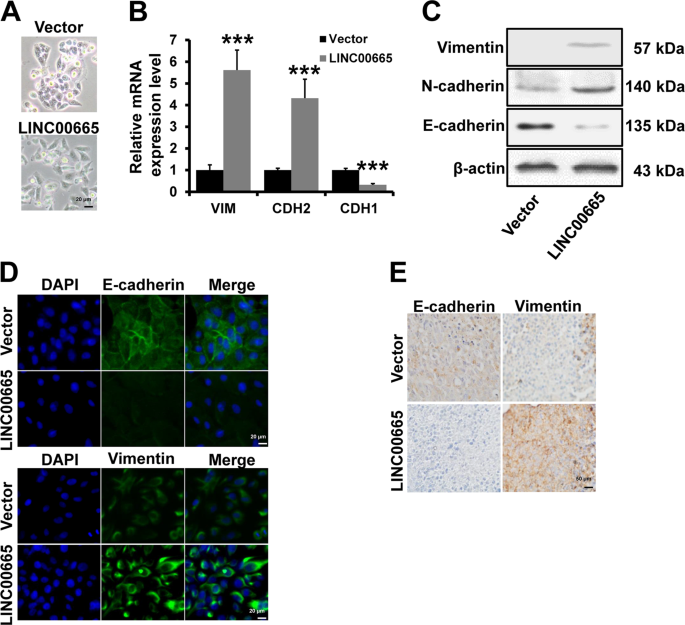
用含有蛋白酶抑制剂鸡尾酒片的RIPA缓冲液(50 mm Tris,150 mm NaCl,0.5%EDTA,0.5%NP 40)提取总蛋白,并在12,000 rpm离心20 min。在10%十二烷基硫酸钠-聚丙烯酰胺梯度凝胶上负载50μg总蛋白。将这些蛋白转移到PVDF膜(Milli孔隙,Bedford,MA,USA)上,在室温下用5%的脱脂牛奶封闭1h,然后在4℃下与抗Lin28b、Vimentin、N-cadherin、E-cadherin和β-actin的初级抗体共同孵育1小时(美国贝弗利市)。在室温下与辣根过氧化物酶结合二次抗体孵育1h,用ECL试剂检测蛋白质。
增殖试验
采用MTT法、edu法和平板集落形成法评价细胞增殖能力。33.
荧光原位杂交
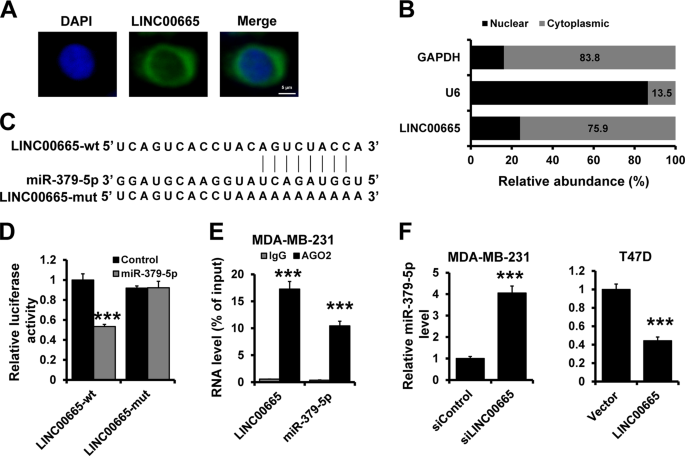
对于FISH分析,根据制造商的建议,从RiboBio购买了FISH Kit。用RiboBio设计合成了荧光共轭型LINC 00665探针。细胞固定在4%甲醛中,用PBS洗涤。固定细胞在含0.5%TritonX-100的PBS中渗透,在预杂交缓冲液中预杂交。然后,在4°C的杂交缓冲液中,用50 nm的探针隔夜孵育细胞。第二天,用PBST洗涤细胞,用4‘,6-二氨基-2-苯环吲哚(DAPI)进行染色。
RNA提取和逆转录-定量PCR
从培养的细胞中提取总RNA。TM巴黎TM设备(生命技术)根据制造商的指示。利用TaqMan miRNA反转录试剂盒(LifeTechnologies)进行TaqmanRT-qPCR检测成熟miRNAs的表达。用GoTaq qPCR主混合(Promega)进行qPCR。每个基因的CT值按三重反应平均。基因表达由2。−ΔCT方法。
荧光素酶报告试验
荧光素酶报告试验用miR-379-5p模拟或模拟对照和1000 ng的Lin28b-wt/mut或LINC 00665 wt/mut共转染293 FT细胞。细胞接种于24孔板中,转染48h后收集。荧光素酶的活性是根据制造商的建议由双荧光素酶报告分析系统(Promega)确定的,如前所述。34。所有转染均一式三份。
Transwell和伤口愈合试验
细胞侵袭能力的评估在Transwell包被Matrigel(BD生物科学,圣地亚哥,CA,美国)如前所述。16。在伤口愈合实验中,细胞在6孔板中培养至70%-80%汇合,然后用200μ1无菌移植物针尖进行损伤。经PBS洗涤后,细胞在无血清培养基中培养。在每个时间点采集图像。
异种移植模型
雌性SCID小鼠(5周龄,每组5只)皮下注射肿瘤细胞(2×10)。6含有100μg Matrigel(BD生物科学)的细胞进入乳腺脂肪垫。用卡钳式仪器测量肿瘤细胞所形成的肿瘤,并根据以下公式计算肿瘤体积:体积(Mm)。3)=宽度2(毫米)2)×长度(Mm)/2。考虑动物福利,5周处死小鼠,测定肿瘤组织的最终体积和重量。所有动物研究均经天津医科大学肿瘤研究所和医院动物伦理委员会批准,并按照“癌症研究中动物福利和使用指南”和“国家法律”进行。
免疫组织化学
小鼠肿瘤在4°C下用4%多聚甲醛固定,然后用石蜡包埋。连续切片(2μm厚)与原抗体(抗Vimentin和抗E-cadherin)在室温下孵育2h,在室温下与抗小鼠HRP结合二次抗体孵育1h。用PBS冲洗三次后,用二氨基联苯胺染色,再用苏木精染色。
统计分析
数据作为平均±标准差从至少三个独立的实验。所有计算均用IBM SPSS统计软件进行(IBM公司,美国纽约州阿蒙克)。用学生的方法分析各组间的差异t-测试和P-数值<0.05被认为是有统计学意义的。