BC细胞和标本
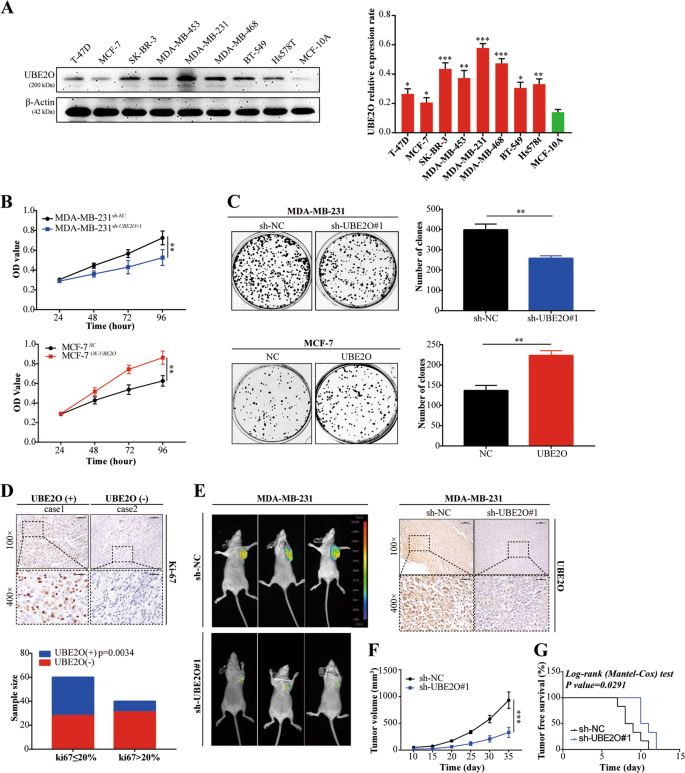
MDA-MB-231、MCF-7和T-47D细胞是从中国科学院(上海)的细胞库购买的。MDA-MB-453,MDA-MB-468,SK-Br-3,Hs578T,BT-549和MCF-10A细胞购自Bena培养物(北京)。在含10%胎牛血清(FBS)的DMEM培养基上培养MDA-MB-231、MDA-MB-453、MDA-MB-468、T-47D、MCF-7、SK-BR-3和Hs578T细胞。BT-549细胞在RPMI 1640(美国吉布科)中保持10%的FBS。用含有霍乱毒素的MEGM试剂盒培养McF-10A细胞。所有细胞系在37℃下,在含5%二氧化碳和95%氧气的加湿气氛中孵育。
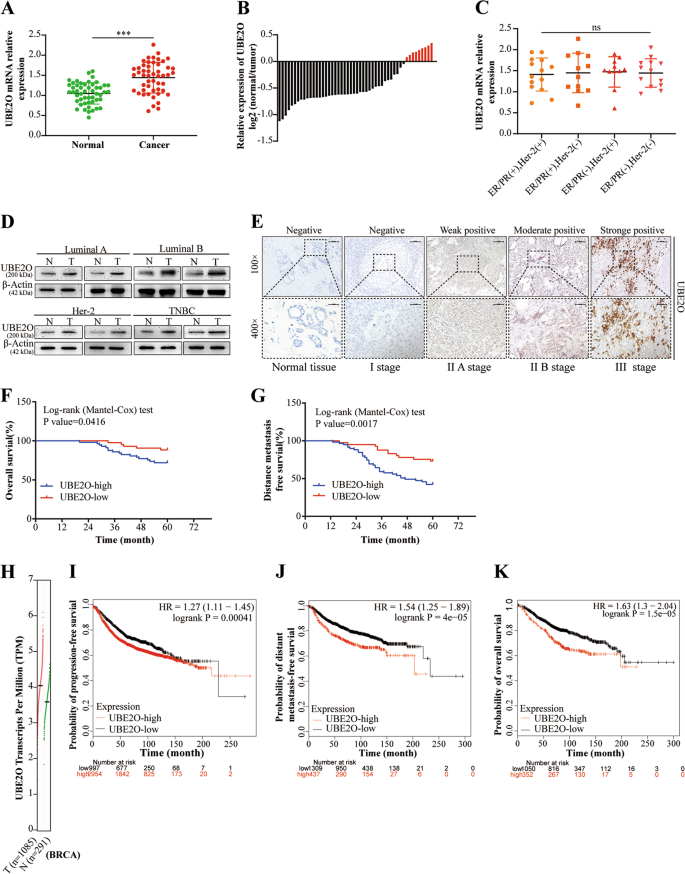
新鲜BC组织和配对正常组织取自BC患者(n50)于2016年4月至9月在哈尔滨医科大学癌症医院接受手术。切除后全部取组织标本,立即保存于−80°C。2012年至2013年,100例福尔马林固定石蜡包埋的原发性BC标本也从哈尔滨医科大学肿瘤医院病理科获得。以上患者均有完整的临床病理资料。术前接受辅助化疗、免疫治疗或放射治疗的患者和复发肿瘤、转移性疾病、双侧肿瘤或其他先前肿瘤的患者除外。我们的研究得到了哈尔滨医科大学研究伦理委员会的批准。所有参与本研究的患者均签署知情同意协议。
实时定量PCR
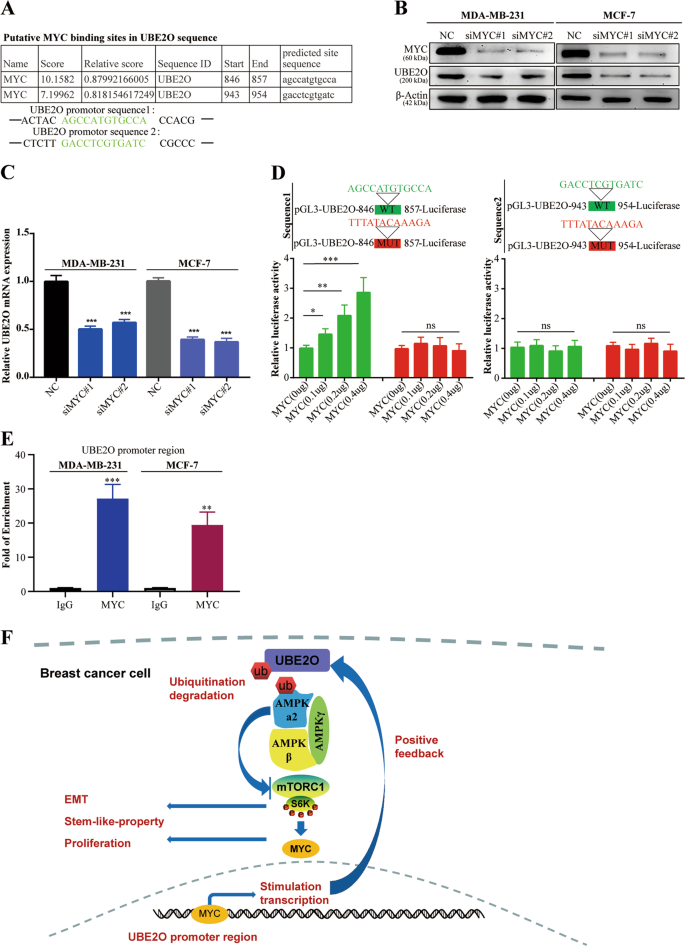
用TRIzol试剂(目录号15596018,Invitrogen,中国)提取总RNA,用Rever TraAce PCR试剂盒(日本TOYOBO目录号FSQ-201)进行合成。QRT-PCR是在CFX 96触摸检测系统(美国Bio-Rad)上使用SYBR Green实时PCR主混合(目录号QPK-201,日本TOYOBO)进行的。二−∆∆CT采用基因表达定量方法。以GAPDH为参照基因。The sequences of the primers were as follows:GAPDH,5′-GGAGCGAGATCCCTCCAAAAT-3′(F)and 5′-GGCTGTTGTCATACTTCTCATGG-3′(R);UBE2O,5′-GAATCCAAAACCAAGAGCGAAG-3′(F)and 5′-TCATCTCTGCCTTCTTTTAGCA-3′(R);MYC,5′-GGCTCCTGGCAAAAGGTCA-3′(F)and 5′-CTGCGTAGTTGTGCTGATGT-3′(R).
细胞计数试剂盒-8(CCK-8)及集落形成试验
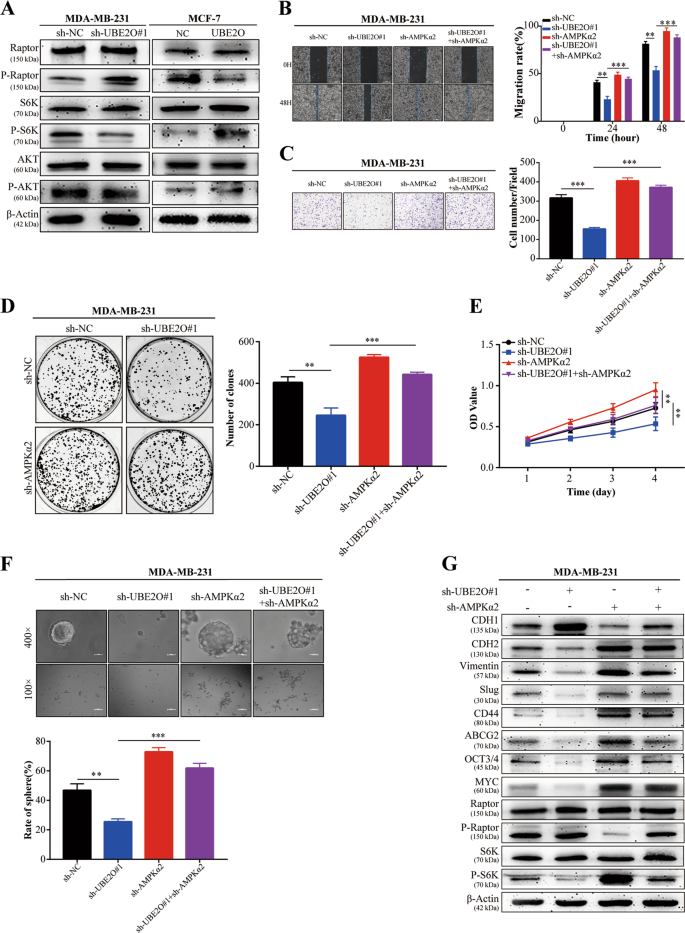
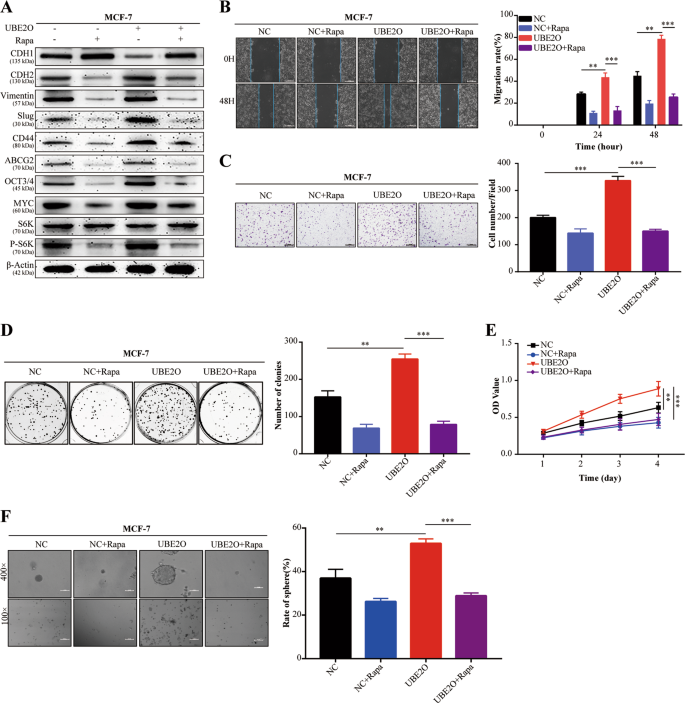
CCK-8检测细胞(2×10)3每孔)分别接种于96孔板的每口井中,在培养基中孵育。在每一预置时间,在每口井中加入CCK-8(目录号C 0038,Beyotime,中国)的10×10升的CCK-8溶液,每口井含有90%的培养基。37°C孵育2h,在570 nm处测定吸光度。
集落形成试验:将所指示的BC细胞接种到6孔板(每孔500个细胞)中,每2天刷新一次培养基。2周后用福尔马林固定30 min。采用结晶紫(编号:C 8470,Solarbio,中国)对细胞进行染色,并采用荧光M系统(ProteinSimple,USA)对细胞进行染色。
伤口愈合和侵袭试验
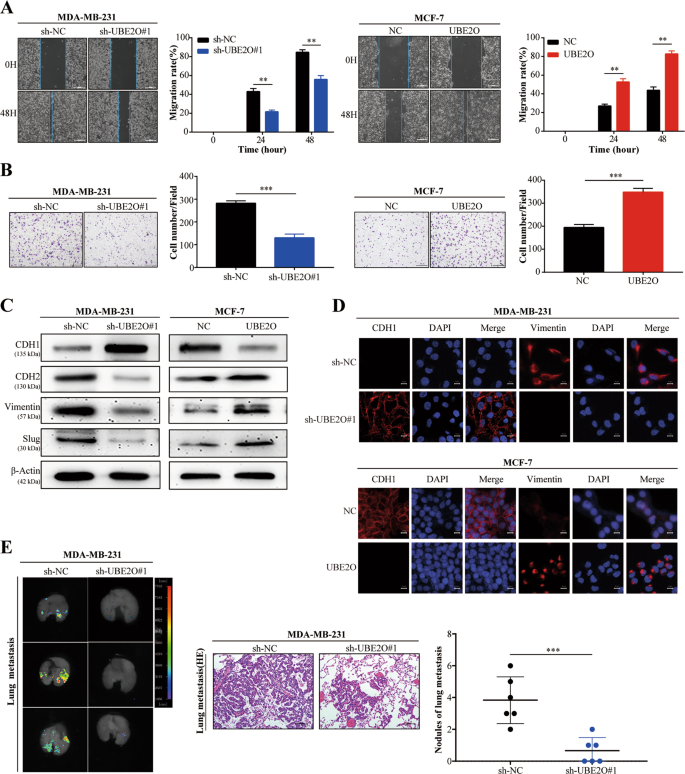
创面愈合试验:细胞接种6孔板,细胞达到100%汇合后,用无菌微管进行划痕处理。在每个预置时间,用磷酸盐缓冲液冲洗细胞,并在显微镜下拍摄图像。然后,测量和分析指示细胞的迁移率。
在侵入试验中,24口井透井板(美国取芯)的上部室涂上了Matrigel(美国取芯目录编号356234)。细胞(1×10)5)悬浮于200μl无血清培养基中,接种于Transwell板的上腔。下腔室加入10%FBS培养液600μl,37°C孵育24h,固定细胞,用结晶紫染色。然后,拍摄图像,在显微镜下对细胞进行计数。
球体文化与球体形成试验
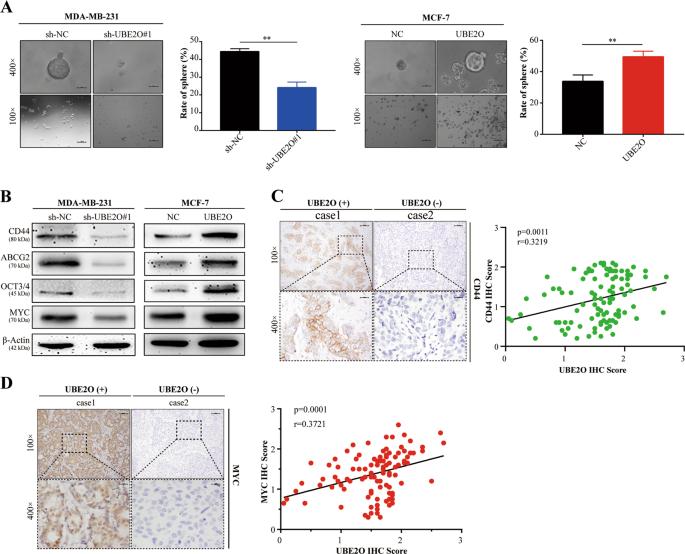
细胞悬浮于肿瘤干细胞培养基(1×10)中。3含DMEM/F-12(编号:12660012,美国吉布科)、1×B27(目录号17504044,Invitrogen,美国)、20 ng/ml表皮生长因子(目录号PHG 0311,Invitrogen,美国)、20 ng/ml碱性成纤维细胞生长因子(目录编号PHG 0263,Invitrogen,美国)和2mM L-谷氨酰胺(目录编号25030081,Invitrogen,美国)。然后,将这些细胞接种到超低附着板中(Thermo Science,USA).每隔48h更换培养基一次,2周后用显微镜对茎球进行成像和计数。
免疫组织化学(IHC)和免疫荧光染色
采用标准链霉亲和素-过氧化物酶复合物法对BC患者和小鼠石蜡包埋标本进行IHC检测。三位病理学家分别用标准组织化学评分(H-Score)对染色结果进行评价和评分。
免疫荧光染色试验如前所述。26。简单地说,细胞被固定,0.5%Triton-100(Solarbio,中国)渗透,5%牛血清白蛋白阻断。在此基础上,用美国的细胞信号技术:抗Cdh 1(14472)和抗波形蛋白(5741)孵育细胞。然后分别与相应的二级抗体(CST,USA)和4‘,6-二氨基-2-苯环吲哚(DAPI)(Thermo Fisher Science,USA)共同孵育。最后用共聚焦显微镜观察染色结果。
Westernblot和环己酰亚胺测定法
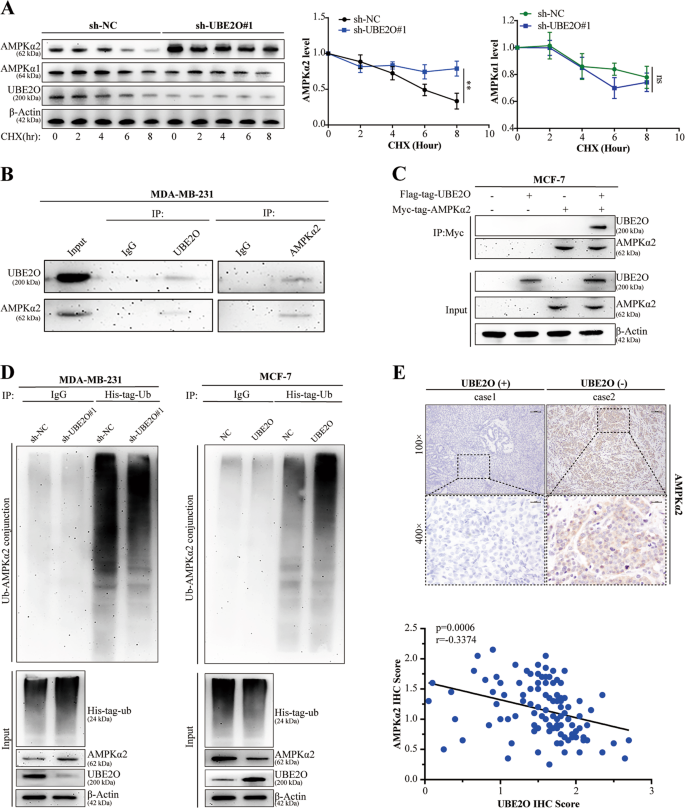
采用放射免疫沉淀法(RIPA)(目录号P0013B,Beyotime,中国)对含苯甲基磺酰氟(PMSF)缓冲液(目录号ST 506,Beyotime,中国)进行Westernblot分析。收集裂解液,并按前面描述的方法进行westernblot检测。27。实验采用UBE2O(15812~1-AP)、AMPKα1(10929~2-AP)、AMPKα2(18167-1-AP)、CDH 2(22018-1-AP)、CD 44(15675-1-AP)、ABCG 2(27286-1-AP)、MYC(10828-1-AP)和β-actin(60008-1-Ig)等抗体。Cdh 1(14472)、波形蛋白(5741)、鼻塞(9585)、OCT 4(2750)、猛禽(2280)、PS 792-猛禽(2083)、S6K(2708)和PT 389-S6K(9234)。
采用放线菌酰亚胺(CHX)法,将MDA-MB-231细胞接种于6孔板中,隔夜培养.在培养基中加入CHX(200μg/ml)(目录号C 7698~5G,Sigma,USA)。在预定时间(0、2、4、6和8h)收集细胞,进行Westernblotting。
慢病毒转染
为建立稳定的UBE2O过表达细胞,将UBE2O表达慢病毒载体和空载体(Genechem,Genechem)分别以8μ/ml的方式转染MCF-7细胞。24小时后,用普罗霉素筛选细胞,获得稳定的UBE2O表达细胞。
为构建稳定的UBE2O或AMPKα2基因敲除细胞,设计了针对UBE2O和AMPKα2的shRNA(Sigma,USA)。其序列如下:ube2OshRNA#1:5′-CCGGCGATGATTCCTATGGCTTCTACTCGAGTAGAAGCCATAGGAATCATCGTTTTT-3′;ube_2O-shRNA#2:5′-CCGGGACATCAAGAAGCTACAGGAACTCGAGTTCCTGTAGCTTCTTGATGTCTTTTT-3′;ube_2O-shRNA#3:5′-CCGGCGGGTCTCTTCTTCGATGATTCTCGAGAATCATCGAAGAAGAGACCCGTTTTT-3′;ampkα2-shRNA#1:5′-CCGGCGCAGTTTAGATGTTGTTGGACTCGAGTCCAACAACATCTAAACTGCGTTTTT-3′;ampkα2-shRNA 2:5′-CCGGGTGGCTTATCATCTTATCATTCTCGAGAATGATAAGATGATAAGCCACTTTTT-3′;和ampkα2-shRNA#3:5′-CCGGCCCACTGAAACGAGCAACTATCTCGAGATAGTTGCTCGTTTCAGTGGGTTTTT-3′.。用qRT-PCR和westernblotting检测转染效果。
质粒与RNA干扰
标记的UBE2O、MYC标记的AMPKα2和His标记的泛素质粒是由Genechem(Genechem,中国)构建的.所有构建物均经全长测序验证。针对MYC的siRNA是从基因制药公司(中国上海)购买的。瞬时转染用脂质体2000转染试剂(目录编号11668019,Invitrogen,美国)根据制造商的指示进行。序列如下:MYC-RNAi#1:5′-GAGGAUAUCUGGAAGAAAUTTAUUUCUUCCAGAUAUCCUCTT-3′;MYC-RNAi#2:5′-GCUUGUACCUGCAGGAUCUTTAGAUCCUGCAGGUACAAGCTT-3′;和MYC-RNAi#3:5′-GGAAGAAAUCGAUGUUGUUTTAACAACAUCGAUUUCUUCCTT-3′.
免疫共沉淀(IP)和泛素化试验
IP试验用含PMSF的RIPA缓冲液对MDA-MB-231细胞进行裂解,离心分离.然后取部分裂解液作为输入,其余部分与IgG或相应的抗体在4°C孵育一夜。然后将微球加入混合物中,旋转4h,用含PMSF的三缓冲盐水(TBS)洗涤。最后,对样品进行煮沸和西方印迹。共免疫共沉淀(Co-IP)实验中,将标记的UBE2O和MYC标记的AMPKα2质粒同时转染MCF-7细胞.48小时后,收集并溶解细胞,细胞裂解液按上述IP处理。
体外泛素化试验如前一份报告所述。28。将His标记的泛素质粒(Genechem,China)转染到所述细胞中,培养48h,收集细胞,进行上述IP处理。
染色质免疫沉淀(芯片)
芯片分析试剂盒(产品目录号,P 2078,Beyotime,中国)是根据制造商的指示使用的。总之,MDA-MB-231和MCF-7细胞在最终浓度为1%的甲醛作用下,将靶蛋白与DNA交联。然后,加入甘氨酸溶液以终止反应。样品经1000×离心分离。g2分钟。然后,将细胞再悬浮在PMSF的十二烷基硫酸钠裂解缓冲液中,用超声波细胞干扰剂在冰上溶解。然后,用DNA净化试剂盒提取和清洗DNA(目录编号D 0033,Beyotime,中国)。然后,用抗MYC(CST,USA)或IgG抗体在4°C孵育一夜,然后用蛋白A沉淀。最后纯化DNA,用qRT-PCR检测UBE2O启动子片段.UBE2O启动子的引物为5‘-TCCGGTTCAAGCGATTTG-3’(F)和5‘-CATGCGAAACCCCATCTCTCTACT-3’(R)。
荧光素酶报告试验
采用美国Promega公司的双荧光素酶检测系统。将野生型或突变型UBE2O启动子荧光素酶报告质粒转染293 T细胞,并将不同数量的MYC质粒转染293 T细胞。48小时后,用被动裂解缓冲液溶解细胞,并进行荧光素酶分析。萤火虫荧光素酶活性正常为肾荧光素酶活性作为内部对照。
动物研究
所有动物研究均经哈尔滨医科大学医学实验动物护理委员会批准。6周龄雌性BALB/c裸鼠(北京生命河实验动物技术有限公司)随机分为两组(n=6)。MDA-MB-231-Luc细胞(5×10)5)分别在小鼠乳腺脂肪垫内注射sh-UBE2O#1和sh-NC。每5天测量一次肿瘤生长。注射后7周,用XenogenIVIS光谱成像系统(美国卡利珀生命科学)对小鼠进行成像,并对肿瘤进行IHC采集。肿瘤体积用以下公式计算:1/2(长×宽)2)。肿瘤转移模型:6周龄雌性BALB/c裸鼠(n6)随机分为两组。MDA-MB-231-Luc细胞(5×10)5)将sh-UBE2O#1和sh-NC分别转染小鼠尾静脉。注射后7周,取肺组织进行苏木精和伊红染色。每一组的样本大小是根据先前的研究确定的。29,30,31.
统计分析
所有数据均以至少三个独立实验的平均值±SDS表示。统计分析用学生的t检验或单因素方差分析以及各组间的差异在统计学上进行比较是相似的。在动物研究中,没有使用致盲的方法。用卡方检验分析UBE2O表达与BC患者临床病理特征的关系。采用Kaplan-Meier法和对数秩检验法绘制生存曲线.P < 0.05 indicated statistical significance, which was evaluated using SPSS 21.0 software (Statistical Product and Service Solutions, USA).