MYC通过克劳丁低三阴性乳腺癌的多基因程序调节脂肪酸代谢
MYC通过克劳丁低三阴性乳腺癌的多基因程序调节脂肪酸代谢
摘要
背景
最近的研究表明,脂肪酸氧化(FAO)是三阴性乳腺癌(TNBCs),尤其是那些MYC高表达的乳腺癌的生长的关键代谢途径。但是,关于MYC促进粮农组织的基本机制仍然知之甚少。
方法
我们结合了代谢组学,转录组学,生物信息学和显微镜技术,阐明了MYC调节TNBC中FAO的潜在机制。
结果
我们建议MYC诱导涉及细胞内钙信号和脂肪酸代谢变化的多基因程序。我们确定了脂肪酸转运蛋白(CD36),脂肪酶(LPL)和激酶(PDGFRB,CAMKK2和AMPK)的关键作用,它们均有助于在表达MYC致癌水平的人类乳腺上皮细胞中促进FAO的生长。生物信息学分析进一步表明,该多基因计划得到了高度表达,并预测TNBC的claudin低分子亚型的存活率较差,但TNBC的其他亚型则没有,这表明在临床上针对FAO的努力可能最适合低claudin TNBC的患者。
结论
我们确定了粮农组织机制中的关键部分,这些关键部分有可能成为改善TNBC患者治疗的目标,尤其是claudin-低分子亚型。
背景
最近的一项研究分析了2000多种乳腺肿瘤的拷贝数和基因表达变化。1,2的一个在乳腺癌最常用和高度扩增的基因的是MYC。1,3 MYC是激活参与细胞周期调控,细胞生长,蛋白质合成,线粒体功能,和代谢的基因的转录因子。MYC扩增在所有乳腺癌中约25%发生,在三阴性乳腺癌(TNBC)中更频繁地发生(高达50%)。4,5 MYC基因扩增与复发风险,预后不良,和死亡有关。6,7
MYC是已知的癌症代谢重编程调节剂。8,9最近的研究报道了TNBC细胞与MYC的高表达有脂肪酸β氧化作用(FAO)的比例很高。10他们进一步证明,用依托莫司对FAO的药理学抑制作用损害了MYC高表达但非MYC低表达的TNBC患者源异种移植物的生长,这表明针对FAO可能是高表达TNBC患者的可行治疗选择。我的C。[10]不幸的是,由于肝毒性的报道,在临床试验中埃托莫昔的安全性受到质疑,最近的一项研究表明,埃托莫昔可以以脱靶(非CPT1A)依赖性方式引起严重的氧化应激。11,12因此,有更好的未满足的需要,FAO的安全抑制剂。与粮农组织有关的其他目标是最近才出现的。例如,已证明FAO可促进TNBC中SRC的活化和转移,[ 13]而另一项研究表明,含有CUB结构域的蛋白1(CDCP1)抑制了酰基辅酶A合成,从而刺激了TNBC细胞系中的FAO。14然而,CDCP1在乳腺中的作用与有争议的报道存在争议。15,16
我们研究的目的不是进一步证明粮农组织在TNBC中的重要性,而是阐明MYC与激活FAO之间的机制联系,并确定阻止TNBC中的FAO的新的可行目标。我们使用表达MYC致癌水平的人乳腺上皮细胞(HME)作为模型系统,以清晰地描述MYC如何促进粮农组织的发展。我们的结果表明MYC会改变钙(Ca 2+)信号传导,然后通过激活Ca 2+来促进FAO-CAMKK2-AMPK信号轴。我们还确定了脂肪酸转运蛋白CD36的重要作用,其中CD36介导TNBC中的脂肪酸吸收。与表达端粒酶逆转录酶(TERT)或HER2的同基因细胞系相比,MYC HME细胞的细胞迁移增加了10倍。MYC HME细胞的迁移可以通过靶向CD36,CAMKK2或FAO来抑制,这表明脂肪酸的摄取和氧化可能是支持细胞迁移所需能量的重要代谢途径。我们发现CD36和其他脂肪酸代谢基因(即LPL,PDK4,FABP4)在TNBC中高度共表达,特别是在TNBC的claudin低亚型中,它们的高表达预示着不良的生存。总的来说,
方法
细胞培养,siRNA转染和慢病毒转导
在添加了HMEC补充试剂盒(Thermo Fisher Scientific)和1x青霉素-链霉素(Corning)的1x HMEC无基础血清培养基(Thermo Fisher Scientific)中培养HME细胞。将MDA-MB-468(ATCC),T47D(ATCC),BT474(ATCC),MDA-MB-231(ATCC),Cal120(DSMZ),Cal51(DSMZ),BT549(ATCC)细胞培养在1×DMEM / F-12 50/50补充了10%的胎牛血清(FBS)(生命技术)和1x青霉素-链霉素。Hs578t(ATCC)细胞在添加有0.01 mg / ml牛胰岛素(Sigma),10%FBS和1x青霉素-链霉素的1×DMEM / F-12 50/50中培养。将SUM159PT(Asterand Bioscience)细胞在补充有5%FBS,氢化可的松(1μg/ ml)和人胰岛素(5μg/ ml)的1x DMEM / F-12 50/50中培养。siRNA转染是通过使用RNAiMAX进行反向转染进行的。所有siRNA均来自Qiagen,并用作四个单独siRNA的库。MYC + pTRIPZ,MYC + shCD36#2和MYC + shCD36#3是使用慢病毒产生的,该慢病毒是由用psPAX2,pVSV-G和相应的pTRIPZ载体(GE Healthcare)转染的HEK293T细胞产生的(Lipofectamine 2000)。使用嘌呤霉素选择MYC HME细胞库。强力霉素(0.5μg/ ml)用于诱导shRNA转录。
蛋白质印迹
细胞在补充有50 mM二硫苏糖醇(DTT)的1x Bolt LDS样品缓冲液(Life Technologies)中裂解。将裂解液在95°C下加热5分钟,然后以10,000× g离心10分钟 然后使用Bolt 4-12%Bis-Tris Plus预制聚丙烯酰胺凝胶(Life Technologies)在200 V下溶解裂解液30分钟,然后使用Mini Blot Module转移系统(Life Technologies)在10 V上将其印迹在硝酸纤维素膜上1 h。然后在室温下,使用含吐温(TBST)的Tris缓冲盐水溶液中的5%牛奶封闭印迹1小时。将印迹与一抗在4°C下孵育过夜。一抗以1:1000稀释度在TBST中的1%牛血清白蛋白(BSA)和0.05%叠氮化钠中使用。抗体从以下供应商处购买:肌动蛋白(Abcam#8226),TERT,HER2(细胞信号#4290),MYC(细胞信号#5605),微管蛋白(Sigma HPA043640),ER(细胞信号#8644),PR(细胞信号编号#8757),EGFR(细胞信号编号#4267),AMPK(细胞信号编号#2532),P-AMPK(Cell Signaling#2535),P-ACC(Cell Signaling#3661),CAMKK2(Santa Cruz#100364和Abnova#H00010645),CDH1(Cell Signaling#5296)和PDGFRB(Cell Signaling#3169)。二抗购自Li-Cor Biosciences(山羊抗小鼠#926-32210和驴抗兔#926-68073),并稀释为TBST的1:10,000溶液。与二抗一起在室温下孵育1小时。使用Li-Cor Odyssey红外成像仪对印迹成像。与二抗一起在室温下孵育1小时。使用Li-Cor Odyssey红外成像仪对印迹成像。与二抗一起在室温下孵育1小时。使用Li-Cor Odyssey红外成像仪对印迹成像。
定量PCR(qRT-PCR)
使用RNeasy Mini Kit(Qiagen)分离总RNA,并使用SuperScript IV VILO Master Mix(Life Technologies)反转录。使用ABI 7500快速qPCR系统(Thermo Fisher Scientific)通过Fast SYBR Green Master Mix(Life Technologies)扩增cDNA。使用ABI 7500 v2.0.6软件分析结果。靶基因的相对表达水平通过归一化使用ΔΔC的β肌动蛋白基因确定吨方法。
为了定量线粒体DNA,使用线粒体DNA分离试剂盒(Abcam; ab65321)从HME细胞中分离了mtDNA。使用gDNA纯化试剂盒(Thermo Scientific)从HME细胞中分离基因组DNA(gDNA)。使用ABI 7500 Fast qPCR系统(Thermo Fisher Scientific)进行qPCR,并使用ABI 7500 v2.0.6软件分析结果。线粒体基因的tRNA相对表达水平亮氨酸(UUR)和的16S rRNA,通过归一化使用ΔΔC核基因β2微球蛋白确定吨方法如前所述。17,18
流式细胞仪
对于MitoTracker Green染色,将HME细胞沉淀,用冰冷的PBS洗涤,然后重悬于1x HME细胞无血清基础培养基(Thermo Fisher Scientific)中,并与20 nM MitoTracker Green FM(Thermo Fisher Scientific)孵育。然后将细胞用PI(Alfa Aesar)染色。使用CellQuest软件在FACSCalibur(Becton-Dickinson)流式细胞仪上对细胞进行分选。首先对细胞进行PI染色分选;PI阳性细胞从分析中排除。然后将细胞分类以进行MitoTracker Green染色。使用MitoTracker Green强度的几何平均值进行分析。图形展示使用FlowJo软件完成。
为了通过PI染色进行细胞死亡/细胞周期分析,将HME细胞用10 µM STO-609或150 µM依托莫司处理48小时。沉淀细胞和细胞培养基,用冰冷的PBS洗涤,然后用冰冷的70%乙醇固定。在RNA消化之前,用冰冷的PBS再次洗涤细胞。然后将细胞用PI染色。使用CellQuest软件在FACSCalibur(Becton-Dickinson)流式细胞仪上对细胞进行分选。首先对细胞进行PI染色分选,然后根据PI荧光强度创建细胞周期图。使用细胞周期概况的每个片段(Sub-G1,G0 / G1,S或G2 / M)中的细胞百分比进行分析。使用FlowJo软件完成了数据分析和图形展示。
对于细胞表面受体表达分析,使用细胞解离缓冲液(Thermo Fisher Scientific)分离细胞,并在冰冷的PBS中洗涤。在染色缓冲液(PBS和5%BSA)中洗涤细胞。将细胞在第一抗体CD36(Epitomics#S1249;现已停产)或GFP(Clontech)中的冰上孵育30分钟,然后在染色缓冲液中洗涤。对于CD36和GFP染色,在冰上用Alexa Fluor 488染色15分钟,然后在染色缓冲液中洗涤细胞。使用CellQuest软件在FACSCalibur(Becton-Dickinson)流式细胞仪上分析细胞。
共聚焦显微镜
MYC和TERT HME细胞在玻璃盖玻片上的6孔板中生长。用PBS洗涤细胞,并在室温下固定在4%多聚甲醛中。将盖玻片在PBS中洗涤,并用10%FBS封闭,并与抗人CD36(Epitomics#S1249;现已停产)在5%BSA中孵育过夜。将盖玻片与在5%BSA中的Alexa Fluor 488抗小鼠IgG(Molecular Probes)孵育,在PBS中洗涤,并固定在含有DAPI的免疫荧光固定介质中(Vectashield; Vector Laboratories,Servion,瑞士)。使用配备有63×/ 1.32.ph3油HCX PL APO透镜(Leica,Milton Keynes,UK)的共聚焦显微镜(Leica SP2(DMIRBE)激光扫描共聚焦,配备Leica SP2软件)分析样品。
脂肪酸摄取的延时成像
将HME细胞接种在薄层基质胶包被的玻璃6孔板上,并用含有BODIPY标记的十二烷酸的0.5×上样缓冲液处理。根据QBT脂肪酸摄取测定试剂盒(Molecular Devices)的制造商说明制备上样缓冲液。简而言之,将一个含有BODIPY标记的十二酸的小瓶的内容物溶于10 ml的1x HMEC无基础血清培养基(Thermo Fisher Scientific)+ 0.2%无脂肪酸BSA(Sigma)中,制成1x上样缓冲液。使用配备40倍物镜和Hamamatsu ORCA相机的Nikon TE300自动倒置显微镜对HME细胞成像6小时。每500分钟曝光一次,每5分钟捕获一次图像。为了对STO-609-(10μM)和依托莫司(40μM)处理的细胞进行延时成像,应同时添加药物和0.5x上样缓冲液。
碳13稳定同位素示踪实验和代谢组学
如先前所述进行所有代谢组学和脂质组学研究,但有微小差异。19,20的所有代谢实验在执行血清样改进的Eagle培养基(SMEM),其中式先前已描述。19,21 SMEM包含在血液中的浓度是人类生理学相关发现54级不同的营养素。为SMEM补充了Invitrogen(Life Technologies)的HMEC补充试剂盒。将细胞在统一标记的13 C-棕榈酸酯(0.05 mM),13 C-葡萄糖(5.5 mM)或13中孵育C-谷氨酰胺(0.65 mM)持续30分钟,4小时或8小时,如图中的图例所示。对于细胞内提取物,孵育后,将SMEM培养基吸出,并将细胞在冰冷的PBS中洗涤一次。通过向孔中添加甲醇/乙腈/水(5:3:2)的溶液来提取代谢物。将板在摇床上于4℃温育5分钟,然后收集提取溶液。通过在4°C下以15,000x g离心10分钟来清除代谢产物提取物。将上清液转移到带PTFE帽的LC-MS硅烷化玻璃小瓶中,并立即在LC-MS上运行或储存在-80°C下。
为了分析养分吸收和外流,在24小时后收集培养基,并将其稀释50倍至萃取液中(如上所述)。将提取的培养基在热混合器上于4°C涡旋10分钟,然后于-80°C冷冻过夜。第二天,将提取的培养基在冰上解冻,离心后,将澄清的上清液转移至硅烷化的玻璃小瓶中,并立即通过LC-MS运行或在-80°C下保存。
LC-MS分析是在配备了HESI II探针并与Vanquish Horizon UHPLC系统(Thermo Fisher Scientific)耦合的Q Exactive混合四极杆Orbitrap HF-X MS(Thermo Fisher Scientific)上进行的。总共注入0.002 ml样品,并在2.1mm ZIC-pHILIC上通过HILIC色谱分离。样品用碳酸铵,0.1%氢氧化铵,pH 9.2分离,流动相B为乙腈。LC以0.2ml / min的流速运行,并且所使用的梯度如下:0min,85%B;和50%B。2分钟,85%B;17分钟,20%B;17.1分钟,85%B;在85%B下加热26分钟。将色谱柱保持在45°C,并且在将流动相流入色谱柱之前,还将流动相在45°C下预热。MS的相关参数如下:鞘气40;辅助气体10; 扫气1 辅助气体加热器温度为350°C;喷雾电压3。正模式为5 kV,负模式为3.2 kV。毛细管温度设定为325°C,漏斗RF水平设定为40。样品在完全MS扫描中进行分析,极性切换范围为65-975 m / z ; 120,000解析度; 自动增益控制(AGC)目标为1E6;最大进样时间(最大IT)为100毫秒。使用带注释的化合物库和TraceFinder 4.1软件对代谢物进行鉴定和定量。“ M + X”命名法是指给定代谢物的同位素。同位素抑制剂是化学上相同的代谢产物,仅碳13原子数不同。例如,“ M + 2柠檬酸盐”是指柠檬酸盐中六个碳中的两个是13碳,而其他四个是12碳。“ M + 4柠檬酸盐”是指柠檬酸盐中六个碳中的四个是13碳,另外两个是12碳。
脂质组学
细胞沉淀用冷的脱气PBS洗涤两次,重悬在甲醇中,然后转移到硅烷化的玻璃管中。用400 ng 12:0/12:0-PC,100 ng 17:0-LPC,300 ng 12:0/12:0-PE和100 ng 17:1-LPE加标样品; 0.88%氯化钠; 和氯仿。将混合物在室温下涡旋20秒,并在冰冷的水浴中超声处理2分钟。将样品在4°C下以1100 rpm离心15分钟。收集下层相。上层相用合成的下层相萃取(氯仿/甲醇/0.88% NaCl以2:1:1的体积比混合,相分离后,将下层相作为合成下层相进行脂质的第二次萃取)。合并得到的下层相,并在室温下用SpeedVac(Thermo Scientific)在真空下干燥,然后重新溶解在氯仿中。使用Thermo Orbitrap Elite系统(Thermo Fisher Scientific)将五种在线脱气机,四泵,柱温箱和自动进样器与较冷的Prominence HPLC系统(Shimadzu)相连,将最终产物注入LC-MS / MS分析中。脂质分析。详细地,基于正头基团的极性,在正相硅胶柱(2.1×150 mm,4micro,MicoSolv Technology)上用正己烷/二氯甲烷/氯仿/甲醇/乙腈/水/乙胺溶剂梯度分离脂质类别。高分辨率(240k at 在正相硅胶色谱柱(2.1×150 mm,4micro,MicoSolv Technology)上,根据头基的极性,用己烷/二氯甲烷/氯仿/甲醇/乙腈/水/乙胺溶剂梯度分离脂类。高分辨率(240k at 在正相硅胶色谱柱(2.1×150 mm,4micro,MicoSolv Technology)上,根据头基的极性,用己烷/二氯甲烷/氯仿/甲醇/乙腈/水/乙胺溶剂梯度分离脂类。高分辨率(240k atm / z 400)/准确质量(质量准确度<5 ppm)和串联质谱(碰撞诱导的碎片)用于分子种类的鉴定和定量。参考适当的脂质标准可进一步确认脂质的身份。
耗氧率和细胞外酸化率测量
测定前将细胞播种24 h,并铺满90-100%。粮农组织测量,将细胞在KHB缓冲液(111毫摩尔氯化钠,4.7毫米氯化钾,2mM的硫酸镁洗涤两次4,1.25mM的氯化钙2,1.2mM的钠2 HPO 4,100μM 升-肉碱,5 mM HEPES,并用NaOH将pH调节至7.4),然后添加100μMBSA偶联的棕榈酸酯。在使用Seahorse Bioanalyzer XF24(Agilent)分析之前,将细胞温育1小时以适应缓冲液。加入抗霉素A和鱼藤酮可建立背景耗氧率(OCR),并从已报道的基础OCR中减去。为了在FAO上进行血小板衍生的生长因子受体β(PDGFRB)和表皮生长因子受体(EGFR)研究,在加入100μMα-环糊精偶联物之前,先用25 ng / ml PDGF-BB或EGF预处理细胞1小时棕榈酸酯。加入10μM的STO-609和40μM的依托莫司。
为了进行细胞外酸化率(ECAR)测量,在分析前24小时,将TERT和MYC HME细胞接种在96孔Seahorse Bioanalyzer平板中的HME无血清培养基中。用PBS洗涤细胞一次,然后添加补充有5.50mM葡萄糖,0.65mM谷氨酰胺和0.10mM丙酮酸盐的海马培养基。使用XFe96 Seahorse生物分析仪测量ECAR。使用Seahorse Wave 2.6软件分析数据。
脂蛋白脂肪酶活性测定
根据制造商的规程(Sigma)进行脂蛋白脂肪酶(LPL)活性测定。简而言之,制备了包含反应缓冲液和LPL底物乳液的主反应混合物,并将195μl移液到96孔黑色透明底部(平板)板上。使用多通道移液器添加总计5μl的HME细胞裂解液,并将板立即置于荧光计上,每80 s在37°C下读数(Ex = 365; Em = 485)1 h。无细胞裂解物的孔用于背景扣除。Lowry分析用于评估细胞裂解液中的蛋白质浓度。
碳14粮农组织测定
在进行FAO检测之前,将HME细胞播种24小时。将细胞在PBS中洗涤,并加入200μM肉碱和与α-环糊精缀合的1.2μCi(20μM)U - 14 C-棕榈酸酯的新鲜培养基,并在37°C下孵育4小时。将浸泡在5 N NaOH中的Whatman纸附着到每个培养皿的盖子上,并将2.6 N HClO 3添加到培养基中,以在1小时内释放并捕获14 CO 2。Whatman纸直接在闪烁液中计数。对于酸溶性代谢物(ASM),除去培养基,并在60°C下将4 N KOH加入到水解酰基辅酶A酯(皂化)中30分钟;1 M NaC 2 H 3 O 2和3 NH 2 SO 4加入样品并将样品涡旋并转移至玻璃小瓶中。加入CHCl 3:CH 3 OH 的2:1混合物,将样品涡旋,然后加入4 mM MgCl 2,并再次涡旋,然后短暂旋转以分离各相。将上层(水)相添加到闪烁液中并使用闪烁计数器。Lowry分析用于分析蛋白质含量并标准化数据。
RNA测序和独创性途径分析
使用Qiagen RNeasy试剂盒分离RNA。使用Epicenter Ribo Zero试剂盒进行核糖耗尽。根据Illumina TruSeq方案制备文库,并在Illumina GAIIx上测序。使用ensembl(ncbi36.54转录组)将Tophat 1.4.1与hg18进行比对。使用Cuffdiff 2.0.2进行片段偏向和多读校正的成对比较。使用Cuffdiff进行成对样本比较,通过Benjamini-Hochberg方法估计的错误发现率(FDR)用于创建一组通过FDR <5%的重要基因。在所有比较中,满足FDR 5%临界值的所有基因也具有至少4.8倍的变化差异。使用上四分位数归一化对样本进行归一化,并认为在FDR <5%时显着。基因网络,规范途径,https://www.qiagenbioinformatics.com/products/ingenuity-pathway-analysis)。22每个条件下只有一个重复,但是,由于Cuffdiff使用beta负二项式分布作为基础统计模型,因此其重要性考虑到了RNA测序数据的读取计数性质,与仅使用倍数变化相比,其置信度更高。
数据挖掘和人类患者数据
所有患者肿瘤mRNA表达数据,z-得分,拷贝数增加和基因扩增数据均从www.cbioportal.org获得。23,24克乳腺癌患者的肿瘤基于如称为由METABRIC数据库和PAM50 +密蛋白-低的分子亚型分类。1所有METABRIC表达数据和患者元数据均可通过www.cbioportal.org免费获得。
钙成像
在含有(mM)谷氨酸钠(80);氯化钠,54;氯化钾,5; 氯化镁2,1 ; 的CaCl 2,0.1,HEPES,10; 葡萄糖10; 和0.2,EDTA(去除重金属);用NaOH将pH在室温下调节至7.3。
上样后,将细胞洗涤并在培养基中成像(HME细胞不含基础血清的培养基,其中添加了HMEC补充试剂盒和1x青霉素-链霉素)。
使用宽视场数字成像系统获得二维[Ca 2+ ] c图像。激发光由单选光器(英国西萨塞克斯郡的PTI Inc.)提供,以产生490 nm(带通5 nm),并通过液体光导耦合到尼康TE2000U显微镜(英国尼康,萨里郡)。由物镜(×40,NA 1.3)收集荧光发射,并将其发射到由Winfluor控制的带有片上电子倍增的冷却,背照式,帧转移CCD照相机(级联512B; Tuscan,Photometrics,美国亚利桑那州)英国格拉斯哥斯特拉斯克莱德大学)。除非另有说明,否则以10 Hz的频率收集图像。笼式IP 3的光解使用直接连接到显微镜(德国汉堡Rapp Optoelektronic)的三倍频ND:Yag(波长355 nm)激光可以实现这一目标。光解部位的位置(直径约2 µm)由计算机控制(Rapp Optoelektronic)。光解脉冲的持续时间为1 ms,在目标条件下测得的能量为100 µW。
使用程序Metamorph 7.5(Molecular Devices Ltd.,Wokingham,UK)或Image Pro 7.0(Media Cybernetics,MD)分析[Ca 2+ ]图像。为了补偿整个成像区域中荧光的变化(例如,由于细胞焦点的不规则性),将荧光信号减去背景,并表示为荧光计数(F)与基线(对照)值的比值(F / F 0)(取为1)刺激之前(F 0)。
将PDGF-BB用1%BSA-PBS稀释,然后将等分试样(1:100稀释)注入成像浴中,得到100 ng / ml。响应者归类为在PDGF暴露后不久(30 s内)出现的峰值F / F 0 > 1.15的那些细胞。
结果
表达TERT,MYC或HER2的HME细胞的生成
HME细胞已常规用作模型系统,以研究非永生化乳腺上皮细胞向永生化转化的癌细胞的致癌转化。25,26,27此外,HME细胞缺乏雌激素受体(ER)的表达,并因此提供了机会,ER阴性乳腺癌的发展模式。28最近的一项研究表明,在表达MYC的HME细胞的另一个模型中出现的表型和细胞行为与TNBC细胞系MDA-MB-231细胞非常相似。29为了确定与MYC激活FAO有关的新靶标,我们使用了稳定表达野生型MYC的筛选后HME细胞(MYC HME细胞)或MYC T58A的突变型(T58A HME细胞),其半衰期略长(图 1a)。30,31 MYC能够HME永生化细胞部分通过TERT的稳定化。25为确保我们在两个MYC HME细胞系中观察到的效应是特异性针对MYC表达而不是由于TERT引起的,我们还使用了同基因HME细胞系,该细胞系通过TERT直接稳定表达而永生(TERT HME细胞;图 1a)。31,32最后,我们引入的人表皮生长因子受体2(HER2)进入TERT HME细胞,以产生HER2过表达的HME细胞(HER2 HME细胞)。HER2是一种癌基因,通常在约20%的乳腺癌中扩增,与TNBC互斥,并作为与乳腺癌相关的癌基因过度表达的单独模型(图 1a)。等基因HME细胞细胞系的所有四个集合(TERT,MYC,T58A和HER2)对ER和孕激素受体(PR)均为阴性(图 1b)。因此,我们将MYC HME细胞和T58A HME细胞用作TNBC的代表性模型,在其中我们可以清楚地描述MYC对FAO的影响。
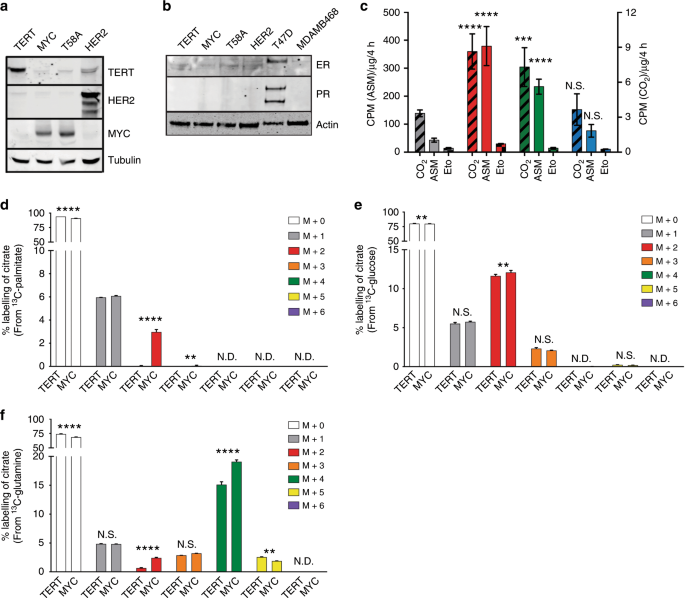
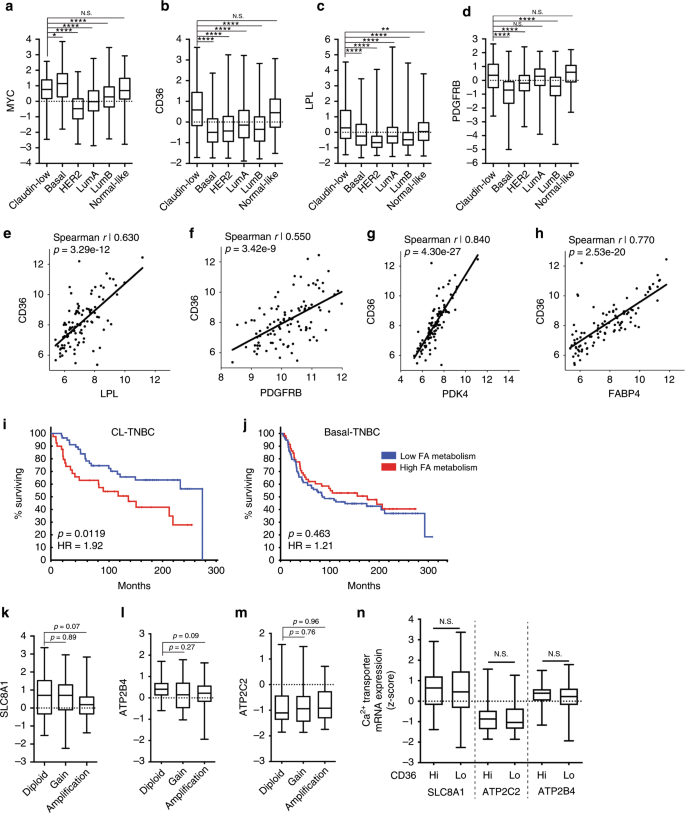
对HME细胞系(稳定库)中TERT,HER2和MYC蛋白表达的免疫印迹分析。b HME细胞和人乳腺癌细胞系中雌激素受体(ER)和孕激素受体(PR)的免疫印迹分析。T47D乳腺癌细胞对ER和PR均为阳性,可作为激素受体阳性细胞的对照。MDA-MB-468缺乏ER,PR和HER2的表达,可作为三阴性乳腺癌细胞的对照。c FAO 在HME细胞中的U - 14 C-棕榈酸酯。左y轴代表酸溶性代谢物(ASM;实心条)的碳-14标记。右y轴表示捕获14个 CO 2HME单元中的黑色斜线),这是粮农组织的数据。依托莫昔治疗用右y轴表示,显示了U - 14 C-棕榈酸酯对14 CO 2产生的抑制作用(方格)。在整个手稿中,TERT =灰色,MYC =红色,T58A =绿色,HER2 =蓝色;Ñ ≥3个独立实验。误差棒代表平均值±标准偏差(sd)。p值是使用不成对的Student t检验计算的,并且相对于每个相应测量的TERT HME细胞而言。d–f用0.05 mM U - 13 C-棕榈酸酯处理的细胞中柠檬酸盐标记的LC-MS定量(d),5.5 mM U - 13 C-葡萄糖(e)和0.65 mM U - 13 C-谷氨酰胺(f)30分钟。碳13标记表示为每个同位素的相对于总柠檬酸盐池的丰度百分比;n = 3个独立样本。在质谱仪上一次运行即可测量样品。使用普通的双向方差分析和Sidak的多重比较测试对每个同位素记录物计算出调整后的p值;* p <0.05,** p <0.01,*** p <0.001,**** p <0.0001,NS =不显着,ND =未检测到。
MYC足以刺激HME细胞中的粮农组织
我们最初想测试MYC是否足以在HME细胞中诱导FAO。为了测量FAO,我们在均一标记的14碳14棕榈酸酯(14 C 16-棕榈酸酯)中孵育了HME细胞。然后,我们测量了HME细胞产生的14 CO 2以及14 C标记的ASM的细胞内水平(图 1c)。ASM被定义为由14 C 16分解代谢形成的碳14标记的细胞内极性代谢产物-棕榈酸酯,例如乙酰辅酶A和三羧酸(TCA)循环中间体。重要的是,所有粮农组织的活动都被添加了埃托莫西(Etomoxir)阻止,埃托莫西是粮农组织限速酶的抑制剂,肉碱棕榈酰转移酶1A(CPT1A)(图 1c)。这项FAO分析显示,与TERT和HER2 HME细胞相比,MYC和T58A HME细胞的FAO比率显着更高。当棕榈酸酯结合物作为唯一的燃料底物时,通过在Seahorse Bioanalyzer上测量OCR也证实了这些结果(补充图 S1a)。
尽管粮农组织的测定表明MYC和T58A HME细胞具有更高的氧化脂肪酸能力,但与其他燃料来源(例如葡萄糖或谷氨酰胺)相比,它并未告知脂肪酸对线粒体代谢的贡献。为了解决这个问题,我们将细胞在统一标记的碳13(13 C)葡萄糖,谷氨酰胺和棕榈酸酯中短时间(30分钟)孵育,以柠檬酸盐标记作为读数比较这三种营养源的氧化。尽管我们没有检测13由柠檬酸盐的C-标记13在MYC HME单元C棕榈酸酯,我们几乎通过检测柠檬酸的标记13 C-棕榈酸酯在TERT HME细胞,这与图的结果一致 1C和补充图 S1A,并进一步表明,TERT HME细胞的FAO水平非常低(图 1d和补充图 S1b)。尽管具有统计学意义,但我们仅从13 C-葡萄糖中检测到柠檬酸盐标记中的细微差异(图 1e和补充图 S1c)。13 C-棕榈酸酯被氧化的速率约为13 C-葡萄糖的25%;但是,这很可能低估了MYC HME细胞中FAO的实际水平,因为培养基中存在其他脂肪酸,它们也可能与50μM13一起被氧化13提供的C-棕榈酸酯。我们通过在TERT,MYC和HER2 HME细胞中添加13 C-棕榈酸酯后测量柠檬酸盐标记更长的时间(4和8小时)来重复代谢通量分析。到8小时时,MYC HME细胞中22%的柠檬酸盐池被13 C-棕榈酸酯标记,而TERT或HER2 HME细胞中6%柠檬酸盐池被标记(补充图 S1d)。对于其他TCA循环中间体,包括α-酮戊二酸和苹果酸,也测量了相似的标记模式(补充图 S1e,f)。这些结果表明,MYC表达足以在人乳腺细胞中诱导FAO。
13 C示踪剂研究中最引人注目的发现之一是MYC HME细胞显示13 C标记的谷氨酰胺对柠檬酸盐的标记明显更高,表明谷氨酰胺碳进入TCA循环的通量很高(图 1f和补充图 S1g)。 。已有充分的文献证明MYC诱导了谷氨酰胺酶表达的上调33,我们发现线粒体定位的谷氨酰胺酶2(GLS2)的表达以MYC依赖性的方式在MYC和T58A HME细胞中被上调(补充图 S1h))。有趣的是,TERT和MYC HME细胞之间的谷氨酰胺摄取没有差异。然而,MYC HME细胞中的谷氨酸外排明显较低(补充图 S1i,j)。较低的谷氨酸外排量将与我们的更高的GLS2表达和更高的谷氨酰胺碳通入TCA循环的观察结果相符。总而言之,这些发现可能表明,TERT HME细胞更依赖于另一种代谢途径来产生ATP,而事实上,我们发现,TERT HME细胞消耗的葡萄糖略多,分泌的乳酸更多,这表明丙酮酸可能会转移为乳酸而不是TERT HME细胞中的线粒体(补充图 S1k,l)。我们还使用Seahorse生物分析仪测量ECAR,作为研究从TERT和MYC HME细胞分泌乳酸的替代方法(补充图 S1m)。这种独立的方法表明,与MYC HME细胞相比,TERT HME细胞的ECAR略高。重要的是,MYC HME细胞的TCA周期中棕榈酸酯和谷氨酰胺的通量增加似乎不是由于MYC HME细胞中存在更多的线粒体,因为四种HME之间的线粒体绿色标记或线粒体DNA含量没有差异细胞系(补充图 S1n–p)。
MYC HME细胞富含脂肪酸代谢基因,并具有指示脂肪酸摄取的磷脂谱
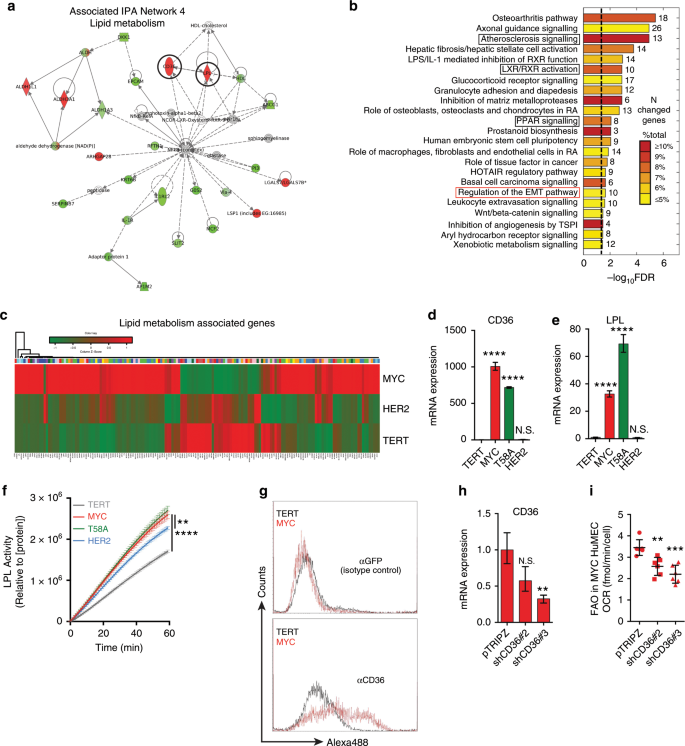
建立了同基因HME细胞系的TNBC模型系统并显示MYC表达足以诱导HME细胞中的FAO,我们接下来想要确定可能有助于MYC HME细胞激活FAO的新靶标。由于MYC是转录因子,因此我们对TERT,MYC和HER2 HME细胞进行了NextGen RNA测序,以进一步了解MYC如何影响HME细胞中FAO的潜在机制(补充表 S1和S2)。将差异表达的基因定位到Ingenuity数据库中可用的网络。根据IPA产生的网络得分,确定了五个网络并对其进行了排名,范围从30到45(补充表 S3)。该分数考虑了差异表达基因的数量(FDR <5%)和网络的大小,以近似网络与原始基因列表的相关性。MYC HME细胞中与代谢相关的唯一网络是“脂质代谢”(IPA网络4),其成分如图2a所示 。IPA还表明,MYC HME细胞中某些最显着改变的经典信号通路(377个基因; FDR <5%;最小倍数:6.81)与脂质代谢有关,包括动脉粥样硬化信号,LXR / RXR激活和PPAR信号(图 2b,黑框)。163个不同基因的无偏列表的基因表达分析(补充表 S4)与跨TERT,MYC和HER2 HME细胞的脂质代谢有关,显示出MYC相对于TERT的上调显着丰富(是所有上调基因的1.4倍,Fisher Exact Test测得p = 5×10 -8)。这些基因的显着功能与脂质转运,酰基辅酶A代谢,线粒体β-氧化和脂肪酶有关。我们的发现与Camarda等人的观点一致。他还报道了TNBC患者中脂肪酸代谢基因的重要表现。10
MYC HME细胞中脂质代谢基因网络的相互作用图。巧妙路径分析用于创建交互图。黑色圆圈突出显示脂质代谢基因CD36和LPL。b根据RNA测序数据(377个基因; FDR <5%;最小倍数变化:6.81),得出MYC与TERT HME细胞中最常见的信号通路。独创性途径分析用于鉴定途径。黑框突出显示与脂质代谢有关的基因本体。每个条旁边的值代表指示信号转导途径内已改变基因的数量。条形图的颜色表示该途径中差异调节的基因百分比。黑色虚线表示显着性(FDR <5%)。C热图显示了与TERT,MYC和HER2 HME细胞中的脂类代谢相关的163个基因的相对表达(在MYC HME细胞中所有上调的基因中占1.4;Fisher Exact Test测得p = 5×10 -8)。这些基因的显着功能与脂质转运,酰基辅酶A代谢,线粒体b氧化和脂肪酶有关。d,ê在HME细胞系CD36和LPL mRNA表达的qRT-PCR分析; n = 3个独立实验。所有值均相对于β-肌动蛋白,并相对于TERT HME细胞标准化。条形图表示带有上限和下限的平均值;使用不成对的学生t检验计算p值。F测量HME细胞裂解物中LPL的活性;n = 4个独立实验。误差棒代表平均值±sd;使用不成对的学生t检验计算p值。g TERT(灰色)和MYC(红色)HME细胞中CD36表面表达的流式细胞仪分析。来自n = 2个独立实验的代表性直方图。αGFP(IgG)被用作同种型对照(顶部直方图)。h MYC HME细胞+ pTRIPZ,MYC HME细胞+ shCD36#2和MYC HME细胞+ shCD36#3中CD36的相对mRNA表达。用0.5μg/ ml强力霉素处理细胞48小时,以诱导shRNA表达。ñ = 3个独立实验。误差线代表具有上限和下限的平均值;使用不成对的学生t检验计算p值。我 MYC HME细胞的基底OCR + pTRIPZ,MYC HME细胞+ shCD36#2和MYC HME细胞+ shCD36#3。在存在0.10 mM棕榈酸酯的情况下测量OCR之前,用强力霉素处理细胞以诱导shRNA表达。n = 5个独立实验。误差棒代表平均值±平均值的标准误差(sem);p值是使用普通的单向方差分析和Tukey多重比较检验计算得出的;* p <0.05,** p <0.01,*** p <0.001,**** p <0.0001,NS =不显着。
接下来,我们进行了脂质组学分析,结果表明,与TERT细胞相比,磷脂酰胆碱(PC)和心磷脂含有更长,更多的不饱和脂肪酰基链(补充图 S2a,b),这种模式通常在细胞中更加依赖于脂肪酸的摄取比从头脂肪酸合成。19,34个这些结果也同意“动脉粥样硬化的信令”(图的预测激活 2B),具有增强的脂质摄取密切相关的过程。此外,MYC HME细胞含有更多的脂质分解产物,例如单酰基甘油(MAGs)和游离脂肪酸(FFA),但三酰基甘油(TAG)少25%,这是细胞的主要脂质存储分子(补充图) 。 S2c)。总体而言,我们的转录组学,生物信息学和脂质组学结果表明,MYC HME细胞不仅可以清除脂肪酸来存储为TAG,还可以积极地代谢它们。
MYC促进HME细胞中的脂肪酸摄取和脂肪酶活性
我们对确定可能涉及TNBC粮农组织的潜在新目标感兴趣。因此,我们研究了哪些特定基因显示最大的上调,并且与IPA网络4和动脉粥样硬化信号转导的典型信号转导通路相关。脂肪酸转运蛋白CD36(> 800倍上调)和LPL(> 80倍上调)是MYC HME细胞中两个最高上调的脂肪酸代谢基因(图 2a,b和补充表 S1)。我们证实了通过qRT-PCR在MYC和T58A HME细胞系中CD36和LPL的上调(图 2d,e)。LPL的生理功能是催化血液中存在的TAG释放脂肪酸。然后可以通过脂肪酸转运蛋白如CD36清除释放的脂肪酸。总之,MYC HME细胞中LPL和CD36的显着上调表明它们可能参与MYC HME细胞中脂肪酸的动员和消耗。与TERT或HER2 HME细胞相比,MYC HME细胞具有明显更高的脂肪酶活性(图 2f)。我们通过流式细胞术证实了MYC HME细胞中脂肪酸转运蛋白CD36的表面表达(图 2g)。然后,我们使用延时荧光显微镜在BODIPY标记的十二烷酸(BODIPY-C12)孵育的TERT和MYC HME细胞上测量了脂肪酸的摄取。与TERT HME细胞(补充影片S1和S2)相比,MYC HME细胞显示出更高的BODIPY-C12摄取 。
通过CD36吸收脂肪酸可支持粮农组织在MYC HME细胞中
我们预测CD36介导的脂肪酸摄取可能与MYC HME细胞氧化脂肪酸的能力有关。我们生成了表达两个不同的针对CD36的TetON诱导型shRNA的MYC HME细胞稳定池(图 2h)。shRNA介导的CD36表达的沉默抑制MYC HME细胞中的FAO,这表明CD36是线粒体中氧化预定脂肪酸的主要贡献者(图 2i)。
多项研究表明,线粒体定位的肉碱酰基转移酶(例如CPT1A和CPT2)是粮农组织在乳腺癌中的重要调节剂,对乳腺癌的生长至关重要。10,35,36相比,TERT和HER2(补充图MYC和T58A HME细胞具有约2倍的增加在CPT mRNA表达 S2d的,E)。基于LC-MS的代谢组学分析表明,MYC和T58A HME细胞还具有较高的肉碱摄取量,肉碱是CPT1A的底物,也是将长链脂肪酸导入线粒体的必需氨基酸(补充图 S2f)。接下来,我们测量了乙酰肉碱的水平和标签,乙酰肉碱是与粮农组织密切相关的代谢产物,其存在的增加表明粮农组织活跃。37,38乙酰基-肉碱是从乙酰-CoA在由酶肉碱乙酰线粒体合成。由于乙酰肉碱是无法进一步代谢的“最终产品”,因此只能转化回乙酰辅酶A。因此,在测量乙酰肉碱合成时,必须考虑细胞中乙酰肉碱的总含量。尽管TERT和MYC HME细胞在使用燃料进行乙酰肉碱合成方面存在差异,但是当我们将13 C-葡萄糖,13C-棕榈酸酯和13 C-胍胺,MYC HME细胞(16.46%)和TERT HME细胞(16.74%)之间没有差异(补充图 S2g–i)。但是,我们确实发现,MYC HME细胞中线粒体乙酰肉碱的总水平是TERT HME细胞的4倍以上(补充图 S2j-1),这表明MYC HME细胞中乙酰肉碱的产生率要高得多。 。此外,我们从MYC和T58A HME细胞中检测到乙酰肉碱向培养基的外排,但从TERT和HER2 HME细胞中未检测到,这进一步证明了粮农组织在MYC HME细胞中具有高活性(补充图 S2m)。总体而言,这些结果表明MYC导致HME细胞中脂肪酸摄取增加,肉碱摄取增加以及FAO升高,并确定CD36是MYC HME细胞中脂肪酸摄取和氧化的潜在介质。
CAMKK2使MYC HME细胞中的AMPK磷酸化
CD36和CPT1A和CPT2分别在质膜和线粒体内膜上增加脂肪酸导入机制的表达,这促进了MYC HME细胞摄取和FAO的增加。但是,调节FAO的主要机制之一是通过5'-AMP活化的蛋白激酶(AMPK)依赖性的乙酰辅酶A羧化酶(ACC)磷酸化。ACC生产丙二酰辅酶A,一种有效的CPT1A抑制剂。因此,AMPK磷酸化对ACC的抑制作用减轻了CTP1A对刺激FAO的抑制作用。Camarda等。研究表明,与受体阳性乳腺癌相比,TNBC的脂肪酸合酶(FASN)和ACC的表达较低,而这种较低的表达与预后较差有关。10尽管我们没有观察到MYC HME细胞中FASN或ACC的下调,但是我们确实发现MYC表达导致HME细胞中AMPK磷酸化增加(图 3a和补充图 S3a)。AMPK通常响应营养胁迫(例如AMP:ATP比的增加)而被磷酸化。但是,代谢组学分析表明,TERT和MYC HME细胞之间的AMP,ADP和ATP浓度没有差异,排除了ATP应激在AMPK磷酸化中的作用(补充图 S3b)。
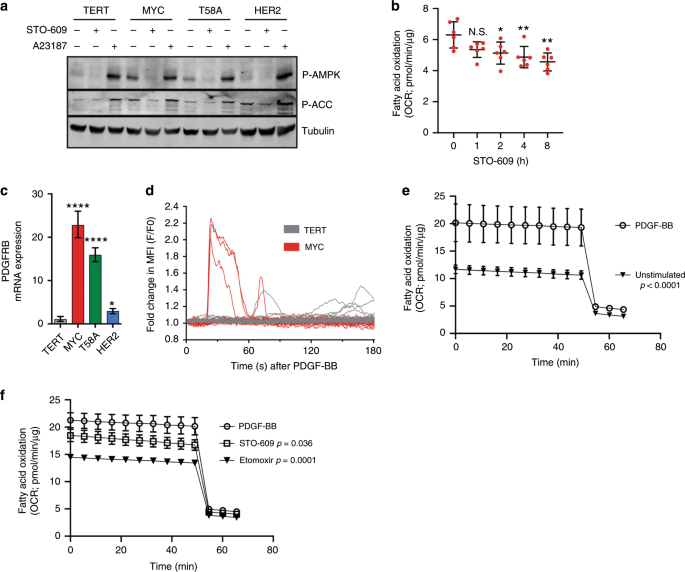
一个抑制CAMKK2的后P-AMPK和P-ACC表达STO-609(10μM)或CAMKK2的刺激由CA激酶活性2+离子载体A23187(1μM)。b在STO-609(10μM)中预孵育后,MYC HME细胞的基础OCR。在存在0.10 mM棕榈酸酯的情况下测量OCR; 来自一个独立实验的n = 5个重复。误差棒代表平均值±sem;使用普通的单向方差分析和Tukey的多重比较测试计算p值。c HME细胞中PDGFRB的相对mRNA表达使TERT标准化并相对于β-肌动蛋白;n = 3个独立实验。误差线代表具有上限和下限的平均值;p使用不成对的学生t检验计算值。d PDGF-BB处理后,TERT和MYC HME细胞中细胞内[Ca 2+ ]的倍数变化。迹线代表每个细胞系的单个细胞。e在不存在(未刺激)和存在25 ng / ml PDGF-BB的情况下,MYC HME细胞的基础OCR。所有OCR测量均在0.10 mM棕榈酸酯存在下进行;n = 5个重复。误差棒代表平均值±sem。基于每个样品的曲线下面积计算总耗氧量。使用ANOVA和事后多重比较比较各组之间的总耗氧量平均值。报告了未调整的p值。F经STO-609(10μM)或依托莫司(40μM)处理后,MYC HME细胞的基础OCR。所有OCR测量均在0.10 mM棕榈酸酯存在下进行;n = 5个重复。误差棒代表平均值±sem。基于每个样品的曲线下面积计算总耗氧量。使用ANOVA和事后多重比较比较各组之间的总耗氧量平均值。报告未调整的p值;* p <0.05,** p <0.01,*** p <0.001,**** p <0.0001,NS =不显着。
还有第二种已知的AMPK激酶,称为钙(Ca 2 +)/钙调蛋白激活的激酶激酶2(CAMKK2),可以以Ca 2+ /钙调蛋白(CaM)依赖性方式磷酸化AMPK 。39我们观察到MYC和T58A HME细胞中CAMKK2 mRNA和蛋白表达增加了约2倍(补充图 S3c,d)。用药理抑制剂(STO-609)抑制CAMKK2或siRNA介导的CAMKK2沉默会强烈抑制MYC和T58A HME细胞中的AMPK磷酸化(图 3a和补充图 S3e)。相反,使用Ca 2+离子载体(A23187)激活CAMKK2 会导致AMPK磷酸化的强劲增加(图 3a))。总而言之,这些发现表明AMPK的激活独立于能量应激而发生,并由MYC HME细胞中的CAMKK2调节。重要的是,STO-609导致MYC HME细胞中FAO的时间依赖性降低,从而表明CAMKK2活性有助于促进FAO(图 3b)。
通过CAMKK2传递的Ca 2+信号有助于促进粮农组织
当Ca 2+与CaM结合时,它会增加CaM对CAMKK2的亲和力。Ca 2+结合的CaM与CAMKK2的结合诱导CAMKK2的自磷酸化和完全活化。因此,我们探讨了Ca 2+在CAMKK2激活中的重要性,并发现BAPTA-AM 螯合细胞内Ca 2+会导致AMPK的磷酸化降低,这表明Ca 2+信号参与了AMPKK的CAMKK2依赖性磷酸化(补充图 S3f)。该结果还表明MYC HME细胞可能已经改变了Ca 2+信号传导。为了进一步研究,我们比较了Ca 2+通过预加载细胞内Ca 2+指示剂Fluo-4和笼状IP 3来在TERT和MYC HME细胞中发出信号。笼中的IP 3是惰性的,直到发出紫外线(UV)脉冲以释放IP 3为止,然后可以比较IP 3诱导的TERT和MYC HME细胞中Ca 2+的释放。在MYC HME细胞中,响应IP 3解封释放的Ca 2+释放速度非常快,并且发生得如此之快,以至于它被埋在UV脉冲的闪光伪像中(补充图 S3g)。然后,我们量化了从解开到Ca 2+的最大峰值一半的时间释放并发现MYC HME细胞对IP 3的反应较之于TERT 细胞迅速,后者表现出明显的延迟(补充图 S3g,h)。
笼式IP 3实验表明MYC HME细胞中细胞内Ca 2+处理的变化,因此,我们提取了RNA测序数据以鉴定Ca 2+信号转导的潜在调节剂。我们发现MYC和T58A HME细胞在三种主要Ca 2+转运蛋白上的表达要低得多:Na + / Ca 2+交换蛋白SLC8A1,高尔基体Ca 2+泵ATP2C2和质膜Ca 2+ ATPase ATP2B4(补充图 S3i-k,补充表 S1)。有趣的是,siRNA耗竭MYC导致Ca 2+表达增加转运蛋白提示MYC可以调节Ca 2+的处理,作为其调节细胞代谢的机制的一部分(补充图 S31,m)。
我们还确定了MYC HME细胞中PDGFRB的显着上调(图 3c和补充图 S3n)。PDGFRB是一种受体酪氨酸激酶(RTK),可诱导细胞内Ca 2+释放,并与上皮到间充质转化(EMT),细胞迁移和癌症进展密切相关。40,41为评估PDGFRB的在FAO的活化中的作用,我们加载MYC和TERT HME细胞用钙2+ -结合染料fluo-3和细胞内Ca测量2+响应于“膨化”释放它的配体,PDGF -BB,到细胞上(如先前参考文献42中所述)。在响应的MYC HME细胞中(3/18),胞质Ca 2+浓度([Ca 2+ ] c)显着增加,平均倍数变化为2.16±0.12(图 3d)。我们还注意到,最初的响应者之一显示出第二个[Ca 2+ ] c峰,表明Ca 2+释放发生振荡(图 3d)。响应(5/29)的TERT HME细胞显示出较晚的时间(从60 s起),[Ca 2+ ] c适度上升(1.32±0.11)(图 3d)。总体而言,TERT HME细胞对PDGF-BB的反应迟缓,而MYC HME细胞的Ca 2+ 对PDGF-BB刺激的反应更快,更高,持续更长的时间。
接下来,我们测试了PDGFRB刺激是否能够在MYC HME细胞中促进FAO。在存在或不存在PDGF-BB的情况下,MYC HME细胞的1小时预孵育证明PDGFRB信号传导会导致FAO的大量增加(图 3e)。PDGF-BB诱导的FAO可被STO-609或依托莫司抑制(图 3f)。预培养1小时后,没有生长因子的STO-609处理对FAO并无实质性影响(图 3b),表明该影响是针对PDGFRB反应的。在没有生长因子的情况下使用依托莫昔治疗抑制了FAO(补充图 S3o); 但是,这是可以预期的,因为在没有刺激的情况下,这些细胞可能会在一定程度上参与粮农组织的工作。有趣的是,当我们用EGF刺激不同的RTK,EGFR时,也可以看到这些结果(补充图 S3p,q)。总之,这些结果表明,RTK介导的Ca 2+释放以及随后对CAMKK2的刺激是表达MYC的HME细胞可以促进FAO的一种方式。
CAMKK2抑制对MYC HME细胞具有细胞生长抑制作用和细胞毒性作用
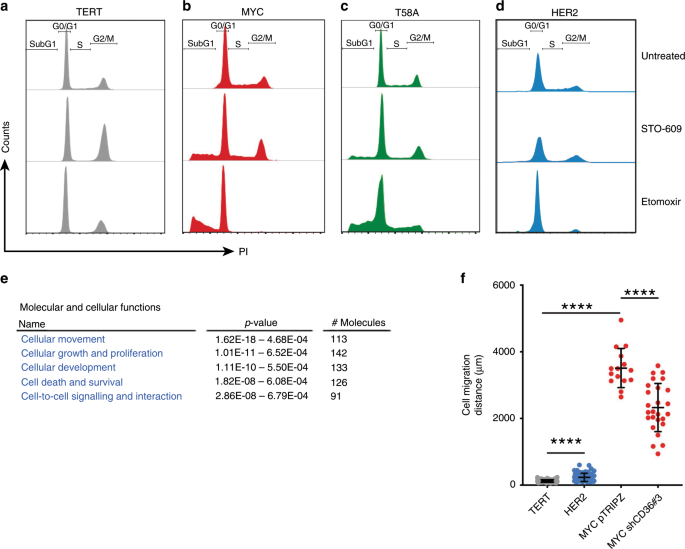
接下来,我们要确定抑制CAMKK2信号传导对MYC HME细胞增殖和存活的长期影响。STO-609在MYC和T58A HME细胞中引起了细胞抑制作用,这在细胞周期的S期和G2 / M期细胞百分比降低中得到了证明(图 4a-d和补充图 S4a)。STO-609还导致15-20%的MYC HME细胞死亡(图 4a-d和补充图 S4a)。)。Etomoxir是一种有效的FAO抑制剂,在MYC和T58A HME细胞中引起大量细胞死亡。相反,对STO-609的反应,TERT和HER2 HME细胞几乎没有细胞死亡。然而,细胞周期的S期减少而G2 / M期增加。除了减少S期细胞百分比外,TERT和HER2 HME细胞在很大程度上不受埃托莫昔治疗的影响。
a-d用STO-609(10μM)或依托莫司(150μM)处理48 h的HME细胞系的细胞周期分析。数据代表n = 2个独立实验之一。e该表根据补充表S1中的 RNA测序数据和独创性途径分析,突出显示了与TERT HME细胞相比,MYC HME细胞中分子和细胞功能发生了最显着变化 。f在8小时内,TERT,HER2,MYC + pTRIPZ和MYC + shCD36#3 HME细胞移动的总距离;n = 3个独立实验。每个点代表一个单独跟踪的单元。误差棒代表平均值±sem;p使用普通的单向方差分析Tukey的多重比较测试计算值;* p <0.05,** p <0.01,*** p <0.001,**** p <0.0001,NS =不显着。
抑制CAMKK2或CD36强烈降低MYC HME细胞迁移
从之前的BODIPY-C12定时拍摄影片中,我们注意到,与TERT HME细胞相比,MYC HME细胞具有高度迁移性(补充影片 1和2)。另外,IPA预测“细胞运动”是分子和细胞功能的最佳选择(p = 1.62e-18;图 4e)。当我们使用延时显微镜追踪单个细胞的迁移时,我们测得的MYC HME细胞迁移速度与TERT或HER2细胞相比增加了10倍(图 4f)。CD36的耗尽或CAMKK2的抑制显着损害MYC HME细胞迁移(图 4f和补充图 S4b))。这些结果表明CAMKK2和CD36是细胞迁移的重要贡献者。
MYC HME细胞的脂肪酸代谢基因特征是低claudin TNBC的代表
到目前为止,我们已经发现,人乳腺细胞中MYC致癌水平的表达诱导了一个多基因程序,其特征在于RTK信号,细胞内Ca 2+处理,CAMKK2信号,脂肪酸摄取和FAO的变化(补充图 S4c)。接下来,我们试图确定MYC HME细胞的脂肪酸代谢基因标记是否代表乳腺癌的特定分子亚型。由于MYC和T58A HME细胞缺乏ER,PR和HER2表达(图 1a,b),我们预测它们的基因表达模式将最紧密地反映TNBC。对约2000名患者肿瘤样品的METABRIC乳腺癌数据库进行的生物信息学分析表明,MYC确实在克劳丁低(CL)和基底型乳腺癌中表达最高,它们也是TNBCs高度富集的两个亚型(图 5a) 。1,2,23,24然而,CL乳腺癌特别有CD36,LPL的最高表达,和PDGFRB(图 5B-d )。接下来,我们比较了MYC,CD36,LPL和PDGFRB在基底TNBC和CL-TNBC中的表达。尽管我们没有观察到MYC(p = 0.08)或LPL(p 基底-TNBC和CL-TNBC之间的表达= 0.11),我们确实发现CL-TNBC肿瘤具有显着更高的CD36(p <0.0001)和PDGFRB(p <0.0001)表达(补充图 S5a-d)。
来自METBRIC数据库的人乳腺癌患者肿瘤中脂肪酸代谢基因mRNA表达水平(z得分)的a–d盒须图。根据METABRIC数据库调用的乳腺癌PAM50 + claudin-低分子亚型对肿瘤进行分类。克劳丁低(Claudin-low),n = 182;基础,n = 198;HER2,n = 218;发光A,n = 673; 发光B,n = 454; 类法线,n =135。方框代表25%到75%,胡须代表最小值到最大值,而线条代表中位数。使用普通的单向方差分析和Dunnett多重比较测试确定p值。e–h在CL-TNBC中,针对LPL,PDGFRB,PDK4和FABP4的CD36 mRNA表达的散点图。黑线表示散点图的线性回归。Spearman相关性r值和p值记录在图表上。i,j基底性TNBC(j)和CL-TNBC(i)患者的Kaplan-Meier生存图。如结果所述,根据CD36,LPL,PDK4和FABP4的表达对患者进行分层。使用对数秩检验计算p值。危险比(HR)显示在图表上。Ca 2+转运蛋白mRNA表达水平的k–m Box和晶须图(z-分数)在CL-TNBC患者的肿瘤中。如METBRIC数据库所称,将肿瘤分为具有二倍体,拷贝数增加和MYC扩增的肿瘤。方框代表第25至75%,胡须代表最小值至最大值,而线条代表中位数。p值记录在图表上,并使用普通的单向方差分析和Dunnett多重比较测试确定。n CD36 Hi与CD36 Lo CL-TNBC患者肿瘤中Ca 2+转运蛋白mRNA表达水平(z得分)的箱形图和晶须图。方框代表第25至75%,胡须代表最小值至最大值,而线条代表中位数。p值是使用未配对的学生t检验确定的;* p <0.05,** p <0.01,*** p <0.001,**** p <0.0001,NS =不显着。
CD36和LPL(Spearman 0.63; p = 3.29e-12)和CD36和PDGFRB(Spearman 0.55; p = 3.42e-9)之间的表达存在显着相关性,表明这些基因的高表达通常在CL中共同发生-TNBC(图 5e,f)。根据METABRIC数据库,与CD36共表达程度最高的两个基因是丙酮酸脱氢酶激酶4(PDK4; Spearman 0.84; p = 1.73e-17)和脂肪酸结合蛋白4(FABP4; Spearman 0.77; p = 2.27e−21)(图 5g,h)。与CD36相似,与所有其他分子亚型相比,PDK4和FABP4在CL乳腺癌中也高表达,除了正常乳腺肿瘤外。此外,当我们比较基底TNBC与CL-TNBC中PDK4 和FABP4的表达时,我们再次发现CL-TNBC中PDK4(p <0.0001)和FABP4(p <0.0001)的表达明显更高(补充图 S5e– h)。
PDK4是葡萄糖氧化的负调节剂,其磷酸化从而抑制丙酮酸脱氢酶活性。关于PDK4在刺激线粒体FAO中的作用,已有大量文献报道。43,44 PDK4通常被认为是作为葡萄糖氧化和FAO,使得高PDK4活性促进FAO之间的分子开关。[43]有趣的是,已经证明脂肪酸流入和CD36的强制表达能够诱导肌肉中PDK4的表达,这表明两者之间有很强的代谢联系。45降低PDK4的表达会影响乳腺癌的代谢,而高PDK4的表达已表明可以预测乳腺癌患者的生存期较差。46FABP4已显示出可促进脂质从脂肪细胞直接转移至卵巢癌细胞,进而促进体外和体内肿瘤的生长。47最近的一项研究表明,FABP4在CL-TNBC细胞(MDA-MB-231)中的外源表达可增加增殖。48有趣的是,FABP4是8号染色体的相同的臂作为MYC和往往是共扩增与MYC在乳腺癌(补充图 S5i,J)。由于我们使用MYC的外源表达来增加HME细胞中的MYC表达,因此这可以解释为什么在MYC HME细胞中FABP4没有被上调(补充表 S1)。
我们创建了一个由CD36,LPL,PDK4和FABP4组成的“脂肪酸代谢基因标记”,并检查了乳腺癌的每个分子亚型,这些基因的上调或扩增。如果这些基因中的任何一个或组合在肿瘤中上调或扩增,则该患者被分类为“高脂肪酸代谢”。所有这些四个基因均缺乏上调或扩增的患者肿瘤被归类为“低脂肪酸代谢”。接下来,我们测试了这四个基因的脂肪酸代谢基因标记是否仅在TNBC或所有乳腺癌亚型中预测了较差的生存。尽管在所有乳腺癌亚型中CD36,LPL,PDK4和FABP4之间的表达具有一致的相关性(数据未显示),但显示生存期较差的唯一亚型是CL-TNBC(p = 0.0119; HR = 1.92;图 5i,j和补充图 S5k-p)。我们使用脂肪酸代谢基因的特征和年龄进行了Cox回归分析,发现两者都是生存的独立预测因子(数据未显示)。我们的生物信息学分析表明,这组脂肪酸代谢基因以及粮农组织可能与CL-TNBC中更具侵略性的疾病有关,但不一定与TNBC的其他亚型有关(图 5g,h和补充图 S6h–m)。
接下来,我们就在CL-TNBC中MYC基因扩增方面比较了SLC8A1,ATP2C2和ATP2B4的表达。尽管没有达到显着性,SLC8A1和ATP2B4在具有MYC基因扩增的CL-TNBC肿瘤中确实具有较低的表达水平(分别为p = 0.07和p = 0.09)(图 5k,1)。关于在CL-TNBC中的MYC基因扩增,没有注意到ATP2C2的表达差异(图 5m)。然后,我们测试了CD36 Hi肿瘤是否具有较低的Ca 2+转运蛋白表达。我们未在CD36 Hi中检测到Ca 2+转运蛋白表达的任何差异与CD36 Lo CL-TNBC肿瘤相比(图 5n)。
HME细胞中的MYC表达诱导EMT
基底-TNBC和CL-TNBC肿瘤具有相似的MYC表达水平,但CD36,LPL,PDK4和FABP4的表达水平却有很大差异,这一事实表明,除了MYC以外,还有其他因素可以直接激活FAO和脂质代谢。 CL-TNBC。此外,CD36表达和Ca 2+转运蛋白表达之间缺乏相关性也表明MYC可能不会直接调节脂质代谢基因的表达。因此,我们测试了siRNA介导的MYC沉默对CD36,LPL和PDK4表达的影响。敲低MYC可以抑制LPL和PDK4的表达,但不能抑制CD36的表达,这表明MYC HME细胞中CD36表达的另一种调节因子(补充图 S6a-d)。
我们重新检查了CD36潜在调节剂的RNA测序数据。已经表明,通过CD36摄取更多的脂肪酸可以促进肝细胞癌49中的 EMT,而EMT是CL-TNBC的定义特征。29有趣的是,MYC HME细胞中最常见的经典信号传导途径之一是“ EMT途径的调控”(图 2b;红色框)。此外,IPA得分最高的网络是“胚胎和机体发育”(IPA网络1)(补充图 S7a)。IPA网络1建议下调E-钙粘蛋白(CDH1),Wnt信号和FOXF2(补充图 S7a,黑圈)。FOXF2抑制乳腺癌中的EMT,并与EMT激活剂FOXC2成反比。50,51我们使用定量RT-PCR以FOXF2的确认下调和FOXC2的上调(补充图 S7b中,C)。MYC HME细胞还具有其他EMT诱导物(如ZEB1,ZEB2和TWIST1)的高表达(补充图 S6e, S7d,e和补充表 S1)。我们还证实了细胞粘附分子的下调,包括E-钙粘着蛋白(CDH1)和claudin 4(CLDN4),这是CL-TNBC的另一个定义特征(补充图 S7f,g和补充表 S1)。29考虑到MYC HME细胞中存在EMT基因签名,我们假设EMT诱导物可能促进CD36表达。siRNA介导的敲除TWIST1(一种促进EMT的转录因子)使CD36的表达降低了50%,这表明MYC HME细胞中CD36的表达可能与EMT的过程有关(补充图 S6f,g)。TWIST1和CD36的表达在CL-TNBC中高度相关,进一步表明这两个分子可能在功能上相连(补充图 S6h)。
MYC HME细胞具有间充质干状TNBC的许多特征
IPA网络1还建议激活刺猬(Hh)信号(补充图 S7a)。Hh信号在胚胎发生,干细胞更新和EMT中起重要作用。52包括GLI2在内的神经胶质瘤相关癌基因家族是Hh信号的主要转录调节因子。53,54因此,我们重新审视了RNA测序数据,以确定有助于其他基因干细胞样用IPA网络相关表型1.另外MYC本身,我们发现其他乳腺癌干细胞因子(SOX2,SOX18,THY1,EYA1上调,GLI2,SALL1,GLIS1,CXCR4),这表明MYC HME细胞呈茎状状态(补充图 S61-1和补充表 S1))。与此结果一致,MYC HME细胞几乎没有CD24的表面表达,CD24是癌干细胞(也称为肿瘤起始细胞)上通常丢失的表面标记(补充图 S6m)。55,56据报道,CL-TNBC肿瘤与所谓的紧密簇的基因表达谱“间充质干样”肿瘤。间充质干样肿瘤具有高度的去分化能力,claudins的低表达,E-cadherin和CD24的缺失以及与EMT相关的基因(包括PDGFRB和TWIST)的高表达。57此外,已知PDGFR信号传导可在乳腺癌中诱导EMT。58总之,MYC HME细胞中发生的主要转录变化也与CL-TNBC中发生的变化相同。数据还表明,在致癌水平的MYC存在下获得EMT表型可能是粮农组织稳定激活所必需的,并且是将CL-TNBC与基础TNBC区分的区别特征。
CL-TNBC细胞系对STO-609和依托莫司敏感
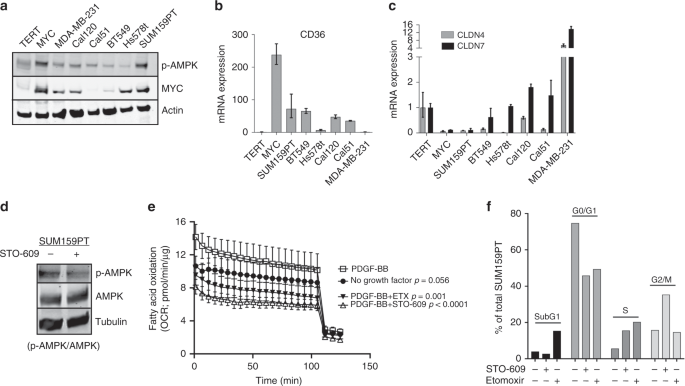
鉴于CL-TNBC和MYC HME细胞之间的相似性,我们分析了一组TNBC细胞系中p-AMPK,MYC,CD36,CLDN4和CLDN7的表达。SUM159PT细胞表达MYC的水平与MYC HME细胞相似,在TNBC细胞系中CD36和p-AMPK的表达最高,并且claudin 4和claudin 7完全丧失(图 6a–c)。用STO-609处理SUM159PT细胞两小时导致p-AMPK水平降低,这表明AMPK的激活以依赖CAMKK2的方式在SUM159PT细胞中发生(图 6d)。我们还看到在另外两个CL-TNBC细胞系中,响应STO-609,AMPK的磷酸化降低(补充图 S8a)。接下来,我们测试了PDGF-BB刺激SUM159PT细胞中的FAO的能力,实际上我们观察到用PDGF-BB处理SUM159PT细胞后,FAO有所增加(图 6e)。增加STO-609或依托莫司可以阻止粮农组织的这种增长。STO-609还导致细胞周期S和G2 / M期的SUM159PT细胞百分比增加,而依托莫司诱导细胞死亡和S期积累(图 6f)。总之,这些结果表明,有可能将CL-TNBC中的粮农组织作为目标。
一个免疫印迹分析在的TNBC细胞系,包括TERT和MYC HME单元的面板MYC和对AMPK的蛋白表达。b,c在一组包括TERT和MYC HME细胞的TNBC细胞系中,CD36(b),CLDN4(c,灰色条)和CLDN7(c,黑色条)的相对mRNA表达。数据是归一化的TERT,相对于β-肌动蛋白;n = 3个独立实验。误差棒代表具有上限和下限的平均值。d STO-609对CAMKK2的抑制作用可抑制CL-TNBC细胞系SUM159PT中AMPK的磷酸化。ËSUM159PT细胞的基础OCR±PDGF-BB(25 ng / ml)刺激并用STO-609(10μM)或依托莫昔(40μM)处理。所有OCR测量均在0.10 mM棕榈酸酯存在下进行;n = 5个重复。误差线表示平均值±标准偏差,基于每个样品的曲线下面积计算总耗氧量。使用ANOVA和事后多重比较比较各组之间的总耗氧量平均值。f使用碘化丙啶进行细胞周期的流式细胞术分析。SUM159PT细胞的细胞周期和细胞存活率(subG1)均受STO-609(10μM)抑制CAMKK2和依托莫昔(150μM)阻断FAO的影响。报告未调整的p值;n = 1个独立实验。
讨论区
最近的研究突出了粮农组织在TNBC增长中的作用,并建议以FAO为目标可能对TNBC患者有益。10,13,14,59粮农组织在TNBC激活已被链接到致癌基因的过度表达MYC,和以前的研究已经表明,MYC的抑制通过使线粒体功能障碍增加在肿瘤中脂滴的形成。10,60,61然而,机械基础由MYC提神粮农组织TNBC仍然难以实现。因此,我们着手深入了解MYC如何调节TNBC中脂肪酸的进口和氧化。
我们发现,通过激活和清除脂肪酸的LPL和CD36的上调促进了FAO的激活。MYC HME细胞消耗了大量的肉碱,并大量储存了乙酰肉碱,这是粮农组织的高能副产品。我们还发现,与TERT HME细胞相比,MYC HME细胞中两种主要的线粒体燃料来源(即谷氨酰胺和脂肪酸)的总体代谢通量更高。CD36促进脂肪酸摄取的增加,与PDK4介导的丙酮酸脱氢酶的抑制作用相结合,将促进FAO的生长并抑制葡萄糖的氧化。因此,PDK4对葡萄糖氧化的抑制作用使CL-TNBC细胞能够利用脂肪酸来促进线粒体乙酰辅酶A的产生,从而可能为其他生物合成途径节省丙酮酸和上游糖酵解中间体。
根据我们的发现,我们还建议从内部存储中释放Ca 2+可以刺激CAMKK2和AMPK的活化,从而进一步促进粮农组织的发展。我们建议RTK,如PDGFRB和EGFR,都在TNBC中高表达,它们激活细胞内Ca 2+的释放。但是,也可能涉及其他RTK或G蛋白偶联受体。MYC还可以通过抑制Ca 2+转运蛋白的表达来进一步增强Ca 2+信号传导,从而损害细胞有效地从细胞质中输出Ca 2+的能力。MYC诱导的质膜Ca 2+泵ATP2B4的下调确实影响了Ca 2+B细胞外排,并与B细胞的增殖和分化有关。62我们的研究首次表明MYC抑制Na + / Ca 2+交换子SLC8A1。Na + / Ca 2+交换子SLC8A1的下调与阴茎癌中的逃避细胞凋亡有关。63我们的结果强调,需要进一步研究离子通道和Ca 2+信号传导对癌症代谢的影响。
在AMPK磷酸化增加骨肉瘤细胞在MYC的诱导发生64和说明Ca最近的一份报告2+信号传导参与NUAK1,所述AMPK相关激酶家族的一个成员的MYC相关活化。65此外,CAMKK2在前列腺癌(MYC高表达的癌症)中被上调并磷酸化AMPK。66,67,68,69 ChIPseq分析表明MYC结合到CAMKK2启动子区。70我们发现抑制CAMKK2阻止AMPK磷酸化,抑制PDGF诱导的FAO,并引起MYC HME细胞和SUM159PT CL-TNBC细胞的细胞生长抑制作用和细胞毒性作用。由STO-609引起的细胞周期分布变化表明,除了刺激FAO之外,可能还有其他CAMKK2功能控制细胞周期。为了支持该概念,已显示siRNA介导的前列腺癌细胞中CAMKK2表达的沉默可增加G1期细胞的百分比。71
MYC和TERT HME细胞具有相似的增殖速率(数据未显示),但是MYC HME细胞的细胞迁移速度比TERT HME细胞高> 10倍。我们提出,MYC表达诱导的新陈代谢状态的增强能够满足高度迁移和高度增殖细胞的高能量需求。试图推测MYC通过“劫持” Ca 2+信号作为在其他养分充足条件下激活AMPK的手段来完成这项任务。通过使用Ca 2+为了激活AMPK,MYC HME细胞产生代谢应激的假饥饿状态。AMPK随后将进一步刺激包括粮农组织在内的多种代谢途径。能量生产的这种增长将通过支持细胞迁移过程中对能量的需求过程而为TNBC提供一个优势,同时还使癌细胞能够满足生物量和增殖对能量的需求。实际上,我们发现抑制CD36或CAMKK2减少了细胞迁移。
我们设想,迁移的细胞需要高水平的能量产生,而CD36介导的脂肪酸摄取是粮农组织可以提供的。我们的脂质组学分析表明,MYC HME细胞吸收的脂肪酸也正在用于脂质生物合成,这表明CD36也可能有助于膜的生物发生。与伪足延伸和细胞表面投射相关的膜重塑的复杂性仍存在争议,需要进一步研究以阐明位于迁移和侵入细胞前沿的磷脂类型和组成的确切变化。72有趣的是,CD36是新兴的代谢靶标,已被认为对于口腔鳞状细胞癌的细胞迁移,侵袭和转移至关重要,73胃癌,74和卵巢癌。75我们的结果也与一项研究相吻合,该研究表明,脂肪细胞中脂肪酸的动员可促进乳腺癌的侵袭。76 FABP4在乳腺癌中经常与MYC共同扩增,并且几乎总是与CD36高度共表达,被证明对于卵巢癌转移至网膜脂肪垫并在其中支持脂肪酸运输和FAO至关重要。47
也许从我们的研究中得出的最有趣的发现是,CL-TNBC的CD36,LPL,PDGFRB,FABP4和PDK4的表达要比包括基础TNBC在内的所有其他乳腺癌高得多。考虑到这些脂肪酸代谢基因与FAO之间的关联,我们建议CL-TNBC患者有可能从靶向FAO中获得最大收益。目前临床上尚无常规的诊断CL乳腺癌的诊断工具,而基因表达谱分析仍是TNBC分子亚型化的金标准。77因此,CL乳腺癌在临床上通常被更广泛地归类为TNBC,而CL乳腺癌患者则不存在针对性疗法。78 临床上已经在努力更好地诊断CL乳腺癌,并且很有趣的发现脂肪酸代谢基因可能成为CL乳腺癌的标志物。
我们的研究还支持抑制我们研究中确定的一个或多个替代性粮农组织目标(例如CAMKK2和CD36)的理论依据。靶向CAMKK2与CD36的结合可能在两个不同的方面影响FAO,这些靶标在细胞周期调控和膜生物发生中的次要功能也可能进一步带来益处。总体而言,我们的研究对TNBC与FAO之间的联系有更深入的了解,并表明MYC促进了一个多基因计划,该计划大大改变了乳腺细胞的行为和代谢。
我们的发现可能会影响CL-TNBC以外的乳腺癌治疗。例如,已经提出,不管最初的乳腺癌亚型如何,在化学疗法或内分泌疗法后残留的癌细胞(即复发的肿瘤)在很大程度上都具有CL乳腺癌的特征。79此外,有趣的是,许多乳腺癌小鼠模型最终都采用了CL乳腺癌特征。80,81的一个例子是在乳腺肿瘤的小鼠导致肿瘤消退MYC表达的失活,但许多这些肿瘤的最终复发。81这些复发性乳腺肿瘤的无监督基因聚类分析表明,丰富了CL基因标记,而CL基因标记在原发肿瘤中是完全不存在的。同样,在MMTV-MYC模型中出现的约20%的肿瘤采用EMT /鳞状肿瘤表型,该表型与低克劳定的乳腺癌高度相似。80但是,这种现象并非MYC驱动的模型独有。复发性Neu诱导(即HER2 +)乳腺肿瘤也表现出EMT表型。82 因此,迫切需要确定CL乳腺癌的新治疗机会,这不仅是因为它是一种尚未被广泛了解的分子亚型,而且还因为其基因表达模式高度代表了人类中大部分耐药和复发性肿瘤乳腺癌患者。
我们的生物信息学分析揭示了上述小鼠研究与MYC HME细胞之间的惊人相似之处。MYC HME细胞采用CL-TNBC基因签名,但有趣的是,许多与EMT相关的基因不受MYC的直接调控(即CD36,ZEB1,ZEB2,PDGFRB等)。越来越明显的是,癌细胞可以独立于致癌基因启动事件(即MYC激活)而进化和生长。81,83我们目前的假设是,MYC建立从该高度转化的和抗性细胞出现的背景。MYC产生这种有益细胞状态的确切机制仍不清楚,但可能涉及Ca 2+信号传导的长期失调,62microRNA表达改变,84或表观遗传重编程。85人们已经注意到,通过下调Ca 2+转运蛋白来扩增Ca 2+信号传导是其他癌症类型(包括淋巴瘤Eμ- myc模型)中潜在的肿瘤促进机制。62,63
总体而言,使用我们基于细胞的模型,我们能够发现在CL乳腺癌中普遍存在的脂肪酸代谢途径中的新靶标,并与患者存活率低显着相关。我们预测,脂肪酸的摄取和氧化是细胞迁移的关键代谢过程,也是CL-TNBC中脂肪酸代谢基因签名盛行的驱动力。未来的研究将研究在CL-TNBC中靶向脂肪酸代谢的治疗潜力,以及高脂饮食和肥胖如何影响脂肪酸代谢和肿瘤进展。关于生长因子信号传导,Ca 2+信号传导和新陈代谢之间的串扰,还有许多要学习的知识。众所周知,许多线粒体脱氢酶和转运蛋白都含有钙2+结合位点和EF手基序; 然而,Ca 2+信号转导在癌症线粒体功能中的作用尚待探索。
|
|