MicroRNA-27a / b是小的非编码RNA,据报道可调节炎症反应和细胞增殖。尽管一些研究表明,口腔扁平苔藓(OLP)患者的口腔标本中miR-27b被下调,但miR-27b减少的分子机制仍然是一个谜,而且miR-27a在OLP中的表达没有很好的探索。在这里,我们证明与健康对照组相比,miR-27a和miR-27b在从OLP患者获得的口腔活检,血清和唾液样本中均减少了。在脂多糖(LPS)或活化的CD4 + T细胞治疗的人口腔角质形成细胞(HOKs)中也证实了miR-27a / b的降低。此外,我们在miR-27a / b的启动子中发现了维生素D受体(VDR)结合位点基因并验证了这一发现。我们还测试了经paricalcitol治疗的维生素D缺乏或VDR基因敲除小鼠的口腔上皮中的miR-27a / b水平。在救援实验中,我们证实了维生素D和VDR抑制了HOKs中LPS或活化的CD4 + T细胞诱导的miR-27a / b降低。总之,我们的结果表明维生素D / VDR信号在口腔扁平苔藓中诱导miR-27a / b。
介绍
口腔扁平苔藓,看作是一种慢性粘膜皮肤炎性病症,被认为是在一个共同的共识潜在恶性疾病之一1。它影响约2%的成年人口,女性患病率更高2。尽管已经进行了大量研究并取得了很大进展,但是OLP的发病机理仍然是一个谜。很明显,自身免疫反应,感染,精神压力都有助于OLP萌生和发展3,4。在临床中,即使在进食过程中,患有OLP的患者也经常出现疼痛,刺激和烧灼感等症状3。OLP的组织病理学特征包括固有层中典型的T细胞浸润带。角化过度,上皮层细胞样体和水样变化3。到目前为止,OLP似乎是无法治愈的疾病,大多数临床工作都集中在炎症控制和症状减轻3上。因此,迫切需要研究OLP的发病机理并寻找治愈的方法。
微小RNA(miRNA)是一组小的非编码RNA,通过与它们的3'UTR相互作用5抑制目标mRNA的表达。在已发表的研究中,miRNA被报道发挥炎症,代谢和发育的生物学功能的6,7,8,9,10,11。在OLP领域,许多研究都把种miRNA作为生物标志物的疾病进展和恶变12,13。蜂窝的miRNA-27在整个各种组织和细胞类型的无所不在表达并且是高度保守的14,15。迄今为止中,miR-27的功能研究大多集中在免疫系统和细胞增殖在10,11,14,15,16,17。一对夫妇的研究,在OLP患者口腔活检在OLP的情况下,的miR-27B据报道,下调2,18。然而,miR-27a在OLP中的表达尚不清楚,并且对miR-27a / b减少的机制也没有很好的解释。鉴于此,在OLP中使用miR-27a / b将有助于我们更好地了解OLP的原因。
维生素D是一种多效激素,在广泛的生物学活动中起着至关重要的作用19。在肾脏中合成的维生素D的活性形式称为1,25-二羟基维生素D [1,25(OH)2 D 3 ] 20。1,25(OH)2 D 3通过与维生素D受体(VDR)21相互作用来发挥其调节作用。维生素D / VDR信号被证实在炎症性疾病中具有调节功能22。我们已经报道维生素d / VDR信令在从OLP患者的口腔活检或血清样品抑制23,24。此外,先前的研究也表明,这种信号抑制的miR-802和缺氧诱导因子1α(HIF-1α),以改善细胞凋亡和在HOKs炎症反应25,26,这表明OLP其保护作用。在这项研究中,我们证实miR-27a / b在OLP患者的口腔活检,血清和唾液样本中被下调,并且维生素D / VDR信号传导可以诱导OLP中miR-27a / b的表达。
方法与材料
人体样本
在山西医科大学附属口腔医院,从健康个体和OLP患者那里采集颊黏膜活检,血液和唾液样本。参加者保留智齿拔出而无任何可见的颊部炎症被分类为健康对照。OLP鉴定和入选标准的基础上修改的世界卫生组织(WHO)的诊断标准设置27,28。参与本研究的所有参与者均签署了书面知情同意书。该调查得到山西医科大学伦理委员会的批准。所有方法均按照相关指南和规定执行。在先前的研究中提供了有关OLP患者的更多信息23。
动物研究
通过实验选择了具有野生型背景的8周龄C57BL / 6小鼠。通过腹膜内注射每天向野生型小鼠施用维生素D类似物paricalcitol(300 ng / kg),持续一周。对于建立维生素D缺乏症模型,如断奶前所述,将小鼠在断奶后立即置于黑暗的房间中,并喂食缺乏维生素D或正常饮食的食物,持续8周,如29所述。VDR-/-小鼠是根据先前方法30生成的。收集来自小鼠的口腔上皮细胞以分离蛋白质和miRNA。动物研究的所有方案均已获得山西医科大学伦理委员会的批准。所有方法均按照相关指南和规定执行。
细胞培养
将人口腔角质形成细胞(HOK)置于6孔板中,并与含有10%胎牛血清(FBS)和1%青霉素/链霉素(P / S)的口腔角质形成细胞培养基一起培养。两种细胞模型用于体外模拟OLP 。首先,HOS受到LPS(100 ng / ml)的挑战。第二,将来自T细胞培养的上清液(以抗CD3 / 28刺激)以30%的最终体积浓度25添加到HOKs培养基中。对于随时间变化的实验,LPS或活化的CD4 +T细胞分别持续0、4、8、12、24小时。对于其余的细胞模型,除非另有说明,否则将HOK攻击24小时。在另一个实验中,在LPS或活化的CD4 + T细胞处理之前,将HOKs用VDR或对照质粒(4 µg)转染36小时,或用1,25(OH)2 D 3(20 nM)预处理12小时。VDR或空质粒被Lipofectamine 2000(Thermo Fisher Scientific,Waltham,MA)转染。如之前25所述进行T细胞的分离和刺激。
口腔粘膜上皮分离
将人和小鼠的口腔颊组织在冷室中用0.25%的dispase II消化12小时。据报道31使用肌肉钳完成上皮和固有层的分离。
免疫印迹
如先前所述使用Western blot分析32。简而言之,将细胞或组织用laemmli缓冲液溶解,然后在95°C下孵育5分钟。全细胞裂解物通过SDS-PAGE凝胶分离,然后转移到PVDF膜上。第一抗体用于在冷室中孵育膜过夜,然后在室温下进行一小时的第二抗体处理。使用ECL试剂盒(Thermo Fisher Scientific)对条带进行可视化。VDR(sc-13133)和β-actin(sc-47778)抗体均来自Santa Cruz Biotechnology(美国德克萨斯州达拉斯)。
实时PCR
用TRIzol试剂(Invitrogen,Carlsbad,CA)从HOK或口腔颊上皮中提取总RNA,并纯化mRNA。第一链cDNA使用PrimeScript RT试剂盒(TaKaRa,Mountain View,CA)合成,实时PCR使用SYBR Premix Ex Kit(TaKaRa)进行。使用miRNA分离试剂盒(Life Technologies)分离组织和细胞中的miRNA,并根据制造商的说明使用mirVana PARIS试剂盒(Life Technologies)获得血清和唾液中循环的miRNA。相应地,使用特定的miRNA第一链cDNA合成试剂盒(Aidlab Biotechnologies,北京)来完成cDNA合成和实时PCR。转录物的相对量通过2- ΔΔCt进行分析式。对于循环miRNA样品,在提取miRNA之前添加了相同量的外源cel-miR-39,并将其标准化。PCR引物的序列示于表 1。
染色质免疫沉淀(ChIP)分析
根据制造说明书,使用商业试剂盒进行ChIP测定。简而言之,将用VDR或空质粒转染的HOK细胞固定在1%甲醛中,然后用甘氨酸处理以进行中和。将细胞裂解液超声处理,并借助抗体(VDR或IgG)和蛋白A琼脂糖沉淀。洗脱和一系列洗涤后,通过qPCR定量样品。表1中提供了用于ChIP测定的引物 。
统计分析
数据显示为平均值±SD。使用2尾Student t检验分析2 组数据,并通过单因素方差分析分析多组数据。P <0.05被认为具有统计学意义。
结果
miR-27a / b在OLP患者和OLP模型中下调
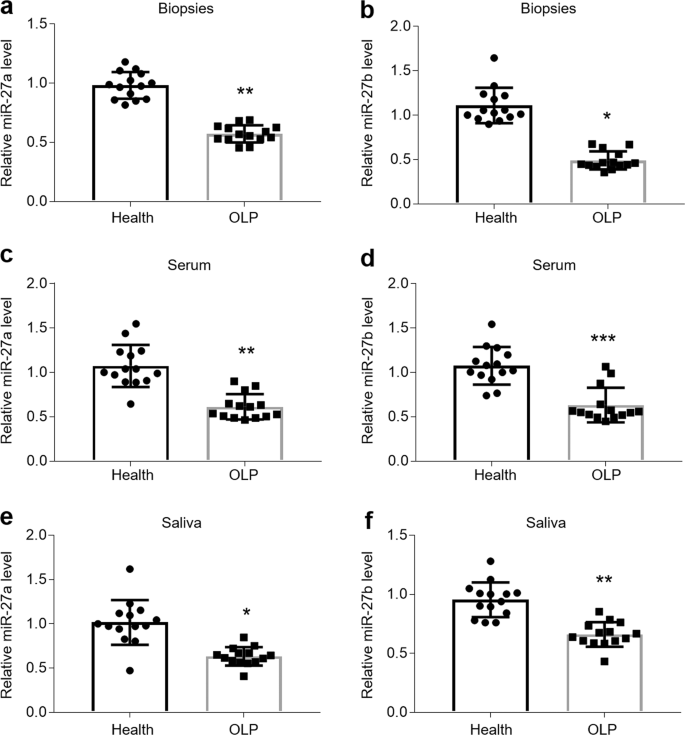
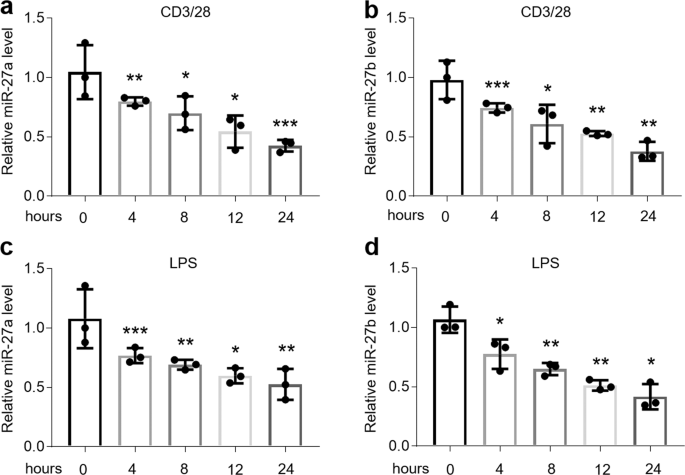
以前的研究已经证明了miR-27b中示出了OLP患者口服活检一个显著减少2,12,18。为了确认miR-27b的表达并利用OLP中的miR-27a,我们收集了个体的口腔上皮,血液和唾液样本以研究miR-27a / b的水平。如图1所示,在 OLP患者的口腔活检组织的上皮层中miR-27a / b降低(图 1a,b)。此外,OLP组的循环miR-27a / b血清水平低于健康对照组(图 1c,d),唾液样本中的水平也是如此(图 1e,f)。由于自身免疫反应和感染都能够诱导OLP,因此可以更好地模仿它在体外,我们用LPS或活化的CD4 + T细胞上清液处理了HOK,以建立OLP模型。不出所料,在两个细胞模型中,miR-27a / b均呈时间依赖性下调(图 2a–d)。在存在LPS或活化的CD4 + T细胞上清液的情况下,被选作阳性对照的TNFα,IL-6和IFNγ也有所增强(补充图 1a–f)。重要的是,LPS或活化的CD4 + T细胞上清液对用于阴性对照的miR-16没有影响(补充图 2a,b)。
VDR与其在miR-27a / b启动子中的元件结合,以增强其在HOK中的表达
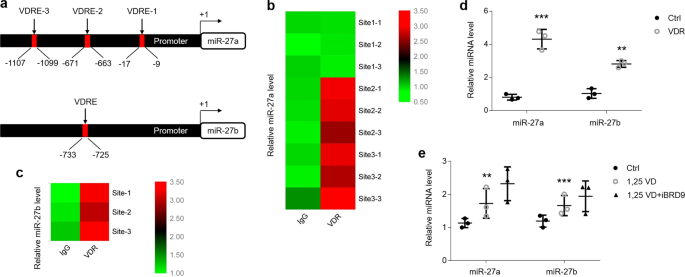
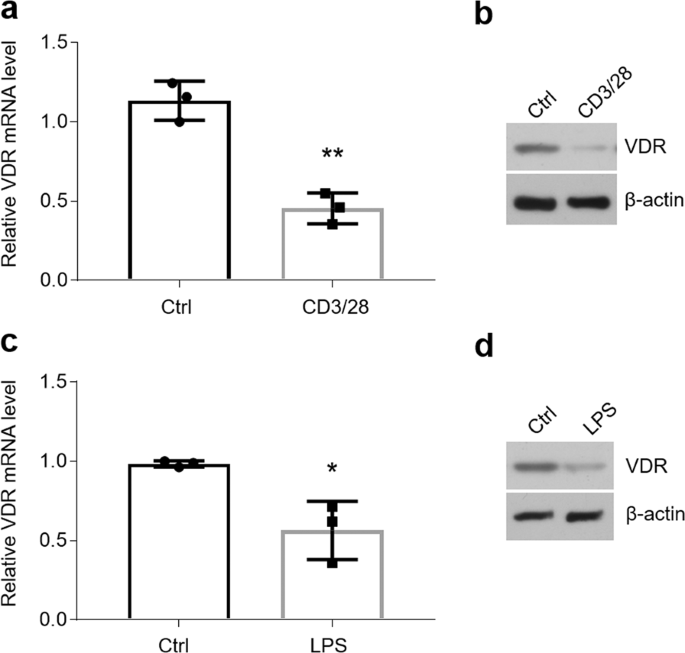
为了确定miR-27a / b在OLP中降低的机制,我们检查了miR-27a / b的启动子,在其中我们发现了VDR元件(VDRE)(图 3a)。看来在miR-27a的启动子中有3个推定的VDR结合位点(1-3)(补充图 3a),但是我们的ChIP数据显示,只有VDRE-2和VDRE-3构成了VDR的真实结合位点(图 3b和补充图 3c)。此外,与用空质粒转染的HOKs的温和增加相比,VDR的过表达大大增强了VDR和VDRE的组合(补充图 3d,e)。而且,miR-27b的启动子中有一个VDRE(补充图 3b),其通过ChIP测定法在用或不用VDR质粒转染的HOK中证实(图 3c和补充图 3f)。为了进一步验证VDR在miR-27a / b诱导中的作用,我们将VDR质粒转染到了HOKs中并测试了miR-27a / b诱导。如图3所示, 在存在VDR质粒的情况下,miR-27a / b水平高度增加(图 3d)。Hsa-let-7a-2,VDRE 研究的阳性对照33,在VDR过表达后在HOK中也显示出较高的表达(补充图 3g)。SNAP25和TXN2是miR-27a / b 14的两个靶基因,接下来我们尝试探索它们的表达方式。伴随miR-27a / b的增加,VDR过表达下调了SNAP25和TXN2的水平(补充图 3h)。据报道,维生素D可激活大多数细胞中的VDR以发挥其生物学功能21。为此,在这项研究中,我们向HOKs培养基中添加了1,25(OH)2 D 3。如图所示,维生素D轻微上调了miR-27a / b的状态(图 3e)。据报道,含溴结构域蛋白9(iBRD9)的药理学抑制作用增强了VDR的生物学功能[ 34],我们的数据表明iBRD9促进了维生素D的表达,从而增加了miR-27a / b的表达(图 3e)。
维生素D和VDR促进HOKs中miR-27a / b的表达。(a)miR-27a / b启动子中VDR结合位点的示意图。(b)ChIP分析表明,在IgG或VDR抗体沉淀后,在用VDR质粒转染的HOK 中,miR-27a中的VDR结合位点上调。站点1-3分别表示VDRE 1-3。条形图显示对数变化2倍,每个位点n = 3。(c)ChIP分析表明在IgG或VDR抗体处理后,用VDR质粒转染的HOK 中miR-27b中VDR结合位点的上调。条形图显示原木的2倍变化,该位置n = 3。(d)实时荧光定量PCR检测含或不含VDR质粒的HOKs中miR-27a / b的水平。(e)采用指示的不同处理方法实时定量检测HOKs中的miR-27a / b。** P <0.01,*** P <0.001 vs. n =3。Ctrl,控制;1,25VD,1,25(OH)2 D 3。
维生素D / VDR信号调节小鼠口腔上皮细胞中miR-27a / b的表达
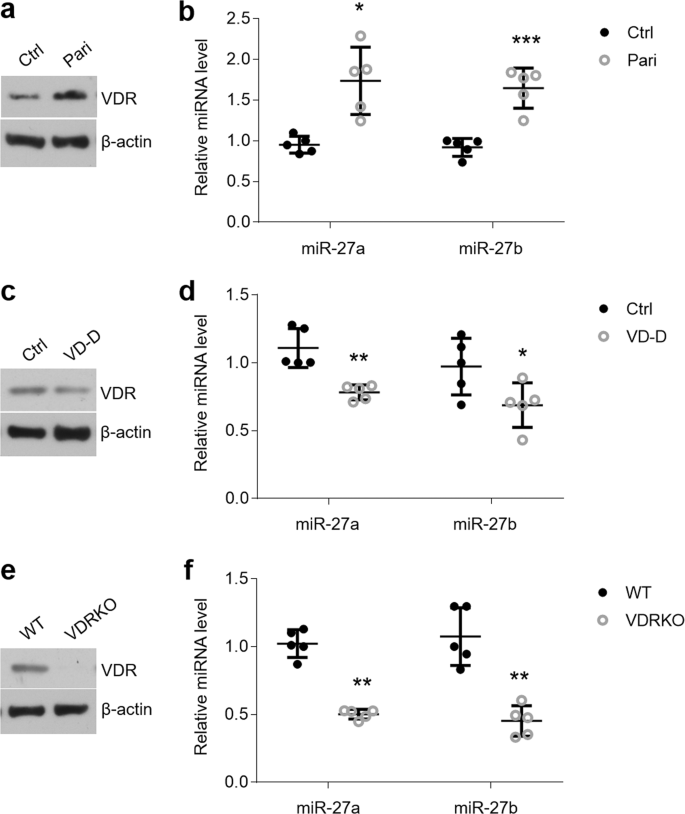
为了进一步检测维生素D / VDR信号传导对miR-27a / b 体内的影响,我们用paricalcitol处理了C57BL / 6小鼠。伴随着VDR表达的增加,口腔上皮细胞中的miR-27a / b水平被上调(图 4a,b)。相反,维生素D缺乏或VDR敲除小鼠的口腔上皮miR-27a / b的表达下调,表明VDR降低或VDR缺失(图 4c-f)。这些结果提供了在体内 miR-27a / b上介导维生素D / VDR信号的证据。
miR-27a / b的表达是由体内的维生素D和VDR介导的。(a,b)分别通过western印迹和qPCR在经帕立骨化醇处理的小鼠中测量口腔上皮细胞的VDR表达(a)和miR-27a / b水平(b)。(c,d)蛋白质印迹和qPCR显示维生素D缺乏症小鼠的口腔上皮的VDR(c)和miR-27a / b(d)状态。(ê,˚F)Western印迹和qPCR显示VDR表达式(ë)和miR-27A / B水平(˚F在口腔上皮层)VDR淘汰赛小鼠。与相应的对照或WT相比,* P <0.05,** P <0.01,*** P <0.001;n =5。Ctrl,控制;pari,paricalcitol; VDRKO,VDR淘汰赛;VD-D,维生素D缺乏症;WT,野生型。
维生素D / VDR信号的抑制导致miR-27a / b的OLP降低
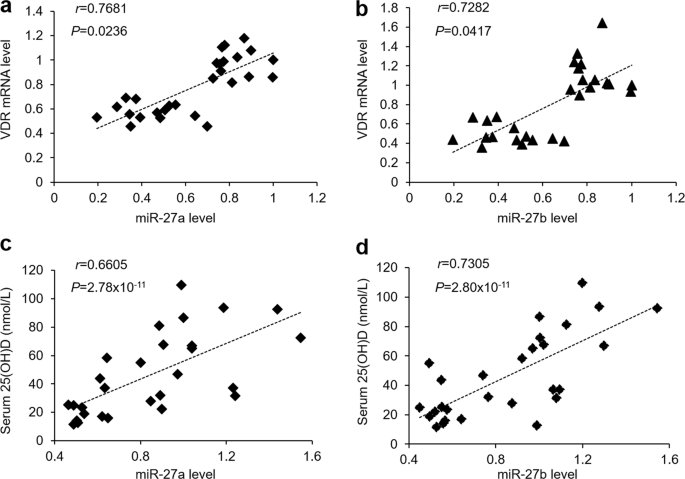
在OLP患者我们以前的研究表明,VDR的状态在活检和维生素d血清是下调23,24,其表示的miR-27a的原因/ B在OLP降低可能是,至少部分地由于维生素D / VDR信号抑制。与关于人类样品的结果一致,我们在两种细胞模型中测试了VDR表达,发现在用LPS或活化的CD4 + T细胞治疗的HOK中,它们的水平受到了损害(图 5a-d)。因此,在从OLP患者和对照组获得的口腔上皮细胞中,观察到VDR与miR-27a / b之间呈正相关(图 6a,b [ r = 0.7681,P = 0.0236,针对miR-27a的Spearman关联检验]和[ r = 0.7282,P = 0.0417,针对miR-27b的Spearman关联检验])以及参与者血清中的25(OH)D和miR-27a / b也显示良好相关性(图 6c,d [ r = 0.6605,P = 2.78×10 -11,针对miR-27a的Spearman相关检验]和[ r = 0.7305,P = 2.80×10 -11,针对miR-27b的Spearman相关检验] )。
维生素D / VDR和miR-27a / b在OLP患者和健康对照组中显示出良好的正相关。(a,b)来自OLP患者和健康对照组的人口腔上皮细胞中VDR和miR-27a(a)/ miR-27b(b) 的相关性(r = 0.7681,P = 0.0236,Spearman的miR-27a相关检验; r = 0.7282,P = 0.0417,miR-27b的Spearman相关检验,n =14。(c,d)人血清中25(OH)D与miR-27a(c)/ miR-27b(d)的相关性来自OLP患者和健康对照者(r = 0.6605,P = 2.78×10 -11,用于miR-27a的Spearman相关检验;r = 0.7305,P = 2.80×10 -11,针对miR-27b)的Spearman相关检验,n = 14。
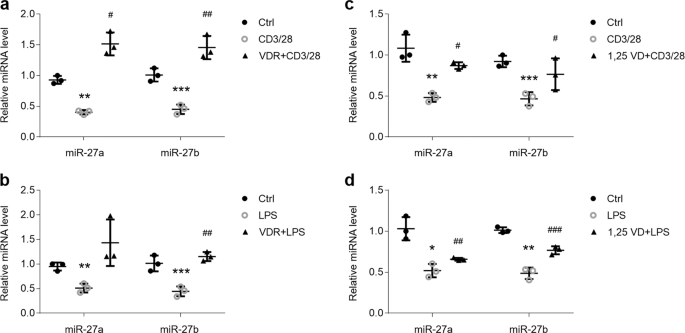
如果维生素D / VDR信号的抑制导致OLP中miR-27a / b降低,我们假设维生素D或VDR治疗可能会挽救他们。为了研究这个假设,我们在LPS或激活的CD4 + T细胞攻击之前用维生素D或VDR质粒预处理了HOK 。如图所示,在HOKs中存在活化的CD4 + T细胞或LPS 的情况下,VDR质粒转染逆转的miR-27a / b减少(图7a,b),而1,25(OH)2 D 3预处理也是如此(图 7b)。 7c,d)。此外,VDR过表达还改善了细胞培养基中miR-27a / b的减少(补充图 4a,b)。相应地,维生素D / VDR信号通过LPS或活化的CD4 + T细胞治疗减弱了霍克氏综合征中TNFα的产生(补充图 4c-f)。总之,这些数据表明维生素D / VDR信号传导阻滞是miR-27a / b降低OLP的原因之一。
维生素D和VDR在OLP细胞模型中增加miR-27a / b。(a,b)实时PCR显示,在有或没有VDR质粒转染的情况下,用活化的CD4 + T细胞(a)或LPS(b)处理的HOK中miR-27a / b的水平,如所示。(c,d)实时PCR,表明在存在或不存在1,25 VD的情况下,用活化的CD4 + T细胞(c)或LPS(d)处理的HOK中miR-27a / b表达。* P <0.05,** P <0.01,*** P <0.001 # P <0.05,## p <0.01,###与CD3 / 28或LPS组相比,P <0.001;n =3。Ctrl,控制;1,25VD,1,25(OH)2 D 3。
讨论区
在这项研究中,我们收集了来自OLP患者和健康参与者的口腔活检,血清和唾液样本以检测miR-27a / b的表达。与健康对照相比,在来自OLP患者的三种类型的样品中,miR-27a / b水平一直受到损害。从OLP患者的口腔活组织检查这些发现与以前的笔记一致了miR-27B是下调2,18。重要的是,我们通过LPS处理来模拟HOK感染条件或采用活化的CD4 +,进一步研究了OLP细胞模型中miR-27a / b的状态。T细胞上清液可模拟自身免疫反应的微环境。与在人类样品中发现的观察结果一致,miR-27a / b水平在两种细胞模型中均显示出强劲的下降,这为我们的发现提供了令人信服的证据。
体内miR-27a和miR-27b的主要生物学活性已证明与免疫应答,细胞增殖和发育有关。在HeLa细胞中,miR-27靶向SNAP25和TXN2以阻断腺病毒感染14。先前的报告已经通过调节T细胞功能和细胞因子生产声称的miR-27禁止显示炎性应答10,15。相反,miR-27过表达具有损害Treg分化的能力17。对于细胞增殖,的miR-27被证实促进骨肉瘤细胞的生长和加速软骨分化16,35,而另一些研究鉴定的miR-27在肾细胞癌肿瘤抑制36。这些不一致的观察结果导致人们对miR-27的功能尚不清楚。在OLP领域,一些研究表明miR-27b靶向PLK2以促进口腔角质形成细胞增殖 37。由于炎症条件,在OLP的情况下,miR-27a / b的功能可能很大程度上参与了免疫反应。该假设需要在我们的后续项目中进行进一步研究。在这里,我们专注于减少OLP中miR-27a / b的机制。
我们最近的数据已经表明,维生素d / VDR信号传导通过抑制细胞因子分泌和细胞凋亡在口腔角质形成细胞在OLP保护作用25,26。在当前的研究中,我们将VDR结合位点定位在miR-27a / b的启动子区域,这意味着维生素D / VDR信号传导具有诱导miR-27a / b表达的潜力。然后,我们进行了ChIP分析,以确认VDR通过与VDRE结合来增强miR-27a / b转录本。此外,VDR质粒转染,但不转染1,25(OH)2 D 3处理后,HOKs中的miR-27a / b产量大大提高,表明VDR在维生素D / VDR信号传导中起主要作用。这种看法是一致的与以前的报告,其中需要注意的是VDR是β细胞存活,基质重新编程和肝纤维化的关键调制器34,38,39。由于一些研究已经报道了维生素D的生物学功能在几个领域都受到限制40,我们建议应更多地关注VDR本身而不是维生素D激素。维生素D / VDR信号传导是否调控小鼠miR-27a / b转录本?为了回答这个问题,我们建立了三种模型。我们的数据表明,维生素D处理可提高小鼠口腔上皮细胞中miR-27a / b的表达,而维生素D缺乏或VDR缺失会降低它们。这些细胞系和小鼠数据共同确定了口服上皮维生素D / VDR信号传导在miR-27a / b表达介导中的关键作用。
我们已经证明,口腔上皮的VDR水平约50%下调和25(OH)d的血清显示状态在OLP患者> 50%减少早期探索23,24。与人类数据一致,我们进一步显示OLP细胞模型的VDR降低了约50%。根据这些结果,我们得出的结论是维生素D / VDR信号抑制可导致OLP中miR-27a / b降低。重要的是,在OLP患者的口腔标本或血清中发现VDR / 25(OH)D与miR-27a / b之间具有良好的正相关。由于缺乏完善的OLP动物模型,我们无法在小鼠患病条件下调查VDR和miR-27a / b的相关性。
维生素d或VDR表达已经被证明可以阻止核因子κB(NF-κB)途径或通过诱导希佩尔-林道(VHL)执行OLP的口腔上皮其监管职能25,26。在这项工作中,我们发现VLP质粒转染或维生素D处理可减弱LPS或活化的CD4 + T细胞上清液诱导的miR-27a / b在OLP细胞模型中减少,提示维生素D / VDR信号传导可控制miR- 27a / b表达可在OLP中发挥其生理作用,并扩展维生素D / VDR信号的调控网络。
总之,这项工作表明维生素D / VDR信号可以促进OLP中miR-27a / b的表达。与VDRE结合后,维生素D促进VDR改善口腔上皮细胞中的miR-27a / b转录本。因此,OLR的miR-27a / b降低可能至少部分归因于维生素D / VDR信号转导抑制。尽管已经阐明了miR-27a / b减少的机制,但是miR-27a / b在OLP发育中的作用仍然需要进一步研究,以更好地了解这种疾病的病因。