靶向B细胞成熟抗原(BCMA)的表达嵌合抗原受体(CAR)的T细胞具有抗多发性骨髓瘤的活性,但需要改进抗BCMA CARs。我们证明了针对临床用于抗BCMA CARs的鼠单链可变片段(scFv)的受体抗CAR T细胞反应。为了绕过潜在的抗CAR免疫原性并减小CAR结合结构域的大小,在这里我们设计了具有抗原识别结构域的CAR,这些抗原识别结构域仅包含一个完整的人重链可变结构域而没有轻链结构域。名为FHVH33-CD8BBZ的CAR包含一个完整的人类重链可变域(FHVH)以及4-1BB和CD3ζ域。表达FHVH33-CD8BBZ的T细胞表现出相似的细胞因子释放,脱粒和小鼠肿瘤根除作用,与CAR相同,只是用scFv替代FHVH33。包含4-1BB对于减少活化诱导的细胞死亡和促进表达含FHVH33的CAR的T细胞的存活至关重要。我们的结果表明,仅重链抗BCMA CARs适合在临床试验中进行评估。
介绍
嵌合抗原受体(CAR)是人工的蛋白质,其包括抗原识别部分,T细胞激活结构域,如CD3ζ,以及诸如4-1BB和CD28共刺激结构域1,2,3,4,5,6,7,8。B细胞成熟抗原(BCMA)被正常和恶性浆细胞和B细胞的一个小的子集表示9,10,11。这种受限制的表达模式使BCMA成为免疫疗法的良好靶抗原。
多发性骨髓瘤是浆细胞的几乎总是可治愈的恶性肿瘤12,13,14,15。我们和其他人有二手车的T细胞靶向BCMA在临床试验中用于治疗多发性骨髓瘤16,17,18,19。这些临床试验表明,患者的81-88%,具有抗BCMA CAR T细胞治疗后,有客观的抗瘤反应,但大多数抗骨髓瘤的反应是不是永久性的17,18,19。显然,需要改善多发性骨髓瘤的CAR T细胞疗法。
这可能限制汽车的T细胞存活收件人抗CAR免疫反应已经在临床试验中表现出对CAR T细胞20,21,22。已经并入在若干临床试验中使用车11D5-3单链可变片段(scFv)16,17,19是从鼠单克隆抗体衍生的11。以潜在地减少CAR结合结构域免疫原性的方法之一是使用人力,而不是鼠序列23,24。降低CAR免疫原性的另一种潜在方法是通过使用仅重链的结合域来简化CAR的抗原结合域的结构25。
免疫球蛋白样与没有轻链仅重链由抗原结合结构域的分子在骆驼科动物和软骨鱼首先描述25,26,27,28。结合只有一个单一的免疫球蛋白重链可变区结构域的由域已报道表现出强的和特异性抗原结合25,29,30,31,32,33。与scFv不同,单个仅重链的结合结构域不需要潜在的免疫原性连接子将重链连接至轻链。因为仅人类重链的抗原识别域没有接头或轻链,所以必须消除scFvs中必须包含的两个潜在的免疫原性连接25。仅重链的抗原识别结构域的较小尺寸在到达某些小的或部分隐藏的细胞表面抗原上可能比较大的scFv具有空间优势25。仅重链抗原识别结构域的较小尺寸也是从基因治疗载体表达的优势,因为减小转基因的大小会增加病毒基因治疗载体的效价34。与利用两个scFv的设计中,采用两个重链仅抗原识别结构域简化能够识别两种抗原的双特异性构建体CAR的设计相比35,36。
与scFvs相比,减小尺寸以及仅重链结合域的免疫原性可能降低的优势促使我们设计和测试新型的仅重链抗BCMA CAR。表达仅具有重链抗原识别结构域的CAR的T细胞表现出的BCMA特异功能,与表达经临床证明的11D5-3-scFv表达CAR的T细胞的BCMA特异功能相同。包括4-1BB共刺激域对于提高表达仅重链CAR的T细胞的存活特别重要。这些结果表明,仅重链结合域可能为靶向BCMA以外抗原的CAR提供一般优势。
结果
鼠scFv含CAR的免疫原性
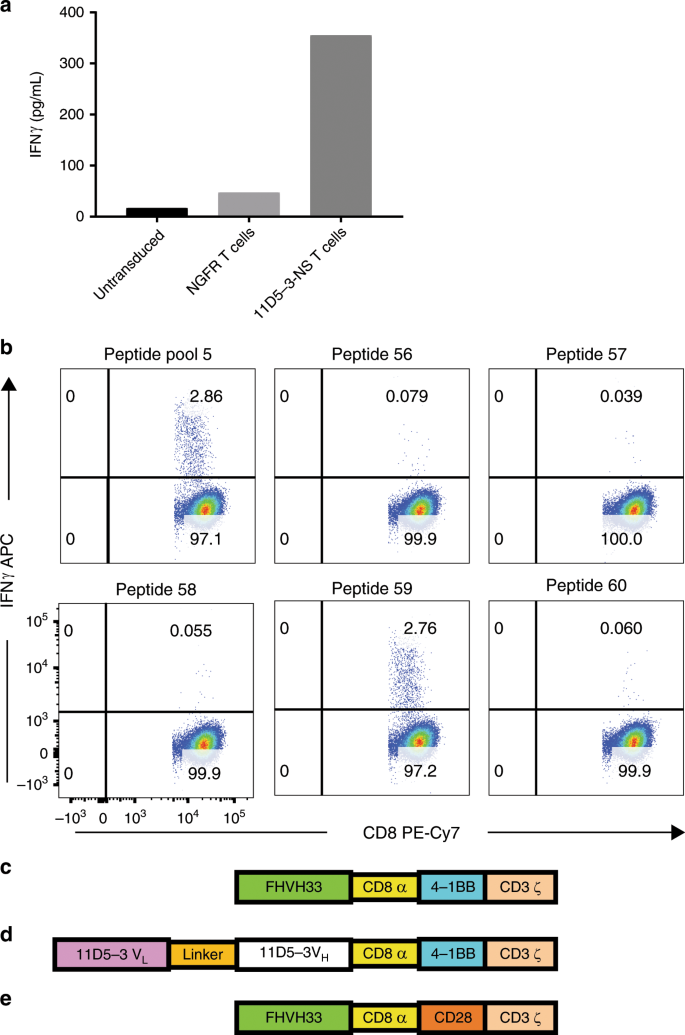
我们试图对鼠11D5-3的scFv通过类似于以前被别人利用这些方法引导学生回答的T细胞免疫反应37,38。我们准备了一个无信号的CAR,称为11D5-3-NS。11D5-3-NS的细胞外和跨膜序列与11D5-3-CD828Z的相应序列相同,CAR先前已在临床试验中测试过17。我们在先前表达11D5-3-CD828Z的T细胞的临床试验中转导了来自患者的T细胞17编码11D5-3-NS(9例)或11D5-3-CD828Z(1例)的γ-逆转录病毒载体。我们将这些转导的患者T细胞用作抗原呈递细胞,以刺激培养中的自体外周血单核细胞(PBMC)。每周两次用表达11D5-3的T细胞对PBMC进行刺激。接下来,我们用表达神经生长因子受体(NGFR)基因的自体表达11D5-3的自体T细胞或自体的阴性对照T细胞将刺激的PBMC培养过夜。然后,我们对培养物上清液进行了干扰素γ(IFNγ)酶联免疫吸附测定(ELISA)。我们在评估的十名患者中有五名发现了针对11D5-3-CAR的特定PBMC反应性。PBMC对CAR的特异性反应被定义为与表达阴性NGFR的T细胞靶相比,表达11D5-3的T细胞靶的IFNγ释放高三倍或更多。对CAR特异性反应性的另一个要求是,PBMC至少要响应表达11D5-3的T细胞靶标释放至少150 pg / mL的IFNγ(图2)。 1a)。
设计了一个 11D5-3-NS,这是一个仅包含鼠类11D5-3 scFv,铰链和跨膜区域的截短的无信号CAR。辐照的自体11D5-3-NS转导的T细胞用于刺激培养中的PBMC。PBMC来自在临床试验中接受11D5-3-CD828Z CAR T细胞的患者。7天后,再次用11D5-3-NS转导的T细胞刺激PBMC。第二次刺激后第7天,将PBMC与未转导,人NGFR基因转导或11D5-3-NS基因转导的自体T细胞培养过夜。通过ELISA测定培养物上清液中的IFNγ。发现IFNγ的11D5-3-NS特异性释放。b PBMC CAR T细胞输注后收集到一个不同的患者比在一自体11D5-3-CAR CD828Z刺激+ T细胞中的一个。通过用刺激的PBMC与自体树突状细胞培养6小时来评估肽反应性,自体树突状细胞用肽库的15聚体肽脉冲,该肽库涵盖11D5-3 scFv的所有可能的15聚体。具体IFNγ产生的T细胞在对肽池5和肽59的ICCS测定从池5中发现Ç的FHVH33-CD8BBZ CAR的图与完全人重链结合域FHVH33,从人CD8α铰链和跨膜结构域,人4-1BB结构域和人CD3ζ结构域。d 11D5-3-CD8BBZ具有鼠scFv结合域。否则,11D5-3-CD8BBZ具有与FHVH33-CD8BBZ相同的序列。Ë 除了用CD28代替4-1BB,FHVH33-CD828Z与FHVH33-CD8BBZ相同。
为了确定在ELISA分析中检测到的抗11D5-3 T细胞反应的确切靶标,我们制备了覆盖11D5-3 scFv整个序列的15-mer肽。我们用这些肽脉冲化自体树突状细胞,并使用肽脉冲化的树突状细胞来测定患者PBMC中的11D5-3特异性T细胞,这些患者PBMC先前已在表达自体11D5-3的T细胞中培养了两次。我们通过细胞内细胞因子染色(ICCS)流式细胞仪检测了IFNγ的肽特异性免疫反应(图 1b)。我们在用这种方法评估的两名患者中,发现两名患者中有11D5-3-肽特异性T细胞。这种方法只能用于两名患者,因为其他患者无法获得足够数量的细胞来进行分析。引起T细胞反应的肽来自一名患者的11D5-3重链的互补决定区3 +构架3区,而另一名患者来自11D5-3轻链的互补决定区1 +构架1区。 。
具有仅重链结合域的CAR的设计
与scFvs相比,仅重链结合结构域的免疫原性降低的潜力以及具有仅重链结合结构域的CAR的其他优势导致我们开发了针对BCMA的完全人源的仅重链结合CAR。我们之前报道过完整功能的人重链可变基因库30的转基因新大鼠。大鼠被称为Unirats 30。Unirats生产的Uniabs由两条共价连接的抗体重链组成。用佐剂30的人BCMA蛋白免疫Unirats 。RNA从引流淋巴结中分离,和高丰度的重链可变区序列表达为蛋白质30,39。这些重链可变区结构域是为BCMA识别测试30,39。具有特异性结合BCMA的能力的四个重链可变域的序列被用作新型CAR 40中的抗原识别域。CAR结合结构域仅由单个完整的人重链可变区组成。并入CAR的四个仅重链序列被称为FHVH(完全人类重链可变域)74、32、33和93 40。在最初的实验中,我们构建了编码CAR的γ-逆转录病毒载体,每个载体均包含四个仅重链的域之一。CAR序列始于每个FHVH结构域的N端,然后是CD8α铰链和跨膜结构域,4-1BB共刺激结构域和CD3ζT细胞激活结构域。示出了FHVH33-CD8BBZ的图(图 1c)。当4-1BB包含在CAR中时,包含FHVH74的CAR的T细胞表面表达劣于包含其他三个FHVH结构域的CAR(补充图 1)。含有FHVH33、32和93的CAR在表达和功能上相似,但是FHVH33在T细胞上的表达略胜一筹,因此被选择用于进一步开发。补充表 1 显示了每个FHVH结构域的CAR产生的BCMA特异性IFNγ。
我们将FHVH33-CD8BBZ与11D5-3-CD8BBZ进行了比较,11D5-3-CD8BBZ的序列与FHVH33-CD8BBZ相同,只是包含了小鼠11D5-3 scFv而不是FHVH33(图 1d)。我们还比较了FHVH33-CD8BBZ与FHVH33-CD828Z,其序列与FHVH33-CD8BBZ相同,只是用CD28代替4-1BB(图 1e)。
11D5-3-CD8BBZ和FHVH33-CD8BBZ的表达和亲和力
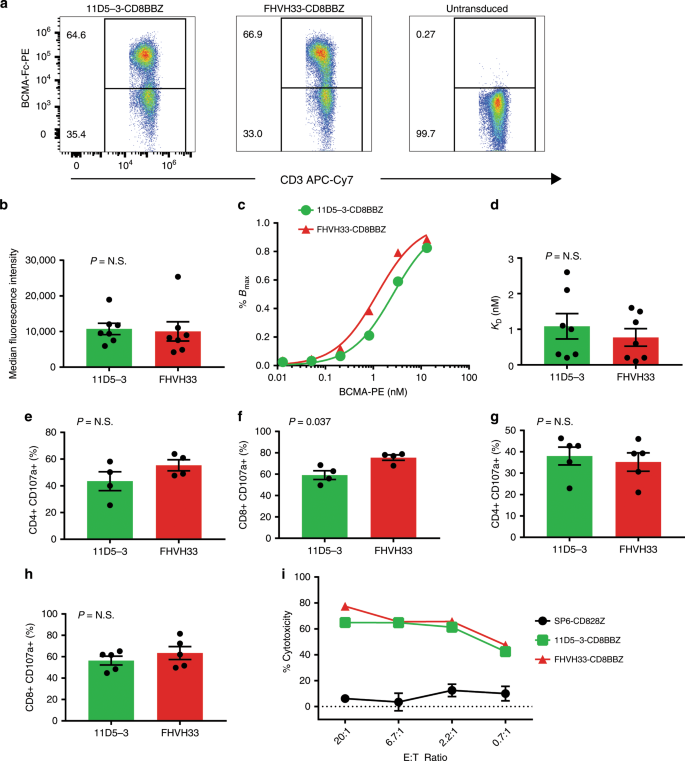
我们使用了可结晶的BCMA-免疫球蛋白片段(Fc)-藻红蛋白(PE)试剂来评估T细胞表面上CAR的表达。转导后5天,表达11D5-3-CD8BBZ与FHVH33-CD8BBZ的T细胞的百分比没有差异(图 2a)。11D5-3-CD8BBZ 的中位数%CAR + T细胞为57.2%(范围33.2-71.4%),而FHVH33-CD8BBZ 的中位数%CAR + T细胞为61.9%(范围49.0-74.3%)(n = 6;P =不显着,NS)。在最佳BCMA-Fc-PE染色后的CAR + T细胞中,11D5-3-CD8BBZ和FHVH33-CD8BBZ之间的中值荧光强度(MFI)没有差异(图 2b))。我们比较了通过使用适于从他人的以前的工作(图方法11D5-3-CD8BBZ和FHVH33-CD8BBZ的相对亲和力 2C)41,42。我们通过非线性回归计算了解离常数(K D)。我们发现11D5-3-CD8BBZ与FHVH33-CD8BBZ 的K D无差异(图 2d)。
a显示了用11D5-3-CD8BBZ或FHVH33-CD8BBZ转导或未转导的来自同一供体的T细胞的流式细胞仪结果;细胞用BCMA-Fc-PE染色。b,d – h表示平均值±sem 11D5-3表示11D5-3-CD8BBZ。FHVH33是指FHVH33-CD8BBZ。所有比较均为两尾配对t检验。P <0.05被认为具有统计学意义。NS没有统计学意义。b显示了表达11D5-3-CD8BBZ或FHVH33-CD8BBZ 的CD3 +,BCMA-Fc-PE +细胞的中值荧光强度(n = 7,P = NS)。C11D5-3-CD8BBZ与FHVH33-CD8BBZ的相对亲和力是通过用降低浓度的BCMA-Fc-PE染色表达CAR的T细胞并进行流式细胞术来确定的。Y轴是最大特异性结合的百分比(Bmax的%)。d相对K D值通过非线性回归从表达11D5-3-CD8BBZ的T细胞和FHVH33-CD8BBZ的T细胞的结合曲线确定。基于产生半最大结合的BCMA-Fc-PE的浓度计算K D值(n = 7;P = NS)。用11D5-3-CD8BBZ或FHVH33-CD8BBZ转导T细胞,并在培养中刺激4小时。CD4 +脱粒通过CD107a表达评估CD8 + T细胞。用BCMA + C17-BCMA - K562细胞(e和f,n = 4)或BCMA + RPMI8226细胞(g和h,n = 5)刺激T细胞。CD4 +或CD8 +%CD107a +事件来自活细胞CD3 +细胞门控的流式细胞仪图。从BCMA +细胞刺激脱颗粒中减去BCMA阴性NGFR-K562细胞刺激引起的背景脱颗粒。将结果标准化为CAR表达。一世在4小时的细胞毒性试验中(相似的实验之一)测试了表达11D5-3-CD8BBZ,FHVH33-CD8BBZ或阴性对照CAR SP6-CD828Z的T细胞。点代表重复孔的平均细胞毒性±sem
11D5-3-CD8BBZ T细胞与FHVH33-CD8BBZ T细胞的功能
我们没有发现在11D5-3-CD8BBZ和FHVH33-CD8BBZ之间脱粒的差除了在CD8差较小+ T细胞脱粒,当T细胞用一个出于测试了两种靶细胞系的测定(图 2E-H)。与脱粒一样,当比较11D5-3-CD8BBZ和FHVH33-CD8BBZ时,我们没有发现细胞毒性的差异(图 2i)。
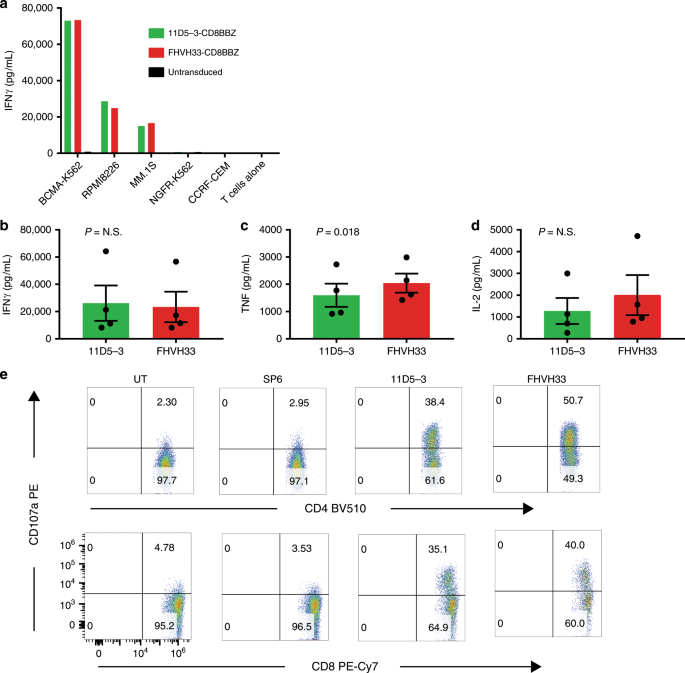
表达11D5-3-CD8BBZ或FHVH33-CD8BBZ的T细胞特异性识别BCMA +靶细胞系(图 3a)。表达两种CAR的T细胞释放的IFNγ和白介素-(IL)-2的量没有差异。FHVH33-CD8BBZ T细胞产生的肿瘤坏死因子(TNF)略高(图 3b–d)。我们量化了目标细胞系上BCMA的表达,并评估了11D5-3-CD8BBZ和FHVH33-CD8BBZ通过ICCS识别这些细胞系的能力(补充图 2)。)。与ELISA实验一致,我们发现FHVH33-CD8BBZ T细胞比11D5-3-CD8BBZ T细胞产生的TNF稍高。我们评估了表达11D5-3-CD8BBZ和FHVH33-CD8BBZ的T细胞是否可以识别原代人骨髓多发性骨髓瘤细胞。我们发现两个CAR均响应BCMA +原发性多发性骨髓瘤细胞而脱颗粒(图 3e)。当表达11D5-3-CD8BBZ或FHVH33-CD8BBZ T细胞相比,有在BCMA特异性活化诱导的细胞死亡(AICD)或增殖(补充图没有差别 3,4)。与含4-1BB的CAR相比,当我们比较具有CD28域代替4-1BB的CAR时,我们发现FHVH33-CD828Z的AICD水平高于11D5-3-CD828Z(补充图 5)。在与先前工作相似的实验中,我们未观察到11D5-3-CD828Z与FHVH33-CD828Z CAR在T细胞表面聚集的差异(补充图 6)43。
用11D5-3-CD8BBZ或FHVH33-CD8BBZ转导来自同一供体的 T细胞,或不进行转导。将T细胞与指示的靶细胞培养过夜,并对培养物上清液进行IFNγELISA。条形表示重复孔的方式。由于值太小,看不到代表包括未转导的T细胞的培养物和带有BCMA阴性靶细胞的培养物的条。用来自四个不同供体的细胞获得了相似的结果。BCMA-K562,RPMI8226和MM.1 S为BCMA + ; 其他靶细胞是BCMA −(b – dRPMI8226靶细胞与11D5-3-CD8BBZ(11D5-3)T细胞或FHVH33-CD8BBZ(FHVH33)T细胞培养过夜。接下来,进行ELISA测定以测量培养上清液中的IFNγ,TNF或IL-2。从响应RPMI8226的细胞因子释放中减去平行培养中对BCMA阴性细胞系NGFR-K562响应的非特异性细胞因子释放的量,以获得RPMI8226-特异性IFNγ释放。将结果标准化以用于CAR表达。显示了平均值±sem;Ñ = 4 P = NS(无统计学显著)由成对双尾吨 -tests对IFNγ和IL-2; 对于TNF,P= 0.018。e由56%BCMA +组成的患者骨髓细胞将多发性骨髓瘤细胞与未转导(UT)或经SP6-CD828Z阴性对照CAR,11D5-3-CD8BBZ或FHVH33-CD8BBZ转导的自体T细胞培养4小时。对细胞进行CD107a染色,以检测CD4 + T细胞(上排)或CD8 + T细胞(下排)的脱颗粒。地块在CD3 +活淋巴细胞上门控。
具有4-1BB和CD28域的CAR的功能
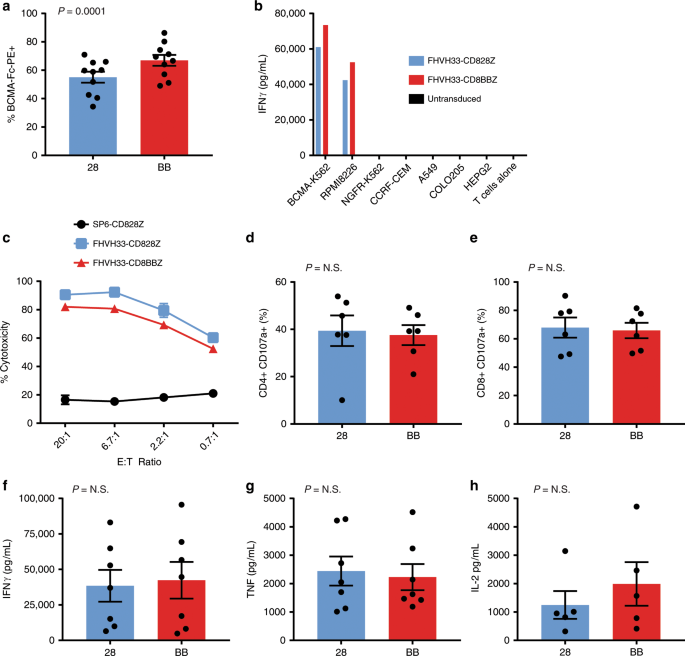
我们进行了表达FHVH33-CD8BBZ或FHVH33-CD828Z的T细胞的功能比较。转导后,表达FHVH33-CD8BBZ的T细胞分数略高于表达FHVH33-CD828Z的T细胞分数(图 4a)。我们通过抗体结合能力方法评估了CAR表达。44我们发现,用FHVH33-CD828Z或FHVH33-CD8BBZ转导的T细胞,基因组整合和每个基因组整合的CAR表达水平相似(补充图 7)。我们发现表达FHVH33-CD8BBZ或FHVH33-CD828Z的T细胞以BCMA特异性方式释放IFNγ(图 4b)。我们发现细胞毒性(图 4c)或脱颗粒(图 4d,e)比较FHVH33-CD8BBZ和FHVH33-CD828Z。表达FHVH33-CD8BBZ或FHVH33-CD828Z的CAR T细胞释放的IFNγ,TNF和IL-2的量没有差异(图 4f–h)。因为BCMA是一种分泌蛋白,已在多发性骨髓瘤患者的血清中检测到,中位水平为17.8 ng / mL 10,所以我们评估了增溶的BCMA是否可以阻止FHVH CAR对BCMA +目标细胞的识别或引起CAR的非特异性激活T细胞。我们既未发现靶细胞识别受阻,也未发现非特异性CAR T细胞活化(补充表 2)
用FHVH33-CD828Z(28)或FHVH33-CD8BBZ(BB)转导来自十个供体的 T细胞。转导后四或五天,将T细胞用抗CD3和BCMA-Fc-PE染色以检测表达CAR的T细胞。显示了表达每种CAR的T细胞百分比的平均值±标准误。该图中所有统计比较均通过配对的两尾t检验进行。P <0.05被认为具有统计学意义。b将表达FHVH33-CD828Z或FHVH33-CD8BBZ或未转导的T细胞与指示的靶细胞培养过夜,并通过ELISA在培养上清液中测量IFNγ。BCMA-K562和RPMI8226为BCMA + ; 其它细胞系是BCMA -。条形表示重复孔的方式。由于值太小,看不到代表包括未转导的T细胞和带有BCMA阴性靶细胞的培养物的培养条。进行了七个结果相似的实验。Ç表达任一FHVH33-CD828Z,FHVH33-CD8BBZ,或控制CAR SP6-CD828Z T细胞在4小时的细胞毒性测定中测试。进行了两个结果相似的实验。符号表示CD4的一式两份孔±SEM脱颗粒的手段+ d或CD8 + Ë T细胞通过检测与流式细胞术的CD107a上调测量(Ñ = 6)。显示了用RPMI8226细胞培养4小时后CD107a上调的T细胞减去用NGFR-K562细胞培养后背景CD107a上调的百分比。的释放˚F IFNγ,克 TNF,和^ h IL-2与RPMI8226细胞减去背景的细胞因子产生过夜培养培养后NGFR-K562细胞之后被示出(Ñ 对于IFNγ和TNF = 7,Ñ = 5 IL-2)。对于d – h,显示平均值±sem;将结果标准化为CAR表达;NS,无统计学意义。P <0.05被认为具有统计学意义。
。
FHVH33-CD8BBZ与FHVH33-CD828Z对T细胞的存活
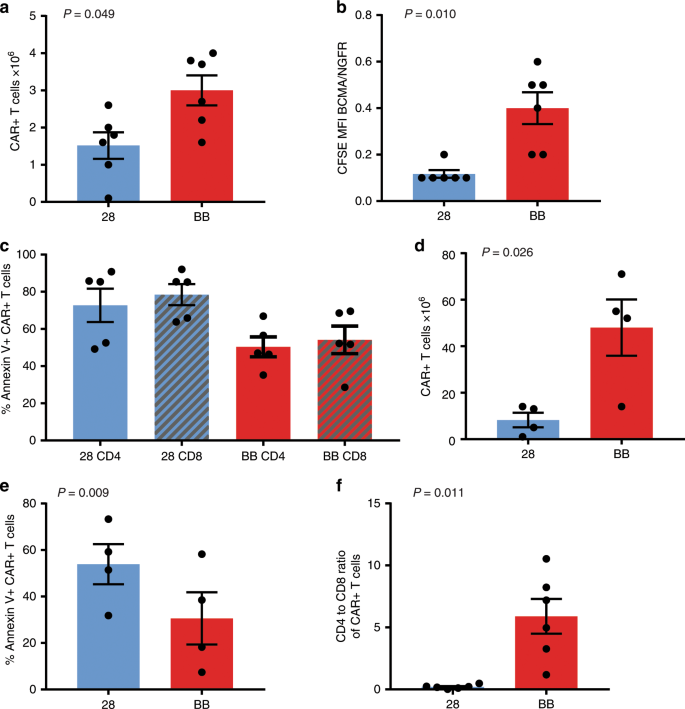
我们用羧基荧光素琥珀酰亚胺酯(CFSE)标记表达FHVH33-CD8BBZ或FHVH33-CD828Z的T细胞,并将其与BCMA-K562细胞或阴性对照NGFR-K562细胞一起培养。在4天的体外培养中,FHVH33-CD8BBZ CAR T细胞的数量增加超过FHVH33-CD828BB T细胞的数量(图 5a)。我们用BCMA-K562刺激的CAR T细胞CFSE MFI除以NGFR-K562刺激的CAR T细胞CFSE MFI来表示BCMA的CFSE BCMA特异性稀释度。较低的BCMA-K562 / NGFR-K562 MFI比值表明CFSE稀释度更高,且BCMA特异性增殖更多。表达FHVH33-CD828Z的T细胞比表达FHVH33-CD8BBZ的T细胞增殖更多(图 5b)。
用CFSE标记表达FHVH33-CD828Z(28)或FHVH33-CD8BBZ(BB)的 T细胞,并用辐照的BCMA-K562细胞或NGFR-K562细胞培养。显示了4天培养期间CAR + T细胞数量的变化(n = 6)。该图中所有条形图均显示平均值±sem。所有统计数据均采用配对的双尾t检验,P <0.05被认为具有统计学意义。b BCMA特异性增殖通过将用BCMA-K562刺激的T细胞的CFSE MFI除以用NGFR-K562刺激的T细胞的CFSE MFI来表示。FHVH33-CD828Z T细胞(28)的BCMA特异性CFSE稀释和增殖大于FHVH33-CD8BBZ(BB)T细胞(n = 6)。将表达FHVH33-CD828Z(28)或FHVH33-CD8BBZ(BB)的T细胞与BCMA-K562细胞或NGFR-K562细胞培养过夜,并用膜联蛋白V染色以检测凋亡。作为测量BCMA特异性细胞凋亡的一种方法,将%annexin V + CAR + T细胞计算为BCMA-K562刺激后膜联蛋白V + CAR + T细胞的百分比减去NGFR-K562刺激后的膜联蛋白V + CAR + T细胞的百分比。FHVH33-CD828Z 的膜联蛋白V + CAR +细胞百分比高于CD4 +(P = 0.017)和CD8 + T细胞的FHVH33-CD8BBZ(P = 0.007);Ñ = 5 d表达FHVH33-CD828Z(28)或FHVH33-CD8BBZ(BB)将T细胞与BCMA-K562细胞刺激。在培养开始时和7天后对CAR + T细胞进行定量。显示了从培养开始到培养的第7天之间CAR + T细胞数量的变化(n = 4)。e在d中所述的培养后,对T细胞的膜联蛋白V染色。显示了平均值±sem%annexin V + CAR + T细胞(n = 4)。f CFSE标记的28和BB CAR +的CD4:CD8比的平均值±sem显示了从a培养4天后的T细胞(n = 6)。
我们假设,尽管相对于FHVH33-CD8BBZ T细胞,FHVH33-CD828Z T细胞中FHVH33-CD828Z T细胞的积累较少,但却是由于THV死亡增加。我们用BCMA-K562(BCMA +)细胞或BCMA阴性靶细胞刺激FHVH33-CD8BBZ和FHVH33-CD828Z T细胞过夜,然后进行膜联蛋白V染色以检测AICD引起的细胞凋亡。我们发现表达FHVH33-CD828Z的T细胞中的AICD水平高于表达FHVH33-CD8BBZ的T细胞中的AICD水平(图 5c)。当在AICD分析中使用RPMI8226靶细胞时,我们还发现FHVH33-CD828Z与FHVH33-CD8BBZ相比具有更高的AICD水平(补充图 8)。)。与BCMA-K562细胞相比,RPMI8226细胞表达较低水平的BCMA。对于RPMI8226靶细胞,无论表达哪种CAR ,CD8 + T细胞中AICD的水平都比CD4 + T细胞中的高。我们没有看到CD4 +和CD8 + T细胞与BCMA-K562靶细胞之间AICD的差异(图 5c)。当将T细胞与RPMI8226靶细胞培养过夜时,表达11D5-3-CD828Z或11D5-3-CD8BBZ的T细胞之间的AICD没有差异(补充图 9)。
接下来,我们比较了用BCMA-K562细胞培养7天后FHVH33-CD8BBZ与FHVH33-CD828Z T细胞的体外细胞计数。FHVH33-CD8BBZ T细胞比FHVH33-CD828Z T细胞积累更多(图 5d)。通过在该培养系统中通过FHVH33-CD8BBZ T细胞的膜联蛋白V染色相对于FHVH33-CD828Z T细胞,我们还检测到较低水平的T细胞凋亡(图 5e)。在这些实验中,在7天的培养开始时T细胞的细胞表面表型显示在补充图 10中。。我们还比较了用BCMA-K562培养7天后11D5-3-CD828Z T细胞和11D5-3-CD8BBZ T细胞的体外细胞计数和凋亡。与11D5-3-CD828Z相比,11D5-3-CD8BBZ的T细胞积累更高,凋亡略低(补充图 11)。在用BCMA-K562刺激的T细胞进行的两个系列培养实验中,我们发现FHVH33-CD8BBZ的CD4与CD8的比率高于FHVH33-CD828Z的CD4与CD8的比率(图 5f,补充图 12)。
抗BCMA CAR T细胞的小鼠研究
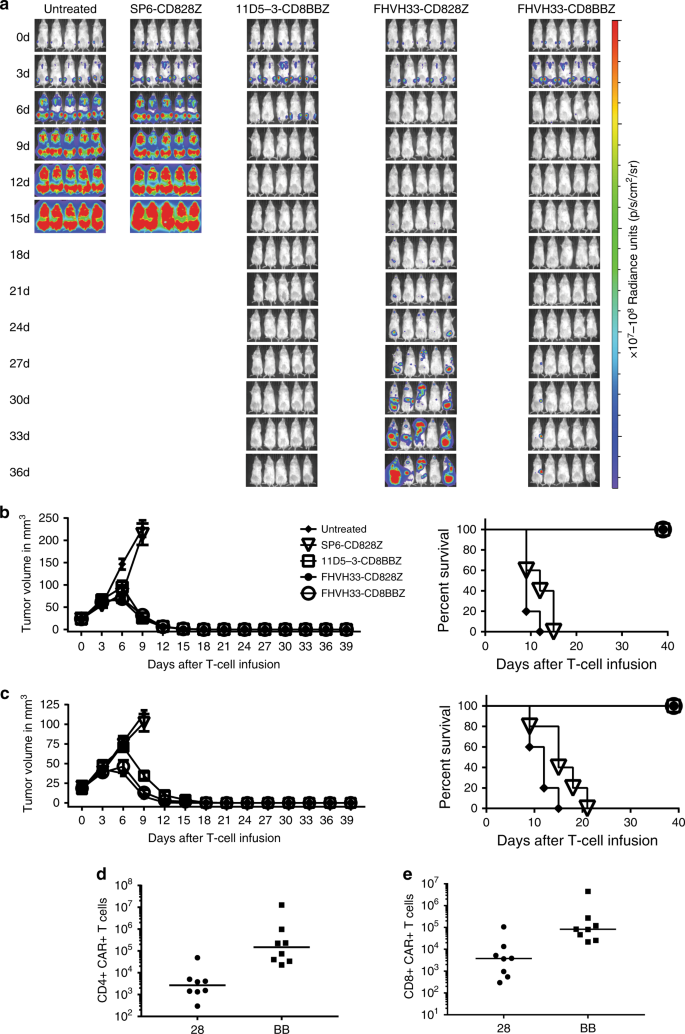
所述MM.1人力多发性骨髓瘤细胞系的弥散性恶性肿瘤负担设立于NOD.Cg- PRKDC SCID 的II2rg tm1Wjl / SZJ(NSG)小鼠。通过单次注射表达评估的每种抗BCMA CAR的CAR T细胞,MM.1 S细胞降至低于可检测水平:11D5-3-CD8BBZ,FHVH33-CD828Z和FHVH33-CD8BBZ;但是,大多数接受表达FHVH33-CD828Z的T细胞的小鼠都出现了高肿瘤负荷复发(图 6a,数字生物发光比较在补充图 13中)。)。我们还评估了携带RPMI8226人骨髓瘤细胞系实体瘤的小鼠的抗BCMA CAR T细胞疗法。一次静脉注射表达11D5-3-CD8BBZ,FHVH-CD828Z或FHVH33-CD8BBZ的T细胞,以1×10 6 CAR + T细胞/小鼠(图6b)或2×10 6 CAR +的剂量完全消除了肿瘤。 T细胞/小鼠(图 6c)。在每只小鼠0.5×10 6个 CAR T细胞的剂量下,没有任何抗BCMA CAR表现出抗肿瘤活性(补充图 14)。
给 NSG小鼠静脉注射MM.1 S细胞。10天后, 静脉注射表达所指示的CAR的1×10 6个 T细胞。每3天对小鼠成像一次。用来自不同供体的细胞完成了五只小鼠的两次实验,结果相似。b,c将 RPMI8226细胞皮内注射到NSG小鼠中。建立明显的肿瘤后,给小鼠静脉内注射表达指定CAR的b 2×10 6或c 1×10 6 T细胞。左侧图显示了五只小鼠/组的平均肿瘤体积。右侧图显示了相同小鼠的存活Kaplan–Meier图。对于2×10在6 CAR T细胞剂量下,表达SP6-CD828Z阴性对照CAR的T细胞与11D5-3-CD8BBZ,FHVH33-CD828Z和FHVH33-CD8BBZ的T细胞之间的存活率存在统计学上的显着差异( 所有三个P均为0.003)比较)。对于1×10 6 CAR T细胞剂量,表达SP6-CD828Z阴性对照CAR的T细胞与11D5-3-CD8BBZ,FHVH33-CD828Z和FHVH33-CD8BBZ的T细胞之间在存活率上有统计学意义的差异(P 对于所有三个比较,均= 0.002)。用来自不同供体的T细胞完成每只5只小鼠/组的两个实验,每个实验用2×10 6 CAR + T细胞/小鼠完成。d CD3 + CD4在注入FHVH33-CD828Z(28)或FHVH33-CD8BBZ(BB)T细胞后10天,通过流式细胞仪对+ CAR +和e CD3 + CD8 + CAR +脾细胞进行定量。在静脉内注入CAR T细胞之前,NSG小鼠已经播散了MM.1 S肿瘤细胞。通过Mann-Whitney检验进行比较。 对于CD4比较,P = 0.0011,对于CD8比较,P = 0.0030。条形代表中位数; 每组n= 8只小鼠。
为了评估CAR + T细胞的持久性,我们在NSG小鼠中建立了散布的MM.1 S细胞,并注射了表达FHVH33-CD828Z或FHVH33-CD8BBZ的T细胞。十天后,对脾脏CAR T细胞进行定量。我们发现FHVH33-CD8BBZ T细胞的绝对数量高于FHVH33-CD828BB T细胞(图 6d,e)。计算CD4 + CAR + T细胞的中值绝对数与CD8 + CAR + T细胞的中值绝对数之比。接受FHVH33-CD8BBZ的小鼠的比例为1.8,接受FHVH33-CD828Z的小鼠的比例为0.7。
由于在鼠类实验中使用了MM.1 S细胞,因此我们还以MM.1 S细胞作为BCMA +靶细胞进行了体外增殖测定。MM.1 S表达的BCMA水平明显低于我们大多数体外增殖试验中使用的BCMA-K562细胞(补充图 15)。在体外,我们发现FHVH33-CD8BBZ相对于CD4 + T细胞的FHVH33-CD828Z T细胞具有更大的积累(补充图 16)。对于没有达到统计学意义的CD8 + T细胞,与FHVH33-CD828Z T细胞相比,FHVH33-CD8BBZ T细胞有更大的积累趋势。
讨论区
为了解决具有scFv结合域的CAR的某些局限性,我们开发了具有仅由单个人重链可变区组成的抗原结合域的抗BCMA CAR。使用仅重链的结合域有三个主要原理。首先,仅具有重链的结构域的简单结构应比具有人工接头以及轻链,接头和重链组分之间的接头的scFv的免疫原性低。我们的结果表明,可以针对临床使用的鼠类11D5-3 scFv引发T细胞应答(图 1)。这些结果为通过使用人而不是鼠序列以及通过使用不太复杂的抗原结合结构域(例如仅重链结构域)开发免疫原性较低的CAR提供了理论依据。其次,单个仅重链结构域比scFv小,限制基因治疗载体表达的基因大小通常会导致转导的T细胞更好的基因表达34。限制性表达的基因的大小是特别重要的,当超过一种蛋白质,如两个车需要被表达35,45,46。第三,由于CARs靶向的恶性细胞中的抗原损失,使同一个表达CAR的T细胞同时靶向多种抗原是CAR领域的主要目标35,45,46,47,48,49。重链仅结合结构域的双特异性缓解CAR的设计35,36。靶向超过一种抗原是多发性骨髓瘤中重要的,因为一些患者出现进行性多发性骨髓瘤用抗BCMA CAR T细胞治疗后BCMA表达的损失16,17。
我们相信我们的工作对于将我们与11D5-3 scFv与CAR进行的仔细比较而著称,这是临床上最先进的bb2121 CAR T细胞产品的结合剂。结合11D5-3车已经在两项临床试验被证明是有效的16,17,19。当与含有临床有效的11D5-3 scFv的CAR进行比较时,FHVH33-CD8BBZ CAR提供了完全人重链结合域的优势,而在体外或在鼠模型中,表达CAR的T细胞的功能没有任何下降。
我们已经启动了用MSGV1-FHVH33-CD8BBZ转导的自体T细胞的I期临床试验。这是一项剂量递增试验,招募患有复发性或难治性多发性骨髓瘤的患者。治疗方案包括单次注入CAR T细胞,然后进行环磷酰胺和氟达拉滨调理化学疗法。该试验的主要目的是评估FHVH33-CD8BBZ T细胞的安全性和可行性。次要目标包括评估FHVH33-CD8BBZ T细胞针对多发性骨髓瘤的活性以及评估CAR T细胞的体内增殖和持久性。
含4-1BB车有比含有CD28,人以前曾报道4-1BB的增加T细胞的持久性和耐AICD的能力不同的CAR功能特性2,8,50,51。我们先前已经进行了广泛的临床前和临床工作与含有CD28的共刺激结构域的CAR 11,16,17,23,52,53。与传统的scFv,我们发现,含有CD28的CAR的增殖和体外培养过程中存活良好11,23,52。与我们以前的工作相反,表达含有CD28的CAR FHVH33-CD828Z的T细胞的体外存活率较表达含有4-1BB的CAR FHVH33-CD8BBZ的T细胞的存活率差。当我们在两种类型的体外培养实验中观察到FHVH33-CD8BBZ T细胞比FHVH33-CD828Z T细胞有更多积累时,这些观察结果得到了证实(图 5a,d)。尽管发现当用BCMA +靶细胞刺激时,FHVH33-CD828Z T细胞比FHVH33-CD8BBZ T细胞增殖更多(图5b),但FHVH33-CD8BBZ T细胞具有更大的积累(图 5b)。在三个不同的实验系统中,BCMA刺激后,我们发现FHVH33-CD828Z与FHVH33-CD8BBZ T细胞的凋亡更多(图 5c,e,以及补充图 8); 因此,相对于FHVH33-CD8BBZ T细胞,相对于FHVH33-CD8BBZ T细胞而言,相对于FHVH33-CD8BBZ T细胞而言,FHVH33-CD828Z T细胞积聚较少的可能原因是与FHVH33-CD8BBZ T细胞相比,FHVH33-CD828Z T细胞死亡增加。这些体外发现与注射后10天在小鼠中持续存在的FHVH33-CD828BB T细胞数量相比于FHVH33-CD8BBZ T细胞数量较少是一致的(图 6d,e)。重要的是,使用AIBB的4-1BB共刺激域可保护FHVH33 CAR。当CAR包含4-1BB共刺激域时,包含FHVH33的CAR和11D5-3的AICD水平没有差异(补充图 3)。); 然而,当比较具有CD28共刺激域的CAR时,与表达11D5-3-CD828Z的T细胞相比,表达FHVH33-CD828Z的T细胞具有更高的AICD水平(补充图 5)。11D5-3-CD828Z具有与FHVH33-CD828Z相同的序列,只是用11D5-3 scFv替代了FHVH33。有趣的是,当我们在11D5-3-CD828Z和11D5-3-CD8BBZ中比较AICD时,没有统计学上的显着差异,这表明4-1BB在结合有仅重链结合的CAR的AICD保护中更重要域与带有scFv的CAR的对比(补充图 9)。
我们始终发现FHVH33-CD8BBZ T细胞中FHVH33-CD828BB T细胞中CD4与CD8的比率更高(图 5f,补充图 12)。FHVH33-CD8BBZ导致较高的CD4与CD8比率的一个可能因素是FHVH33-CD8BBZ T细胞的CD4 +与CD8 + T细胞凋亡的平均比率低于FHVH33-CD828Z T细胞。(补充图 8)。FHVH33-CD8BBZ与FHVH33-CD828Z的CD4 +与CD8 +比率的差异不是由于CD8 +和CD4 + T细胞的增殖差异引起的(补充图 17)。)。与接受FHVH33-CD828Z T细胞的小鼠相比,接受FHVH33-CD8BBZ T细胞的小鼠脾脏CAR + T细胞的CD4与CD8比率也略高。由于我们的工作目标是产生有效的临床CAR T细胞治疗方法,因此我们关注CAR T细胞的体外生长特性和T细胞的体内特性。与FHVH33-CD8BBZ T细胞培养物中CD4 + CAR + T细胞的优势相似,在bb2121 CAR T细胞产品的临床试验中观察到CAR + T细胞的CD4与CD8比率很高治疗多发性骨髓瘤19。像FHVH33-CD8BBZ一样,bb2121 T细胞产物的CAR带有4-1BB结构域。
总之,具有完全人源重链的结合域的CAR与scFv结合域相比具有重要的优势。当CAR中包含4-1BB部分时,与11D5-3 scFv相比,FHVH33域在体外或在鼠模型中没有功能上的缺陷。
方法
在实验中使用人类细胞和使用小鼠
PBMC和骨髓细胞用于美国国家癌症研究所(NCI)临床试验的患者。NCI机构审查委员会已批准将患者样品用于研究。所有患者均获得知情同意。所有动物研究均按照NCI动物护理和使用委员会批准的方案进行。
γ-逆转录病毒转导和T细胞培养
为了产生无复制能力的γ-逆转录病毒,包装细胞用编码CARs的质粒以及编码RD114包膜蛋白的质粒转染,如先前所述52。T细胞培养开始后2天,如前所述,用编码CARs或其他蛋白质的基因对T细胞进行了γ-逆转录病毒转导52。如先前所述培养T细胞52。简而言之,在AIM V完全培养基(Invitrogen)和300国际单位(IU)/ mL的IL-2(Teceleukin,Roche)中,抗CD3单克隆抗体OKT3(Ortho)刺激PBMC。AIM V完全培养基由AIM V培养基(Thermo),5%人AB血清(Valley Biomedical),100 U / mL青霉素和100μg/ mL链霉素组成。非组织培养物处理的六孔板用10μg/ mL Retronectin(Takara)包被。OKT3刺激后两天,将2 mL逆转录病毒上清液加到涂有Retronectin的平板的每个孔中,并在37°C下孵育2小时。将细胞重悬于AIM V完全培养基和2×10 6将2 mL培养基中的细胞直接添加到病毒上清液中。加入IL-2至终浓度为300 IU / mL。转导在37°C下进行16-18小时。转导后,将细胞悬浮在含有300 IU / mL IL-2的新鲜AIM V完全培养基中。每两天将所需细胞数悬浮在AIM V完全培养基中,浓度为0.5×10 6细胞/ mL,以维持培养,每2天含300 IU / mL IL-2。
自体刺激细胞的产生
表达非功能性版本的11D5-3-CD828Z CAR的自体刺激细胞用于刺激PBMC诱导11D5-3-特异性T细胞的增殖。11D5-3-NS基因的序列从N端到C端如下:CD8α信号序列,鼠抗BCMA scFv(11D5-3)以及CD8α铰链和跨膜序列。通过Integrated DNA Technologies(IDT)将11D5-3-NS序列合成为gBlock片段,并将其克隆到MSGV1γ-逆转录病毒载体主链中54通过使用XhoI和BamHI限制酶(NEB)。产生了编码11D5-3-NS的γ-逆转录病毒载体,并按照“γ-逆转录病毒转导和T细胞培养”所述转导了患者的T细胞。还用由先前描述的编码人全长低亲和力NGFR的质粒52制成的γ逆转录病毒转导患者T细胞。将细胞冷冻保存(Cryostor CS10,StemCell Technologies)以用于随后的刺激。
从11D5-3 scFv生成15-mer肽文库
针对11D5-3-CD828Z CAR 11(PEPScreen,Sigma Aldrich)的8–279位氨基酸生成了具有11个氨基酸重叠序列的单个15-mer肽。15聚体覆盖11D5-3 scFv序列的轻链,接头和重链。将各个肽溶解在二甲亚砜中至20 mg / mL的浓度。为了快速筛选,生成了13个库,每个库由5个肽组成。
表达CAR的刺激细胞刺激PBMC
我们培养患者PBMC通过修改先前描述的方法,以评估CAR反应性T细胞37,38。在十分之九的患者中,患者的PBMC受辐照(3000 rad)的自体11D5-3-NS转导的刺激性T细胞刺激,该T细胞的生成如“自体刺激细胞的产生”所述。在一名患者中,由于起始细胞不足以产生11D5-3-NS刺激物,因此用辐照(3000拉德)的自体11D5-3-CD828Z诱导的刺激物T细胞刺激PBMC。
使用两种不同的培养过程扩增CAR反应性T细胞。使用第一种方法37,将患者PBMC解冻,并在T细胞完全培养基:RPMI1640 + L-谷氨酰胺(2 mM),加热,灭活的人AB血清(10%,Valley Biomedical),HEPES(25 mM,Corning),2-巯基乙醇(0.025 mM,Thermo Fisher)和Pen / Strep(100 U / mL青霉素,100 mcg / mL链霉素,Thermo Fisher )。在第3天,将IL-2加入培养物中(20IU / mL)。在第7天,用11D5-3-NS辐照的刺激细胞和作为辐照细胞的辐照自体PBMC以2:1:4的响应者:刺激剂:饲养者比例重新刺激响应者PBMC。在第9天和第11天,将IL-2添加到培养物中(20 IU / mL)。使用第二种方法38,将患者PBMC解冻,并在T细胞完全培养基中以1:2的响应者:刺激物比率与放射的自体11D5-3-NS刺激物细胞一起培养。在第2天,将IL-2加入培养物中(300 IU / mL)。在第7天,以1:8的响应者:刺激物比率用照射的11D5-3-NS刺激物细胞对响应者PBMC再刺激。在第8天,将IL-2加入到共培养物中(300IU / mL)。对于这两种方法,将第14天的应答者PBMC用于实验,以评估其对11D5-3 scFv的反应性。
检测CAR特异性T细胞反应的方法
为了通过IFNγELISA检测抗11D5-3 scFv T细胞反应,将第14天有反应的PBMC或与以11:5的反应者:刺激物比率在T中表达11D5-3-NS或NGFR的自体T细胞一起培养-cell完整媒体。在37°C孵育20小时后,通过ELISA测定上清液中的IFNγ。
为使ICCS评估与15-mer肽库刺激的PBMC反应性,使用先前描述的方法55产生了自体单核细胞衍生的未成熟树突细胞(MoDCs)。MoDC用来自肽库的10 µg / mL混合肽或单个肽在37°C的T细胞完全培养基中脉冲过夜。作为阴性对照,用10 µg / mL乙肝核心蛋白(HBC 128–140)对MoDC进行脉冲处理。)肽。在无叠氮化物/低内毒素级抗CD28和抗CD49d抗体(BD Biosciences)均存在的情况下,将应答者PBMC与肽脉冲的MoDCs以2:1应答者:刺激物的比率进行培养。 T细胞完全培养基在37°C下放置1小时。1小时后,加入布雷菲德菌素A(Bolfeldin A,GolgiPlug,BD Biosciences)(按照制造商的说明以1:1000的比例稀释),并将培养物再温育5小时。对细胞进行CD3,CD4和CD8的细胞表面标记染色,并用Cytofix / Cytoperm固定,并按照建议进行细胞内IFNγ染色(BD Biosciences)。通过流式细胞仪分析样品。
细胞系
RPMI8226和MM.1 S是从ATCC获得的BCMA +多发性骨髓瘤细胞系。L363是DSMZ 的BCMA +骨髓瘤细胞系。A549是BCMA阴性的肺癌细胞系(ATCC)。CCRF-CEM是BCMA阴性T细胞系(ATCC)。HepG2是BCMA阴性的肝癌细胞系(ATCC)。Colo205是BCMA阴性结肠癌细胞系(ATCC)。BCMA-K562是在我们实验室中用全长BCMA基因转导的K562细胞(ATCC)。C17-BCMA-K562细胞是克隆到有限稀释度的BCMA-K562细胞,并被选择用于BCMA低表达。NGFR-K562是在我们实验室中用低亲和力神经生长因子基因转导的K562细胞52。使用相同的γ-逆转录病毒载体和方法转导BCMA-K562和NGFR-K562。测试所有细胞系的支原体,发现均为阴性。
编码FHVH CARs的质粒的设计和构建
我们设计了一系列含有完全人类重链可变区的抗原识别域(FHVH)的CAR。每个CAR的序列都遵循这种模式,从5'端到3'端:CD8α信号序列,4个单个FHVH结构域之一以及人CD8α分子的铰链和跨膜区域。CD28或4-1BB分子的胞质部分,以及CD3ζ分子的胞质部分。用于CD8α,CD28、4-1BB和CD3ζ的序列可从美国国家生物技术信息中心网站(www.ncbi.nlm.nih)获得。有关每个分子要包含在CAR中的部分的指南是从先前的工作中获得的52。
将四个完全人重链可变区专用抗原识别域命名为FHVH 74、32、33和93 40。CAR是系统地命名的。例如,FHVH33-CD8BBZ具有FHVH33抗原识别结构域,CD8α的铰链和跨膜区域,4-1BB共刺激结构域和CD3ζT细胞活化结构域。
构建所有这些CAR,并将CAR序列连接到MSGV1γ-逆转录病毒载体主链中54通过标准方法。IDT将BCMA特异性可变重链序列合成为gBlocks。每个合成的片段由GTC三核苷酸,NcoI位点,CD8α信号序列,FHVH序列,CD8α铰链和跨膜结构域的一部分,BlpI位点和TATCGT六核苷酸组成。加入GTC和TATCGT核苷酸以确保用NcoI和BlpI完全切割末端。将片段用BlpI和NcoI-HF(New England Biolabs)在37°C下消化2小时。然后使用QIAquick PCR纯化试剂盒(Qiagen)纯化消化的片段。将片段连接到BlpI / NcoI-HF消化和凝胶纯化的MSGV1载体主链上,该主链也包括gBlock片段中未包含的CAR的其他成分。MSGV1载体主链中包含的CAR组件为:gBlock片段中未包括的CD8α域的其余部分,即CD28或4-1BB,以及CD3ζ域。每个gBlock CAR片段和MSGV1载体主链片段的连接均使用快速DNA连接试剂盒(Roche Applied Science)进行。
我们还利用了先前报道的11D5-3-CD828Z抗BCMA CAR 11和11D5-3-CD8BBZ,一种与11D5-3-CD828Z相同的CAR,只是用4-1BB代替了CD28。SP6 scFv识别半抗原2、4、6-三硝基苯磺酸56。我们构建了一个带有CAR的γ-逆转录病毒质粒,其SP6 scFv命名为MSGV1-SP6-CD828Z,并将其用作阴性对照。
T细胞的CAR检测和流式细胞仪
洗涤用一种CAR载体转导的T细胞和未转导的T细胞,并用标记有PE的BCMA-Fc蛋白(BCMA-Fc-PE)染色,以检测细胞表面CAR分子。T细胞(5×10 5将其悬浮于50μL染色缓冲液(0.4%牛血清白蛋白,0.1%叠氮化钠的磷酸盐缓冲盐水中; PBS)中,并添加滴定量的BCMA-Fc-PE试剂(Creative Biomart)。对于T细胞表型实验,细胞用以下抗体染色:CD3别藻蓝蛋白(APC)-Cy7(克隆UCHT1,BD Biosciences),CD4 FITC / BV510(克隆RPA-T4,BD Biosciences; Biolegend),CD8 PE-Cy7 / eFluor450(克隆RPA-T8,BD Biosciences; Thermo Scientific),CD45RA FITC(克隆HI100,BD Thermo Scientific),CCR7 APC(克隆150503,BD Biosciences)和CD57 FITC(克隆HCD57,Biolegend)。对于细胞内染色,将细胞用IFNγAPC(克隆B27,BD Biosciences)染色。
流式细胞术通过标准方法进行。通过使用7-氨基放线菌素D(7-AAD,BD Biosciences)排除死细胞。使用FlowJo(Tree Star,Inc.)对所有实验进行流式细胞仪分析。补充图18显示了使用的一般流式细胞术门控策略 。
CAR亲和力的非线性回归分析
使用先前描述的方法分析BCMA蛋白CAR亲和力41,42。总共5×10 5的 CAR T细胞在37°C下用四倍系列稀释的BCMA-Fc-PE蛋白(Creative Biomart)稀释;细胞也用抗CD3染色。对于第一次稀释,在57.5μL测试体积中,将BCMA-Fc-PE蛋白添加至最终浓度13.175 nM。进行流式细胞术并测定结合BCMA-Fc-PE的CAR T细胞的MFI。ķ d值用单点结合(双曲线)非线性回归模型(的GraphPad Prism 7)和BCMA-Fc的PE-CAR结合的T细胞的MFI计算表示为最大的结合位点的百分比(乙最大)。
CD107a分析
对于每个测试的T细胞培养物,准备两个试管。一个试管中包含C17-BCMA-K562细胞或RPMI8226细胞,另一管中包含NGFR-K562细胞。两个试管均包含CAR转导的T细胞,1 ml AIM-V完全培养基,滴定浓度的抗CD107a抗体(克隆H4A3,Thermo Scientific)和1μLGolgi Stop(莫能菌素,BD)。将所有试管在37°C下孵育4 h,然后对CD3,CD4和CD8染色。通过流式细胞仪分析样品。归一化通过将CD4的百分比进行+或CD8 +那名CD107a的T细胞+通过CD4的百分比+或CD8 + T细胞是CAR +通过BCMA-Fc的-PE染色。
细胞毒性测定
如先前所述进行细胞毒性试验52,57。通过比较RPMI8226 BCMA +靶细胞的存活率与阴性对照CCRF-CEM细胞的存活率来测量细胞毒性。将这两种细胞类型与CAR转导的T细胞合并在同一管中。CCRF-CEM阴性对照细胞标记有荧光染料5-(和-6)-(((4-氯甲基)苯甲酰基)氨基)四甲基罗丹明(CMTMR; Thermo Scientific)和RPMI8226 BCMA +靶细胞用羧基荧光素二乙酸琥珀酰亚胺酯(CFSE; Thermo Scientific)标记。在一些实验中,在用于细胞毒性测定之前,通过流式细胞术(FACSAria,BD)从CAR T细胞培养物中去除了自然杀伤细胞。将培养物在无菌的5 mL试管(BD)中一式两份,以多个T细胞与靶细胞的比例进行培养。管中包含的靶细胞是50,000个CFSE标记的RPMI8226靶细胞以及50,000个CMTMR标记的CCRF-CEM阴性对照细胞。将培养物在37℃下孵育4小时。温育后立即添加7-AAD(BD Biosciences),并进行流式细胞仪采集。对于每个T细胞加靶细胞培养物,RPMI8226靶细胞的存活百分比是通过将RPMI8226活细胞百分比除以CCRF-CEM阴性对照活细胞百分比来确定的。通过将每个T细胞加上靶细胞培养物中RPMI8226靶细胞的存活百分比除以含有RPMI8226靶细胞的活百分比与CCRF-CEM阴性对照细胞百分比的比值来计算RPMI8226靶细胞的校正存活百分比。仅RPMI8226靶细胞和无效应T细胞的CCRF-CEM细胞。这种校正对于考虑起始细胞数量的变化和自发靶细胞死亡是必要的。细胞毒性的计算如下:RPMI8226靶细胞的细胞毒性百分比= RPMI8226靶细胞的100校正存活百分比。通过将每个T细胞加上靶细胞培养物中RPMI8226靶细胞的存活百分比除以含有RPMI8226靶细胞的活百分比与CCRF-CEM阴性对照细胞百分比的比值来计算RPMI8226靶细胞的校正存活百分比。仅RPMI8226靶细胞和无效应T细胞的CCRF-CEM细胞。这种校正对于考虑起始细胞数量的变化和自发靶细胞死亡是必要的。细胞毒性的计算如下:RPMI8226靶细胞的细胞毒性百分比= RPMI8226靶细胞的100校正存活百分比。通过将每个T细胞加上靶细胞培养物中RPMI8226靶细胞的存活百分比除以含有RPMI8226靶细胞的活百分比与CCRF-CEM阴性对照细胞百分比的比值来计算RPMI8226靶细胞的校正存活百分比。仅RPMI8226靶细胞和无效应T细胞的CCRF-CEM细胞。这种校正对于考虑起始细胞数量的变化和自发靶细胞死亡是必要的。细胞毒性的计算如下:RPMI8226靶细胞的细胞毒性百分比= RPMI8226靶细胞的100校正存活百分比。
膜联蛋白V染色
将CAR转导的T细胞在BCMA-K562,RPMI8226或NGFR-K562 目标细胞(每个孔中带有1.5×10 6 T细胞和1×10 6个靶细胞)的24孔板中孵育过夜。过夜孵育后,将细胞用BCMA-Fc-PE,CD3,CD4和CD8染色。将细胞用PBS洗涤两次,重悬于膜联蛋白V结合缓冲液(BD Biosciences)中,并在室温下与缀合有APC的膜联蛋白V(BD Biosciences)和7-AAD(BD Biosciences)一起孵育15分钟。立即通过流式细胞仪分析细胞。
细胞因子ELISA
将BCMA +或BCMA阴性目标细胞与CAR转导的T细胞在AIM-V完全培养基中的96孔圆形底板的双孔中以1:1效应子:靶标比率混合。将板在37°C下孵育18–20 h。孵育后,通过使用先前描述的标准方法进行IFNγELISA 23。按照制造商的建议进行IL-2和TNF ELISA(R&D Systems)。当比较两个或多个CAR时,通过将细胞因子水平除以表达给定CAR的T细胞的比例,将细胞因子的释放针对CAR表达进行标准化。
具有BCMA +细胞系的ICCS
使用自体未转导的T细胞(UT)对测试的CAR T细胞培养物中的%CAR +细胞进行标准化,以使%CAR +对于所有测试的CAR T细胞培养物都是相同的。在存在布雷菲德菌素A(GolgiPlug,BD Biosciences,1:1000稀释度)的情况下,将T细胞与BCMA +细胞系以2:1效应子:靶标比率在没有IL-2的AIM V完全培养基中于37°C共培养6小时,在37°C下进行6小时根据制造商的说明)。对细胞进行CD3染色,用Cytofix / Cytoperm固定,然后对IFNγ,IL-2和TNF进行细胞内染色。
可溶性BCMA蛋白ELISA
将抗BCMA CAR T细胞单独或与BCMA-K562或RPMI8226以1:1效应子:靶标比率在AIM V完全培养基中培养。将功能级别的BCMA蛋白(Novus Biologics,NBP2-34903)添加到培养物中,使最终浓度达到25、50或150 ng / mL。在37℃下16小时后,如23所述通过培养上清液的ELISA测定IFNγ 。
增殖测定
在24孔板中建立培养物。培养物中包含的靶细胞是0.5×10 6辐照的BCMA-K562细胞或0.5×10 6辐照的NGFR-K562细胞。在某些实验中,MM.1 S取代了BCMA-K562作为BCMA +目标。培养物中还包括 来自用抗BCMA CAR转导的培养物中的0.75×10 6 T细胞。如前所述58用CFSE(Thermo Scientific)标记T细胞。共培养中使用的培养基是AIM V完全培养基。IL-2未添加到培养基中。启动后四天,每种培养物中的活细胞用台盼蓝计数以排除死细胞,并在用BCMA-Fc-PE,抗CD3,抗CD4和抗CD8染色后进行流式细胞术。BCMA特异性增殖表现为BCMA-K562刺激的T细胞的CFSE MFI除以NGFR-K562刺激的T细胞的CFSE MFI。
抗体和BCMA-Fc-PE结合能力的测量
用于计算抗体或BCMA-Fc-PE结合能力的方法是基于参考文献中公开的方法。44。PE抗人BCMA(FAB193P,R&d系统)和BCMA-Fc的PE(创意Biomart)首先滴定上BCMA-K562和FHVH33-CD8BBZ CAR的T细胞,通过分别使用先前公开的方法59。使用制造商建议的方案(目录:340495,BD Biosciences),使用BD Quantibrite™PE磁珠枚举PE抗体或BCMA-Fc-PE的结合能力。
矢量拷贝数定量PCR
使用BD FACSAria或BD Influx分选仪通过流式细胞仪分选CD3 + CAR + FHVH33 T细胞。使用制造商建议的方案(Qiagen),使用DNeasy血液和组织试剂盒从细胞中提取基因组DNA。使用针对MSGV1γ-逆转录病毒载体设计的转基因特异性定量PCR(qPCR)分析。
RVV前进:5'-TTAGGTCACTGGAAAGATGTCG-3'
RVV探针:5′-6-FAM-AGACGTTGG-ZEN-GTTACCTTC-3′-IBFQ
RVV反向:5′-GATGAGGTCTCGGTTAAAGGTG-3′
对于拷贝数参考,使用了RNaseP qPCR测定法(目录:4403326,Thermo Fisher)。为了绝对定量载体拷贝数/细胞,通过使用BlpI和BamHI位点(新英格兰生物实验室)将人RNaseP基因序列(NR_002312.1)克隆到MSGV1-FHVH33-CD8BBZ质粒中来生成校准质粒。对于qPCR,使用Quanta Perfecta Master Mix(目录:95076-012,Quanta),并在Roche LightCycler 96中循环反应。
七天体外BCMA特异性培养测定
在没有IL-2的AIM V完全培养基中,将CAR T细胞与受辐照的BCMA-K562靶细胞(18,000 rad)以2:1的效应子:靶比例培养3天。3天后,对培养的总细胞计数并加入AIM V完全培养基,使得细胞的终浓度为1×10 6 / mL。在7天培养期的开始和结束时,通过对具有锥虫蓝的细胞进行死细胞排除计数,并对BCMA-Fc-PE和抗CD3染色进行流式细胞术,计算出初始和最终CAR T细胞数。培养结束时的细胞也用膜联蛋白V(BD Biosciences)染色以评估凋亡CAR + T细胞的百分比。
实体骨髓瘤肿瘤体内实验
从NCI-Frederick或Jackson实验室给6-8周龄的NSG小鼠皮内注射PBS中的8×10 6 RPMI8226细胞。允许肿瘤生长10天,直到出现可测量的肿瘤。在7天前开始培养的CAR T细胞以0.5至2×10 6 CD3 + CAR +细胞/小鼠的剂量静脉内注射。小鼠接受了一次CAR T细胞注射。每三天用卡尺测量一次肿瘤,并使用公式(长×宽×高)/ 2计算肿瘤的体积。一旦肿瘤达到最长长度15mm,处死小鼠。
弥漫性骨髓瘤肿瘤实验
MM.1 S细胞在我们的实验室中被编码增强萤火虫荧光素酶基因60的逆转录病毒转导。MM.1S荧光素酶细胞用抗Thy1.1的单克隆抗体染色(BD Biosciences),并通过流式细胞仪分选至纯度(FACSAria,BD Biosciences)。从NCI-Frederick或Jackson实验室的NSG小鼠静脉注射8×10 6 MM.1S-荧光素酶细胞。10天后,CAR T细胞的剂量为1-2×10 6 CD3 + CAR +静脉输注细胞/小鼠。小鼠接受1次CAR T细胞注射。为了成像,给小鼠注射100 µL荧光素溶液(在PBS中为15 mg / mL,GoldBio),并用3%异氟烷麻醉。10分钟后,使用Xenogen IVIS成像系统捕获生物发光成像(BLI)。腹腔图像是在24 cm视场上以1分钟的曝光时间以binning因子4拍摄的。BLI在无尾巴的小鼠身体上以辐射度(p / sec / cm 2 / sr)为单位进行定量使用Living Image软件(Xenogen)。图像按比例缩放为10 7 –10 8辐射单位。根据NCI动物护理和使用委员会的指南,在严重的后腿麻痹发作和消瘦时处死小鼠。
体内T细胞持续性实验
向来自NCI-Frederick或Jackson实验室的NSG小鼠(6-8周龄)静脉注射PBS中的8×10 6 MM.1S-荧光素酶细胞。13天后,静脉输注1×10 6 CD3 + CAR + T细胞/小鼠。在T细胞输注后第10天处死小鼠,并从小鼠中解剖脾脏。用注射器柱塞将整个脾脏分离。用裂解缓冲液(Quality Biological)裂解红细胞,并用BCMA-Fc-PE,抗CD3,抗CD4和抗CD8染色,将0.5×10 6脾细胞用于流式细胞术检测CAR T细胞。为了计算CAR T细胞/脾脏的数量,每只小鼠脾细胞的总数乘以%CD3的乘积+,%CD4 +或%CD8 +以及%CAR +。
Dronpa成像
BCMA CAR-Dronpa融合蛋白是通过将全长Dronpa编码区克隆到MSGV1γ-逆转录病毒主链中11D5-3-CD828Z和FHVH33-CD828Z编码区的3'末端而产生的。
用于成像实验的显微镜是在尼康TE2000底座上的家用系统,之前已描述,并在此进行了必要的改动61。用于成像的物镜是Nikon 100×/1.4 NA Oil Plan Apo。使用405 nm激光(LaserBoxx,Oxxius)将蛋白质光开关到“ on”状态,并使用488 nm激光(Sapphire,Coherent Inc.)对Dronpa成像。使用适当的二向色镜合并激光线。使用ESIo AOTF控制器(ESImaging)控制405 nm激光电流,并使用带有通过使用ESIo AOTF控制器(ESImaging)触发的控制器(部件号SH025T,Thorlabs,Inc.)的光阑快门来关闭405 nm激光电流。使用AOTF(Gooch&Housego PLC)控制488 nm激光线。所有激光都通过线性偏振器(零件号WP25M-VIS,Thorlabs),并使用488 nm二向色镜(零件号DiO3-R488,Semrock)对准物镜。发射光通过二向色镜,并使用45度反射镜反射回相机。发射通过合适的发射滤镜,然后通过双视分离器(光度法)。将DV2 POL立方体(零件号DV2-POL-CUBE-KIT,光度法)插入双视角成像仪,该成像仪将发射分成正交极化,从而允许使用PCO Edge 4.2 LT(PCO AG)相机同时记录两个图像。用MicroManager控制显微镜。估计的成像功率密度为〜0.03 W / cm 将光度学(Photometrics)插入到Dual-View成像器中,该成像器将发射分成正交偏振,从而允许使用PCO Edge 4.2 LT(PCO AG)相机同时记录两个图像。用MicroManager控制显微镜。估计的成像功率密度为〜0.03 W / cm 将光度学(Photometrics)插入到Dual-View成像器中,该成像器将发射分成正交偏振,从而允许使用PCO Edge 4.2 LT(PCO AG)相机同时记录两个图像。用MicroManager控制显微镜。估计的成像功率密度为〜0.03 W / cm2为488 nm激发。
统计
每个图的图例中给出了每个实验中使用的统计检验。通常,我们使用两尾配对的学生t检验来分析体外实验。通过Kaplan和Meier的方法产生小鼠存活曲线。多次比较未校正P值。小鼠肿瘤测量对执行肿瘤测量的研究者不知情。体外试验不致盲。GraphPad Prism 7用于统计分析和制作图形。所有ELISA和细胞毒性测定均一式两份进行。在所有体外实验中,“ n ”是指来自不同供体的细胞进行独立实验的次数。在小鼠实验中,“ ñ”是指单个鼠标。每个图例中给出了“ n ”的值。用来自不同人类供体的T细胞进行小鼠过继性T细胞转移实验。在所有情况下,P <0.05被认为具有统计学意义。
报告摘要
链接到本文的《自然研究报告摘要》中提供了有关研究设计的更多信息 。