癌症干细胞(CSC)是癌症治疗的障碍,并且是耐药性,癌症复发和转移的主要原因。针对增殖的癌细胞的可用治疗方法不能有效消除静止的CSC。CSC调节剂的鉴定将有助于设计治疗策略,以使耐药CSC敏感化为化学根。在这里,我们显示血管生成素和plexin-B2调节前列腺CSC的干性,并且血管生成素/ plexin-B2的抑制剂使前列腺CSC对化学疗法敏感。能够自我更新,分化,并鉴定了单细胞接种后的肿瘤发生和受血管生成素/丛蛋白-B2的调控,血管生成素/丛蛋白-B2可通过5S核糖体RNA加工促进静态和自我更新,并产生5S核糖体RNA的生物活性3'-端片段,从而抑制蛋白质翻译并限制细胞周期。血管生成素和plexin-B2的单克隆抗体可降低前列腺CSC的干性,并在体外和体内使它们对化学治疗剂敏感。
介绍
血管生成素(ANG)是胰腺核糖核酸酶超家族的一员,最初被鉴定为肿瘤血管生成蛋白1。它被广泛表达2和具有不同的生物学功能,从细胞生长和存活3,神经发生和神经保护4,先天免疫反应5和造血再生6,7。ANG的生长促进活性通过其强大的肿瘤血管生成和癌症进展作用8表现出来,其通过表观遗传激活核糖体DNA启动子10促进47S核糖体RNA(rRNA)转录9介导。。ANG的存活函数是通过产生的一类生物活性的小RNA介导的,所述的tRNA衍生的应激诱导的小RNA(tiRNA)11,12,一种抑制全球蛋白质翻译,但允许促存活的内部核糖体进入序列介导的翻译基因13。最近,在造血干细胞和祖细胞(HSPCs)和骨髓祖细胞(MyePros)6中显示了ANG的差异RNA加工活性,导致不同的生物学功能。我们已经报道了骨髓小生境分泌的ANG 7通过增强tiRNA的产生促进原始HSPC的静止,从而导致这些细胞中蛋白质合成受到限制,而在分化程度更高的MyePros中,ANG促进47S rRNA转录,从而刺激蛋白质合成和细胞增殖6。ANG在原始干细胞和分化细胞中的差异功能均由plexin-B2(PLXNB2)介导,plexin-B2(PLXNB2)是最近鉴定的功能性ANG受体,对于多种细胞类型中ANG的生理和病理功能都是必需的和充分的14。
HSPC和MyePros中ANG和PLXNB2的二分功能促使我们根据CSC和HSPC受类似机制调控的合理性,检查它们在前列腺CSC和分化的癌细胞中的功能15。我们假设,而ANG刺激分化的前列腺癌细胞的增殖,功能在文献中充分证明8,16,17,18,19,20,21,22,它限制前列腺CSC的增殖和保持其自通过促进静态更新能力。自2005年进行三项独立研究以来前列腺CSC的原始报道以来23,24,25,积累的证据 26点到前列腺CSC的那些对抗雄激素,化学治疗药物,促氧化剂和辐射本质性的存在 27,28,29。许多细胞表面标记物,包括醛脱氢酶(ALDH),CD133,CD44,CD24和CD49f,已经报道了与前列腺CSC的相关联 30,31,32,33。但是,到目前为止,仍缺乏可用于分选真正的前列腺CSC的可靠细胞表面标记物 34。美国癌症研究协会的一个研讨会确定,真实CSC的三个标准是自我更新,分化和肿瘤启动能力35因此,通过有限稀释法从已建立的人前列腺癌细胞系中鉴定出假定的人前列腺CSC。我们获得了静止的细胞克隆,能够通过单细胞接种在NOD scidγ(NSG)小鼠中自我更新,分化并产生异种异种移植瘤。这些细胞的干细胞由ANG和PLXNB2通过涉及ANG依赖的5S rRNA加工和5S rRNA的生物活性3'-端片段生成的机制进行调控。shRNA或单克隆抗体(mAb)对ANG和PLXNB2的抑制作用会降低前列腺CSC的干度,使其动员进入细胞周期,并使它们对化疗敏感。多西他赛(DTX)和PLXNB2 mAb的联合治疗可抑制化学耐药性CSC肿瘤并延缓疾病的复发,
结果
前列腺CSC的分离和验证
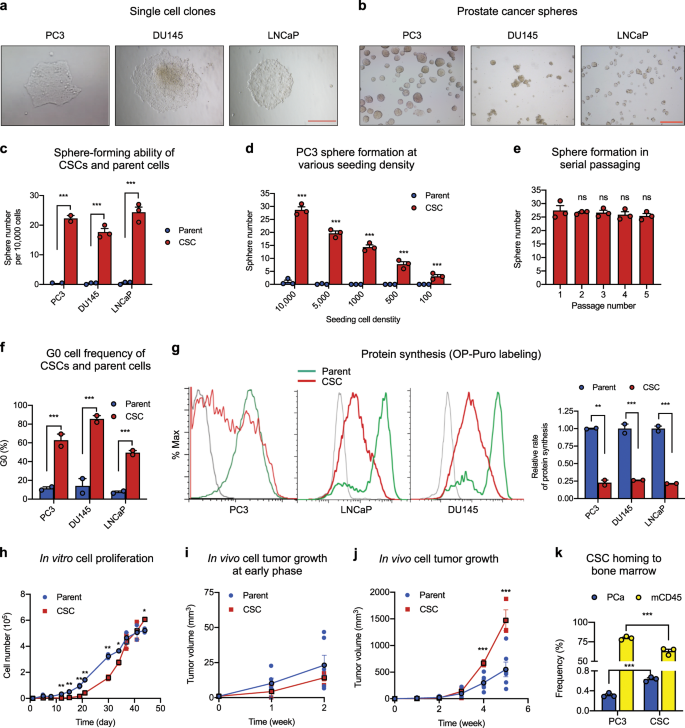
来自PC3,DU145和LNCaP人前列腺癌细胞系的单细胞在形成球状培养基的96孔非粘附板中培养4个月。通过连续繁殖进一步筛选至少五代(图1b),进一步筛选形成的克隆(图 1a)。 )。共检查了18个克隆(每个克隆分别来自PC3,DU145和LNCaP六个)在NSG小鼠中引发异种移植肿瘤的能力。其中,来自PC3的两个克隆以及来自DU145和LNCaP的一个克隆能够在具有100个细胞的NSG小鼠中形成肿瘤,因此需要进一步研究。接种这些细胞的连续稀释液,并在接种后三个月检查肿瘤。在接种了100个PC3 CSC1,DU145 CSC和LNCaP CSC的小鼠中,肿瘤摄取率为100%,而接种了100个PC3 CSC2的小鼠中的肿瘤摄取率为30%(表 1)。接种了PC3的单个CSC1的六只小鼠中有两只患有肿瘤,而接种DU145和LNCaP的单个CSC的八只小鼠中有六只出现了肿瘤(表 1)。在接种了PC3的CSC2系的一或十个细胞的小鼠中未检测到肿瘤(表 1),表明CSCs的克隆异质性很高。在整个研究过程中使用了PC3的CSC1,而不再研究CSC2。在相同条件下,至少需要50,000个亲本PC3细胞才能在NSG小鼠中引发异种移植肿瘤。
从PC3,DU145和LNCaP分离的单细胞克隆的形态。比例尺:500μm。b由在细菌培养皿中的球状培养基中培养的CSC形成的癌球。比例尺:500μm。c在35毫米培养皿中,每2 ml接种密度为10,000,CSC系和它们各自的亲代细胞的球形形成(n = 3)。d在35毫米培养皿中,每2 ml 100–10,000个细胞的PC3 CSCs和亲本细胞的球形形成(n = 3)。e连续传代过程中形成球体(35毫米培养皿中每2 ml 10,000个细胞)(n = 3)。FKi-67和7-AAD染色后,通过流式细胞仪确定CSC和亲本细胞系的G0细胞种群(n = 3)。g通过OP-Puro掺入,然后通过流式细胞仪分析确定n在CSC和亲代细胞中的蛋白质合成率(n = 3)。几何平均值由FlowJo计算。条形图表示CSC与各个亲代细胞之间的相对蛋白质合成速率。h CSC和PC3亲本细胞的体外生长曲线。接种密度为48孔板每孔10,000个细胞(n = 3)。早(i)和晚(j)PC3 CSC和NSG小鼠体内细胞的体内生长阶段。在NSG小鼠中接种含有50,000个细胞的50μlHBSS和50μlMatrigel的混合物(n = 8)。每周测量一次肿瘤大小。k PC3细胞和CSC的骨髓生境结合。将GFP标记的PC3细胞或CSC给予已移植了总骨髓单核细胞(BMMNC)的NSG小鼠,该小鼠来自已移植了人类CD34 +细胞16周的第一批受体小鼠。癌细胞给药后2周,通过流式细胞仪测定BM中GFP阳性细胞和总小鼠CD45细胞的频率(n = 6)。* p <0.05;** p <0.01;*** p <0.001;ns不重要。
与它们各自的亲代细胞相比,这些细胞形成球体的能力大大增强(图 1c)。前列腺球在形态上被鉴定为具有清晰的膜状圆边界的结构,并与显示多态结构的细胞聚集体区分开。由PC3,DU145和LNCaP的CSC形成的球的数量分别是来自相同数目的相应亲代细胞的球的数量的44.6-,53.6-和48.6倍(图 1c)。在有限稀释度分析中获得了相似的结果(图 1d)。在连续电镀实验中,至少有五次传球没有观察到球形成能力的明显下降(图 1e))。这些数据表明,CSC具有增强的自我更新能力,因为已经证明只有自我更新的细胞才能在多代人中维持其形成球体的潜力27。
流式细胞仪分析表明,从PC3,DU145和LNCaP细胞克隆的CSC的G0细胞频率分别是各自亲本细胞的G0细胞频率的5.5倍,3.4倍和8.7倍(图 1f),表明CSC是静止的。蛋白合成在干细胞36中受到严格调节,并且已显示与HSPC干性6密切相关。我们检查了采用氧-炔丙基嘌呤霉素(OP-迪普罗)掺入三种CSC线的蛋白质合成率6,36,发现蛋白质合成率普遍降低的CSC比在其各自的亲本细胞(图 1克),证实了这些CSC的干性。
与静止状态和低蛋白合成率一致,CSC与它们各自的亲代细胞相比具有降低的增殖率。直到培养第40天,它们的体外增殖速度都比亲代细胞慢(图1h),在培养 的早期阶段观察到最大的差异。在长时间的培养中,CSCs与PC3亲本细胞之间增殖速率的差异逐渐降低,到40天时又逆转,当亲本细胞达到稳定水平,但CSCs仍在增殖时,这种现象先前已经观察到37。由CSCs引发的肿瘤在体内的生长也比由相同数量的亲本细胞所引发的肿瘤(图1i)在其在第2周左右加快速度之前的生长速度慢 (图 1j)。)。在DU145和LNCaP细胞的CSC中也观察到了相似的生长特征(补充图 1a,b)。这些数据表明,CSC具有代谢活性,并且不衰老,并且能够在体外和体内增殖和分化。
我们还发现,与亲代细胞相比,CSCs具有增强的骨髓向性性,并且能够与HSPCs竞争骨髓小生境。我们移植了人类CD34 +将脐带血细胞植入亚致死剂量照射的NSG小鼠体内,并证实在移植后16周,人类和小鼠细胞均成功植入了骨髓。来自上述主要受体小鼠的BM细胞被用作第二次移植的供体细胞,以确保受体之间更均匀的移植。二次移植两周后,静脉注射GFP标记的PC3亲本细胞或CSC,再过4周,对小鼠CD45细胞和GFP阳性癌细胞进行BM分析。与亲代细胞相比,有更多的CSCs植入了BM,导致小鼠细胞的植入减少(图 1k)),表明CSC与分化的癌细胞相比具有增强的BM生态位结合能力。在这种情况下,在这些动物的其他器官(包括肺和淋巴结)中未检测到GFP标记的亲代细胞或CSC。
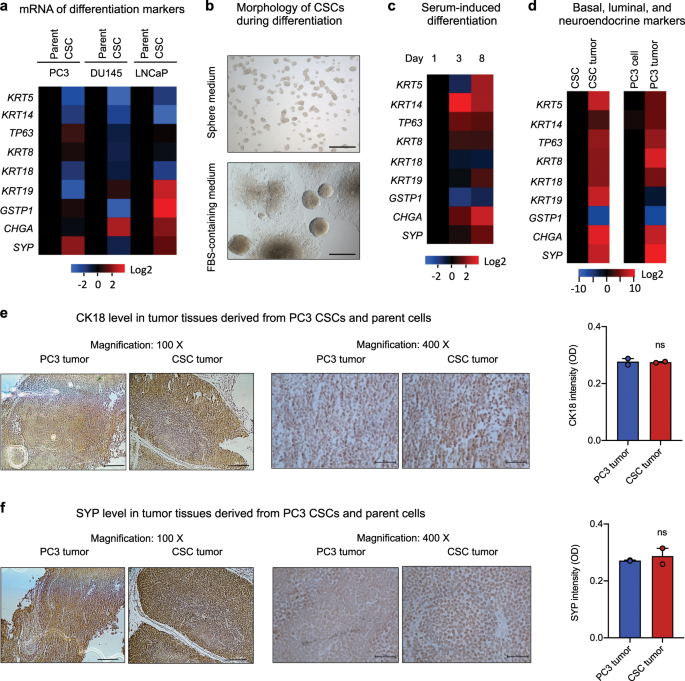
与干细胞的未分化性质一致,这三种前列腺CSC系的qRT-PCR结果显示基底细胞标志物CK5(KRT5)和CK14(KRT14)和管腔标志物CK18(KRT18)的表达降低(图 2a)。和免疫荧光(补充图 2)。观察到三个CSC系与其对应的亲本细胞相比CK5,CK14和CK18表达普遍下降,这与先前报道的具有ALDH + CD44 + α2β1 +表型的CSC 高表达CK5 形成了对比。和CK14 38,表明CSC的异构性质。没有观察到中间细胞标记物的一致表达模式,因为在PC3的CSC中CK19(KRT19)降低,但在DU145和LNCaP的CSC中增强,而在DU145的CSC中谷胱甘肽-S-转移酶-pi(GSTP1)降低但升高。在PC3和LNCaP的CSC中。但是,在所有三个CSC系中,至少两个神经内分泌标记物都升高了:PC3的CSC中突触素(SYP)增强,DU145的CSC中嗜铬粒蛋白-A(CHGA)升高,并且突触素和嗜铬粒蛋白-A均升高。在LNCaP的CSC中升高(图 2a和补充图 2)。
a通过qRT-PCR测量的CSC和亲代细胞中基础,腔和神经内分泌标志物的表达水平(n = 3)。将CSC中的值相对于各自的亲本细胞标准化。b在非贴壁培养皿中的球形培养基(上)和在DMEM加细胞培养皿中的10%FBS(下)中的球形培养基中培养2周的PC3 CSC的形态。比例尺,500μm。c在常规细胞培养基(DMEM + 10%FBS)中培养3天和8天(n = 3)的CSC中基底,腔和神经内分泌标记物的mRNA水平。热图代表每个标记的相对mRNA水平,已标准化为第1 天的值。dCSCs和CSC来源的肿瘤(左)以及PC3细胞和PC3细胞来源的肿瘤(右)中基础,腔和神经内分泌标志物的mRNA水平(n = 3)。将肿瘤组织中的值相对于原始细胞标准化。源自PC3细胞或CSC的肿瘤中CK18(e)和SYP(f)的IHC 。通过图像J获得信号强度的定量(n = 3)。比例尺:左侧面板200μm;右面板,50μm。ns不重要。
接下来,我们检查了候选CSCs的分化潜能,因为已经表明CSCs的可塑性赋予它们分化为癌细胞异质谱系的能力37。尽管候选CSC在非贴壁培养皿中的球形培养基中培养时仍保持其成球能力并保持未分化状态,但它们在粘附培养条件下在存在血清的情况下经历了分化和随后的增殖,这一点可通过形成大菌落和向外生长来证明。细胞(图 2b),并伴有基底,腔和神经内分泌标记物的增强表达(图 2c,补充图 3a))。我们还发现这些候选CSC能够在体内分化。源自CSC和PC3亲本细胞的肿瘤均是异质的,其基础,腔和神经内分泌标记物的表达均高于其各自的起源细胞(图 2d)。结果,源自CSCs和PC3亲本细胞的肿瘤表现出相似水平的CK18(图 2e)和SYP(图 2f),表明亲本细胞和CSCs都能在小鼠中形成分化的肿瘤。
据报道,雄激素受体(AR)调节前列腺癌的干度39。在雄激素敏感的LNCaP细胞和不敏感的DU145和PC3细胞中均可检测到AR mRNA和蛋白质40。在从雄激素敏感的LNCaP细胞克隆的候选CSC中,我们发现AR mRNA水平显着低于亲代细胞,但是,在从雄激素不敏感细胞系PC3和DU145克隆的候选CSC中未发现AR的共有表达模式。(补充图 3b中),与所述的发现相一致,即AR可以是正的或在前列腺CSC的负的,并确认AR在干细胞的异质水平和多样化的功能41,42。我们还发现AR在PC3的CSCs(补充图3c)和亲代细胞(补充图 3d)衍生的异种移植肿瘤中重新表达 ,进一步证明候选CSCs能够在体内分化产生具有以下特征的肿瘤前列腺癌。前列腺特异性抗原(PSA)水平的降低已被报告为前列腺癌细胞干性的指标43。然而,在PSA水平没有差异的CSCs(0.62±0.09每10个纳克之间存在3每天细胞)和亲本细胞(0.65±0.07每10个纳克3的LNCaP每天细胞)。
Taken together, these results demonstrate that the candidate CSCs cloned form prostate cancer cells lines are quiescent, able to self-renew, differentiate, and initiate tumors with a single cell inoculation, indicating that they are authentic prostate CSCs. To the best of our knowledge, this is the first time that a single cell is shown to be able to generate serially transplantable and fully differentiated tumors in mice, even though one previous report showed that single luminal epithelial progenitors can generate prostate organoids in culture44.
ANG and PLXNB2 regulate stemness of prostate CSCs
Cell surface markers including ALDH, CD24, CD44, CD49f, CD133, CD326, and Trop2, have been used to sort potential prostate CSCs30,31,32,33. We analyzed the expression patterns of these cell surface molecules in the CSCs cloned from PC3, DU145, and LNCaP cell lines by flow cytometry and found that all three CSC lines have increased expression of CD49f (Supplementary Fig. 4a) and decreased expression of CD133 (Supplementary Fig. 4b). No consensus expression patterns of ALDH, CD24, CD44, CD326, and Trop2 were noticed among the three CSC lines (Supplementary Fig. 4c–4g).
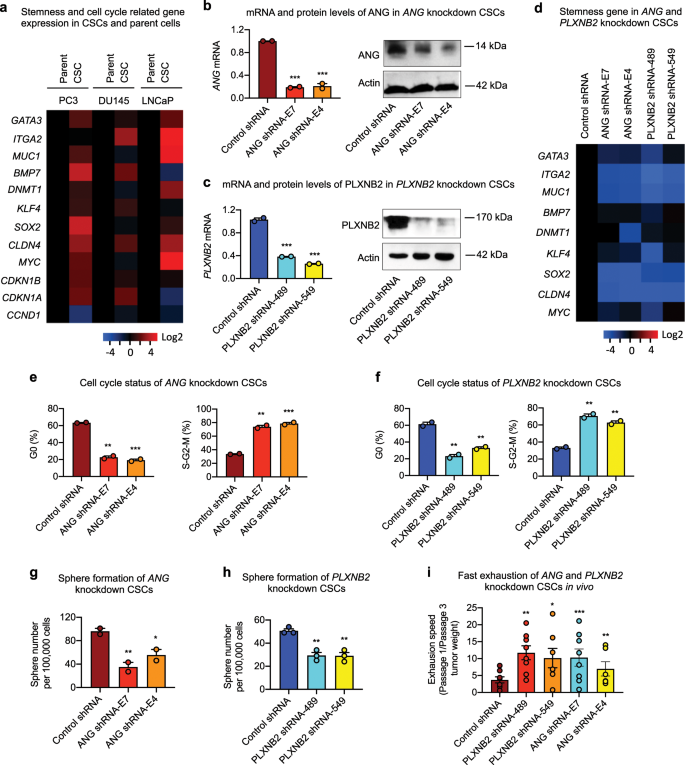
接下来,我们进行了qPCR分析,以检查人干细胞转录因子在CSC和PC3亲本细胞中的表达水平。在分析的88个转录因子中,与亲代细胞相比,GATA3,SOX2和MYC是在CSC中显示升高表达的三个转录因子。这三个转录因子以及许多自我更新和周期检查点基因,包括ITGA2,MUC1,BMP7,DNMT1,KLF4,CLDN4,CDKN1B和CDKN1A据报道,这与干性相关,在所有三个CSC系中进行了分析,发现它们在CSC中总体上高于其各自的亲本细胞(图 3a)。值得注意的是,与细胞周期相关的基因CCND1在CSCs中比在亲代细胞中低,这与CSCs的细胞周期状态降低一致。
前列腺癌干细胞和亲代细胞中癌干相关基因的 mRNA水平(n = 5)。将CSC中的值相对于各自的亲本细胞标准化。击倒CSC 中ANG(b)和PLXNB2(c)的mRNA和蛋白水平。通过qRT-PCR测定mRNA水平,并标准化为对照shRNA转染子(n = 3)。通过免疫印迹确定蛋白质水平。d ANG和PLXNB2基因敲低的CSC 中癌症干性相关基因的mRNA水平(n = 3)。将值相对于对照shRNA转染子标准化。ANG(e)和PLXNB2的细胞周期状态(f)敲低的CSC,在Ki-67和7-AAD染色后通过流式细胞仪分析(n = 2)。ANG(g)和PLXNB2(h)击倒CSC(n = 3)的球形成。我在体内连续传代过程中CSC耗尽。细胞在NSG小鼠(n = 5-8)中传代3次。在每个传代中,每只小鼠接种100,000个细胞。切除肿瘤并在每次传代后4周称重。用力计算为从第一代到第三代的肿瘤重量比。* p <0.05;** p <0.01;*** p <0.001。
ANG已经显示出在前列腺癌逐步上调8,16,17,19,45,最终使雄激素依赖性去势抗性,激素难治性表型的过渡作用21,45。PLXNB2在前列腺癌中也已被上调,并且与患者生存率呈负相关14。CSC 中ANG(补充图5a)和PLXNB2(补充图 5b,5c)的表达水平 高于亲代细胞。通过ANG特异性shRNA E7和E4 敲除ANG(图。 3b,补充图 6)或PLXNB2特异性shRNA 489和549的PLXNB2(图 3c,补充图 6)导致CSC中的干基因表达减少(图 3d),G0细胞频率随着S-G2-M细胞的频率随之增加(图 3e,f),球形成能力下降(图 3g,h)。一致地,ANG和PLXNB2敲低CSCs在体外(补充图7a,b)和体内(补充图 7c)均较快增殖 。肿瘤源于ANG和PLXNB2组合式CSCs大于源自相同数目的对照shRNA转染的CSCs,并伴随肿瘤切片中Ki-67阳性细胞的增加(补充图 7d)。在ANG和PLXNB2敲低CSC的球体浸入46中未观察到差异(补充图 7e)。重要的是,我们发现ANG和PLXNB2的敲低导致CSC体内肿瘤启动能力的更快耗尽,这是通过第一和第三代之间的相对肿瘤生长速率评估的(图 3i)。这些结果表明ANG或CSCs中PLXNB2的表达导致细胞循环增强,自我更新能力降低,这表明ANG和PLXNB2保持CSC的干性(可能通过使其保持静止状态)成为可能,因为已证明未经检查的干细胞增殖会导致精疲力尽47。
As PLXNB2, CD49f, and ALDH are overexpressed in CSCs than in parent cells of PC3, we sorted PLXNB2highCD49fhighALDHhigh cells from PC3 cells and examined their ability to form prostatospheres. However, PLXNB2highCD49fhighALDHhigh cells displayed no enhancement in sphere-forming capabilities as compared with the parent cells (Supplementary Fig. 7f), indicating that PLXNB2 is upregulated in CSCs but is insufficient to be used for sorting potential CSCs.
ANG and PLXNB2 mAbs decrease stemness of prostate CSCs
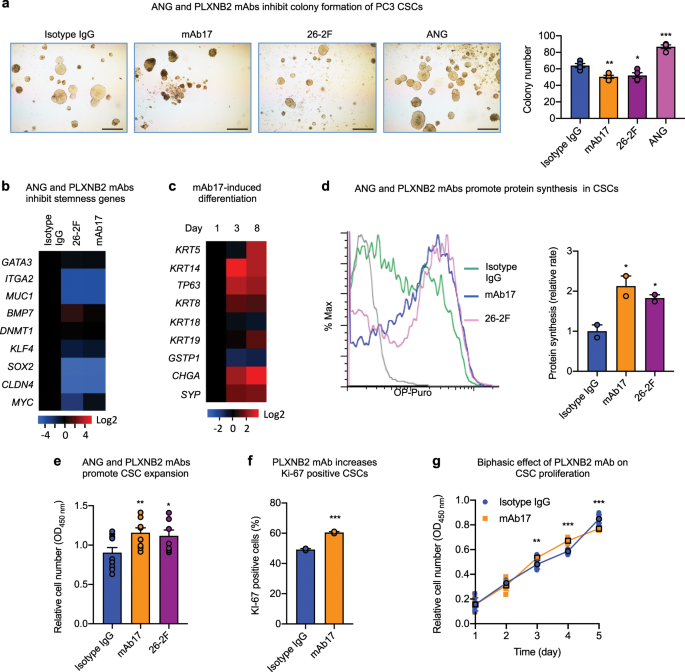
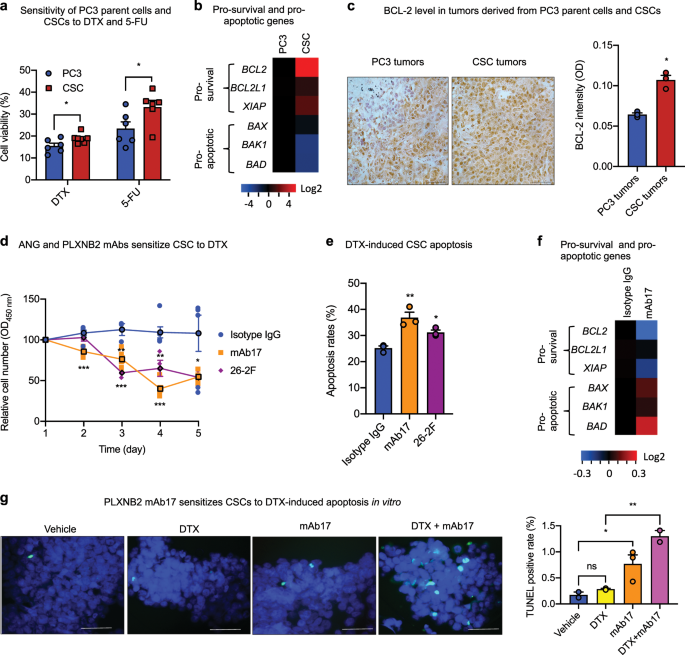
To determine whether ANG-regulated CSC quiescence is of therapeutic relevance, we examined the effect of mAbs of ANG and PLXNB2 on CSC stemness. ANG mAb (26-2F) and PLXNB2 mAb (mAb17) inhibited colony formation of all three prostate CSC lines (Fig. 4a, Supplementary Fig. 8a,b), demonstrating that these antibodies decreased the functional capabilities of CSCs. Expression of stemness-related genes was decreased upon treatment with 26-2F or mAb17 (Fig. 4b), whereas the expression of basal, luminal, and neuroendocrine markers was generally enhanced in a time-dependent manner by mAb17 (Fig. 4c), indicating that the neutralization of ANG or PLXNB2 by mAbs was able to decrease the stemness of CSCs and induce differentiation. Loss of CSC quiescence was accompanied by elevated protein synthesis in CSCs (Fig. 4d), resulting in CSC expansion (Fig. 4e). Consistently, mAb17 increased the frequency of Ki-67 positive cells (Fig. 4f), and had a biphasic effect on CSC proliferation (Fig. 4g). This biphasic effect of mAb17 in CSC culture is likely caused by the dichotomous effect of ANG on CSCs and on differentiated cancer cells. In the early phase of CSC culture, mAb17 likely mobilized CSCs out of quiescence and therefore enhanced their proliferation; however, in the later phase of culture, the population became more predominantly differentiated cancer cells due to CSC differentiation, mAb17 then likely inhibited proliferation of these differentiated cancer cells. This observation is consistent with the finding that treatment of PC3 parent cells with 26-2F and mAb17 resulted in reduced protein synthesis (Supplementary Fig. 8c) and slowed proliferation (Supplementary Fig. 8d, e)。这些结果表明ANG和PLXNB2 mAb促进CSC循环,增强CSC增殖和分化,并抑制分化的癌细胞。
在存在30μg/ ml非免疫同种型IgG对照,26-2F或mAb17或1μg/ ml ANG的情况下,PC3 CSC 的菌落形成(n = 3)。比例尺:500μm。b用30μg/ ml同种型IgG,mAb17或26-2F处理24 h的CSC中干基因的mRNA水平(n = 3)。将值相对于同种型IgG对照标准化。c在存在30μg/ ml mAb17的情况下,第1、3和8天时CSC中基底,腔和神经内分泌标记物的mRNA水平(n = 3)。将值标准化至第1 天。d通过OP-Puro掺入并随后通过流式细胞仪测定,用30μg/ ml同种型IgG,mAb17或26-2F处理24小时的CSC中的蛋白质合成。计算几何平均值,并标准化为同种型IgG对照的几何平均值(n = 2)。È在30存在CSC增殖微克/毫升的IgG同种型,mAb17,或26-2F。处理4天后,通过MTS测定确定细胞数(n = 10-11)。f用30μg/ ml同型IgG对照或mAb17处理3天后,通过流式细胞术在CSC中确定Ki-67阳性细胞群(n = 2)。g在存在30μg/ ml同种型IgG对照或mAb17的情况下,PC3 CSC的体外生长曲线(n = 4-8)。*p <0.05;** p <0.01;*** p <0.001。
ANG和PLXNB2 mAb使前列腺CSC对化疗敏感
CSC对化疗药物如DTX和氟尿嘧啶(5-FU)的耐药性更高(图 5a),这可能是由于存活基因的表达增强和凋亡基因的表达降低(图 5b)。实际上,在源自CSC的肿瘤中观察到比源自PC3亲本细胞的肿瘤中BCL-2蛋白水平的表达增强(图 5c)。DTX是晚期前列腺癌最常用的化学治疗剂,浓度为20 nM,与化学疗法中使用的剂量相当,在5天后不影响CSC生存力,但当30μg/ ml 26时导致约50%的死亡存在-2F或mAb17(图 5d)。在50 nM的高剂量下,DTX在24小时内仅诱导25.2±1.5%的CSC凋亡,但是,在26-2F和mAb17存在的情况下,相同浓度的DTX诱导的36.8±3.7%和31.2±1.6%CSCs 分别进入凋亡状态(图 5e),表明ANG或PLXNB2的抑制使CSCs对DTX诱导的细胞凋亡敏感。因此,发现mAb17减弱存活前基因表达但增强凋亡前基因表达(图 5f),导致细胞凋亡增加(图 5g)。DTX和mAb17对CSC凋亡的协同作用导致DTX对CSC的IC50从240 nM降低到62 nM(表 2)。值得注意的是,DTX对PC3亲本细胞的IC50不受mAb17的影响。
一个用50nM DTX或100μM5-FU 24小时(经处理的PC3细胞和肿瘤干细胞的活力Ñ = 6)。b PC 3 细胞和CSC中存活基因和凋亡基因的表达(n = 3)。将值相对于PC3细胞标准化。c来自PC3细胞和CSC的异种移植肿瘤组织中BCL-2的IHC。信号强度由图像J确定(n = 3)。d在20 nM DTX加上30μg/ ml的同种型IgG对照,mAb17或16-2 F的情况下CSC生存力的时程(n = 4-6)。Ë在30μg/ ml同种型IgG对照,mAb17或26-2 F存在24小时的条件下,用流式细胞仪测定细胞凋亡,然后用膜联蛋白V染色处理50nM DTX处理的CSC,持续24 h(n = 3)。f用30μg/ ml的同种型IgG对照或mAb17处理48小时后,CSC中存活和促凋亡基因的mRNA水平(n = 3)。g通过TUNEL分析在用20 nM DTX,30μg/ ml mAb17或两者处理24小时的CSC中检测到的凋亡细胞。比例尺:50μm。在每个样品中总共200个细胞中计数TUNEL阳性细胞(n = 3)。* p <0.05;** p <0.01;*** p <0.001;ns不重要。
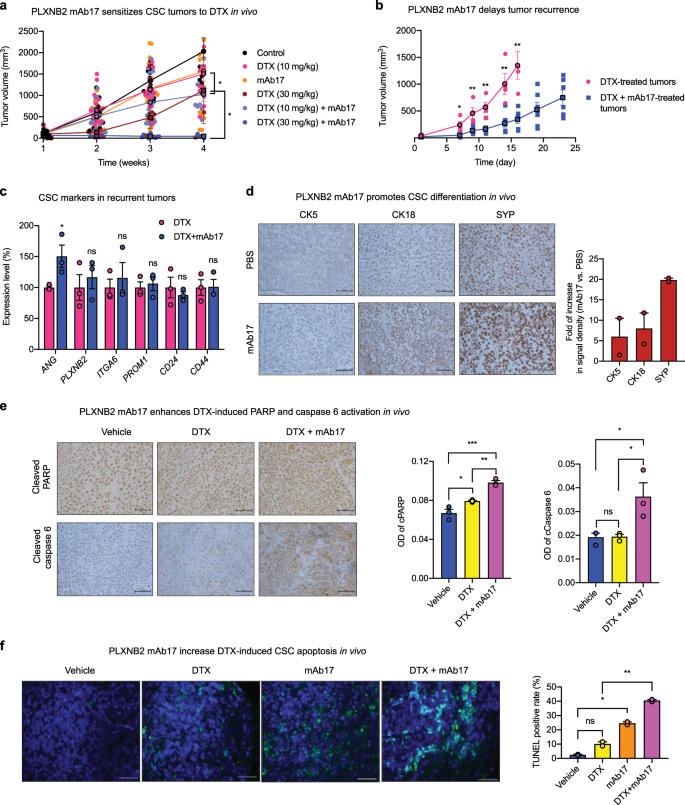
接下来,我们检查了PLXNB2 mAb在体内的化学增敏作用。携带CSC异种移植肿瘤的NSG小鼠用mAb17,DTX或两者的组合治疗。分别以10 mg / kg的mAb17和DTX略微抑制CSC肿瘤的生长(图 6a),并一起使用时显示出加和效应(补充图 9a)。在高剂量(30 mg / kg)下,DTX具有更大的抑制作用,并被mAb17进一步增强,从而在组合治疗组中对肿瘤生长产生了超过90%的抑制作用(图 6a)。组合治疗组的抑制程度高于两个单独治疗组的理论累加值(补充图 9b)), indicating a synergistic effect between mAb17 and DTX. To determine if a combination treatment of DTX and mAb17 delayed tumor recurrence, individual mice bearing similar sizes of tumors from the DTX (30 mg per kg) group and from the DTX (30 mg per kg) + mAb17 (4.8 mg per ml) group were selected for post treatment observation of tumor development. Tumors in mice treated with DTX alone recurred much faster than that in mice treated with DTX and mAb17 (Fig. 6b), indicating that mAb17 not only sensitized CSC tumors to chemotherapy, but also delayed tumor recurrence after treatment was ceased. Recurred tumors from DTX + mAb17 group had slightly enhanced ANG expression as compared with those from DTX group, probably as a feedback response from PLXNB2 inhibition by mAb17 (Fig. 6c). However, no difference was observed in recurred tumors between DTX and DTX + mAb17 groups in the expression levels of PLXNB2 and CSC markers including ITGA6 (CD49f), PROM1 (CD133), CD24, and CD44 (Fig. 6c), suggesting that delayed tumor recurrence in the combinatorial treatment group was not due to changes of clonal composition induced by PLXNB2 inhibition. Consistent with in vitro findings that mAb17 promoted CSC differentiation and enhanced CSC apoptosis, especially in the presence of DTX, we found that CSC tumors from mAb17-treated mice have enhanced expression of basal, luminal, and neuroendocrine markers such as CK5, CK18, and SYP (Fig. 6d, Supplementary Fig. 9c) and apoptotic mediators such as cleaved PARP and caspase 6 (Fig. 6e, Supplementary Fig. 9d), and underwent more robust apoptosis (Fig. 6f). TUNEL staining showed that tumor tissues from animals receiving combinatorial treatment of DTX and mAb17 had increased apoptosis over those receiving treatment with vehicle, DTX or mAb17 alone (Fig. 6f). Consistent with previous reports that inhibition of PLXNB2 by mAb17 had no adverse effect on normal tissues14, no acute or delayed toxicity was noticed in mAb17-treated NSG mice.
一个 PLXNB2单抗敏感CSC肿瘤DTX。将NSG小鼠接种100,000 CSC, 当肿瘤大小达到约100 mm 3时随机分为6组(n = 6-19),并用PBS对照(n = 6),4.8 mg / kg mAb17(n = 19)处理, 10 mg / kg DTX(n = 16),30 mg / kg DTX(n = 6),10 mg / kg DTX + 4.8 mg / kg mAb17(n = 16)和30 mg / kg DTX + 4.8 mg / kg 通过每周ip注射获得mAb17(n = 10)。每周测量一次肿瘤大小。b第4周停止治疗。DTX 30 mg / kg组中具有相似肿瘤大小的动物(4只小鼠,平均肿瘤大小为34.4±5.6 mm 3)和30 mg / kg DTX + 4.8 mg / kg mAb17的组(平均肿瘤大小为22.2±8.3 mm 3的 6只小鼠)观察到了另外23天的肿瘤生长。c定量qRT-PCR检测复发性肿瘤中ANG,PLXNB2和代表性CSC标志物的mRNA水平(n = 3)。将值标准化为DTX组的平均值。d用PBS或mAb17处理的CSC异种移植肿瘤组织中CK5,CK18和SYP的IHC染色(n = 2)。比例尺:50μm。È在CSC切割的PARP和裂解的caspase 6的IHC异种移植用PBS处理的肿瘤组织,30mg / kg的DTX,和30mg / kg的DTX + 4.8毫克/千克mAb17(Ñ = 3)。比例尺:50μm。f通过TUNEL分析在用DTX(30 mg / kg),mAb17(4.8 mg / kg)或两者处理的CSC异种移植肿瘤组织中检测到的凋亡细胞。比例尺:100μm。在每个样品中总共200个细胞中计数TUNEL阳性细胞(n = 2)。* p <0.05;** p <0.01;*** p <0.001;ns不重要。
在一起,以上结果表明,ANG和PLXNB2 mAb能够降低前列腺CSC的自我更新能力并使它们对化学疗法敏感。应当注意,从三个独立的亲本细胞系克隆的所有三个CSC系均对ANG或PLXNB2 mAb有反应,表明这些CSC并不是随机的或奇异的克隆,它们的致癌性更高,而是具有共同的调控机制,其中ANG-PLXNB2轴保持其干度。
ANG促进CSC中5S rRNA加工
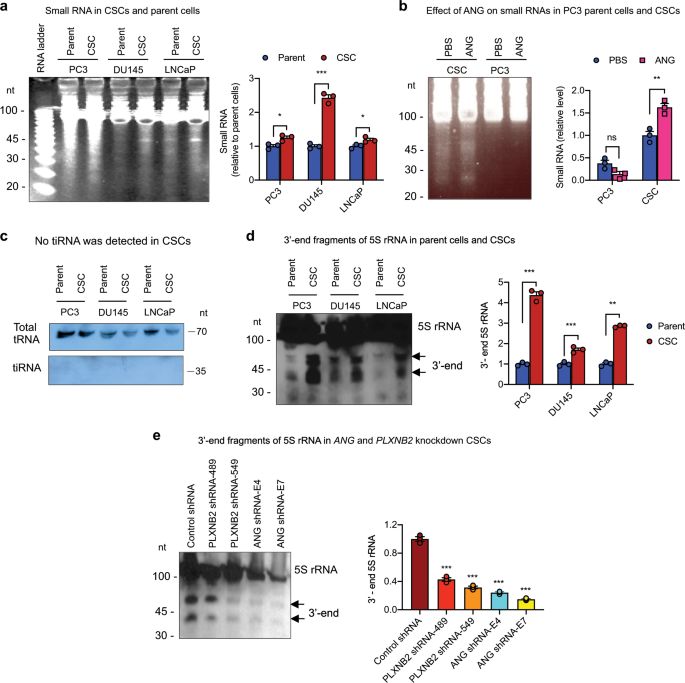
为了了解ANG维持CSC静止的机制,我们首先检查了ANG在CSC和PC3亲本细胞中的亚细胞分布差异,发现ANG转移到细胞核并在PC3亲本细胞的核仁中积累,据先前报道8,它主要位于应力颗粒中,并与CSC中的应力颗粒标记聚(A)结合蛋白(PABP)共定位(补充图 10)。ANG的应激颗粒积累已显示与tiRNA产生有关,并且是ANG限制HSPCs的蛋白质合成和细胞增殖的潜在机制6。然而,尽管我们确实发现CSC与它们的亲本细胞相比会产生大量的小RNA(<50 nt)(图 7a,补充图 11),外源性ANG可以进一步增强这种作用(图 7b,补充图 11),我们未观察到可检测量的tiRNA Gly GCC,这是一种在前列腺CSC中可导致ANG增强HSPC 6的自我更新和静止的tiRNA类型(图 7c,补充图 11)。
通过聚丙烯酰胺凝胶电泳和SYBR Gold染色分析了CSC和亲本细胞中的小RNA(n = 3)。带强度由图像J确定,并表示为相对于各个亲本细胞标准化的相对值。b ANG对CSCs和PC3细胞中小RNA产生的影响(n = 3)。通过图像J确定带强度,并表示为相对于PBS处理的CSC标准化的相对值。c tRNA-Gly-GCC的Northern印迹分析(n = 2)。d使用5S rRNA的3'端片段作为探针,对前列腺CSC和各个亲本细胞中的小RNA进行Northern印迹分析(n = 3)。带强度由图像J确定,并表示为相对于各个亲本细胞标准化的相对值。e通过Northern印迹分析,图像J量化并相对于对照shRNA转染子进行标准化的PLXNB2和ANG敲低CSC 中5S rRNA 3'末端片段的水平(n = 3)。* p <0.05;** p <0.01;*** p <0.001;ns不重要。
In order to determine which small RNA is responsible for ANG-regulated prostate CSC quiescence, we sequenced CSC-produced small RNAs and found that, among the 63 readable clones, 21 contained sequences from the 5S rRNA (Table 3, Supplementary Table 1). It is notable that most of the cleavages occurred at sites located in the β-domain of 5S rRNA (Supplementary Fig. 12), suggesting that the 3′-end fragment of the 5S rRNA remained relatively intact and might thus be functional. We therefore examined the abundance of small RNAs containing the 3′-end sequence of 5S rRNA by northern blotting and found that the amount of 3′-end fragments of 5S rRNA was higher in all three CSC lines as compared with the respective parent cells (Fig. 7d, Supplementary Fig. 11). Knockdown of either ANG or PLXNB2 decreased the level of the 3′-end fragment of 5S rRNA (Fig. 7e, Supplementary Fig. 11), suggesting that ANG and its receptor PLXNB2 are responsible for the production of 5S rRNA fragments in CSCs.
3′-end 5S rRNA fragment enhances stemness of CSCs
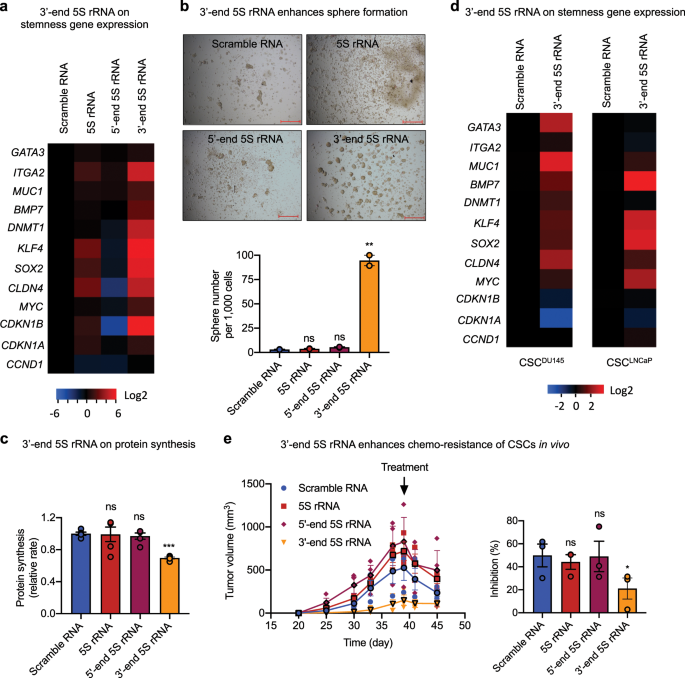
为了了解5S rRNA的3'端片段是否调节CSC干性,我们构建了表达3'端5S rRNA片段(47 nt)以及5'端5S rRNA片段(47 nt)的质粒。长度的5S rRNA(120 nt)和加扰的RNA(47 nt)作为对照,将它们转染到CSC中,并检查了结果导致的茎干变化。在表达3'端5S rRNA片段时,PC3 CSCs显示出茎相关基因的表达升高(图 8a),球形成增强(图 8b)和蛋白质合成降低(图 8c)。在表达3'-端5S rRNA片段的DU145和LNCaP细胞系的CSC中也观察到了干性相关基因的增强表达(图 8d)。一致地,我们发现在NSG小鼠中表达5S rRNA 3'末端片段的CSC比表达5S rRNA 5'末端片段,完整的5S rRNA或加扰对照RNA的CSC的生长更慢(图 8e)。源自表达5S rRNA 3'端片段的CSC的肿瘤对DTX的耐药性更高。每公斤DTX给予30 mg抑制约50%来自表达对照RNA,完整5S rRNA或5S rRNA 5'末端片段的CSC的肿瘤,但它抑制源自表达3'末端的CSC的肿瘤5S rRNA的片段只有20%(图 8e),表明CSC肿瘤具有更多的化学抗性表型,过表达5S rRNA的3'末端片段。
各种小RNA的稳定CSC转染子中茎相关基因的 mRNA水平(n = 3)。将值标准化以加扰RNA转染子。b各种小RNA(n = 2)的稳定CSC转染子的球形形成。比例尺:500μm。c通过OP-Puro掺入然后流式细胞术(n = 3)测量带有各种小RNA的CSCs稳定转染子中的相对蛋白质合成速率。d在DU145和LNCaP前列腺CSC的与加扰RNA控制的稳定转染干性相关基因mRNA水平和5S rRNA基因的3'端片段。Ë各种小RNA的CSC转染子的异种移植生长。在第39天,向NSG小鼠接种了100,000个CSC,这些CSC转染了杂乱的RNA,完整的5S rRNA,5S rRNA的5'-或3'-末端片段,并用单剂量30 mg / kg DTX(ip)处理。通过比较每组第45天和第39天的肿瘤体积,代表对DTX治疗产生的肿瘤生长抑制百分比。* p <0.05;** p <0.01;*** p <0.001;ns不重要。
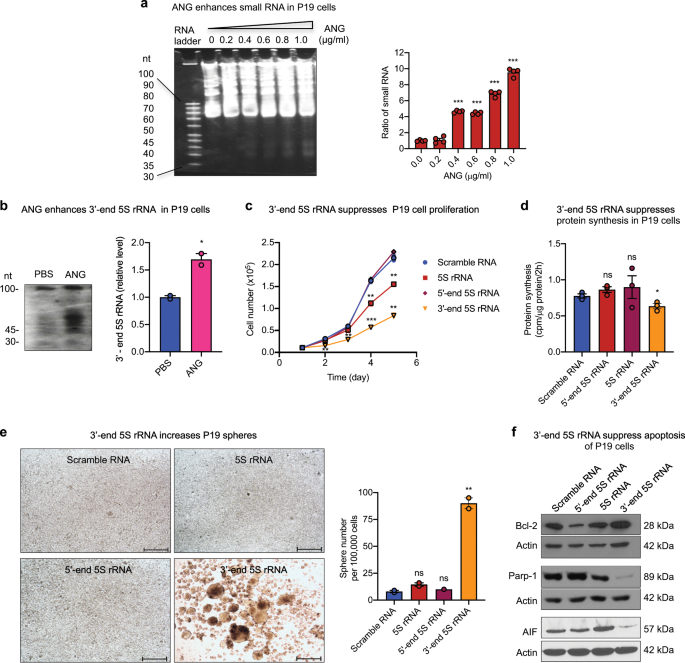
为了确定ANG是否还介导小RNA的产生以及5S rRNA的3'-端片段是否增强其他类型的CSC中的干性,我们研究了ANG在P19胚胎癌细胞(一种功能齐全的细胞系)中的作用已被证明具有多能CSC特性,并且能够分化为所有三个细菌层的细胞类型48。我们发现ANG能够以剂量依赖的方式增强P19细胞中总小RNA的产生(图 9a,补充图 13)以及3'-端5S rRNA片段的产生(图9a)。 图9b,补充图 13)。P19细胞中3'端5S rRNA片段的转染导致细胞增殖减少(图 9c)和蛋白质合成(图 9d),球体形成增加(图 9e),pro-表达增加。存活蛋白Bcl-2,以及Parp-1和凋亡诱导因子(AIF)的表达降低(图 9f,补充图 13)。这些结果表明ANG能够介导5S rRNA的过程,其中一种产物3'端5S rRNA片段能够增强P19细胞的干性,这表明ANG介导了生物活性3的产生。 5S rRNA的'端片段能够调节人和小鼠的CSC。
用不同浓度的ANG处理2小时的P19细胞中的小RNA。每个泳道上总共装载了20μgRNA。小RNA条带的强度通过图像J计算,并标准化为未处理的对照(n = 4)。b用PBS或ANG(1μg/ ml)处理2 h的P19细胞中5S rRNA 3'末端片段的Northern印迹分析。通过图像J确定45nt附近的条带强度,并标准化为PBS对照。c转染了混乱的RNA,完整的5S rRNA(5S rRNA的5'-或3'-末端片段)的P19细胞的体外增殖(n = 2)。d由3确定的各种小RNA的稳定P19转染子的蛋白质合成率[H]蛋氨酸的掺入(n = 3)。e各种小RNA的稳定P19转染子的球形形成。从24孔板的整个孔中计算球数,该孔包含在球形成培养基中培养24小时(n = 2)的100,000个细胞。比例尺:500μm。f在球形形成培养基中培养的各种小RNA的稳定P19转染子中,Bcl-2,裂解的Parp-1和AIF的免疫印迹。肌动蛋白在每个印迹中用作上样对照。* p <0.05;** p <0.01;*** p <0.001;ns不重要。
讨论区
这项研究的意义是多重的。首先,前列腺CSCs被分离并显示出具有自我更新,分化和启动肿瘤的能力,因此满足了真正的癌症干细胞的三个标准[ 35]。在这项研究中克隆的前列腺CSCs是高度静止的,能够在没有血清的情况下自我更新,可以在体外和体内分化为多种前列腺细胞谱系,并且能够通过单细胞接种来引发异种移植肿瘤。真实CSC的分离和验证不仅可以进行有关癌症干性维持和调节机制的研究,而且还为治疗耐药性和疾病复发提供了急需的实验模型。
其次,我们揭示了一种维持CSC干性的调节机制。我们发现抑制ANG和PLXNB2降低CSC干度并引起CSC衰竭。ANG-PLXNB2对前列腺CSCs和分化的大量癌细胞的二分调节在机制上是独特的。ANG维持CSC的静止和自我更新,同时促进分化的癌细胞的增殖,这两种功能都与癌症的进展和转移密切相关。
我们发现ANG主要位于CSCs的应激颗粒和分化的前列腺癌细胞的核仁中。发现ANG可以增强CSC中小RNA的产生。但是,我们没有在6中检测到太多的tiRNA 。取而代之的是,我们在CSC中观察到了大量5S rRNA的3'末端片段,这些片段可以通过外源ANG增加,而通过ANG或PLXNB2的敲低而减少。这项研究的可用数据表明,这是5S rRNA的生物活性3'端片段,而不是5S rRNA的减少,这促进了CSC的干性,因为完整5S rRNA的转染实际上稍微降低了CSC的增殖并降低了干性的表达,相关基因。此外,转染5S rRNA的3'端片段可大大提高CSC的干性,这体现在更高的G0细胞频率,干性相关基因的表达升高,蛋白质合成减少,细胞增殖减少,球体形成增加以及对化学疗法的抵抗力增强。3'端5S rRNA片段增强CSC干性的分子机制将是未来研究的主题。
第三个发现是ANG和PLXNB2 mAb可以减弱CSC的干性。ANG单抗26-2F的抗前列腺癌活性已充分证明17,49并曾作为验证的概念,ANG活性的抑制将是用于癌症治疗的有效手段8。最近,我们确定PLXNB2是功能性ANG受体,既是介导ANG的生理和病理活动所必需的又是足够的,并已显示PLXNB2 mAb阻止了PC3异种移植肿瘤的建立并抑制了已建立肿瘤的生长14。在这项研究中,由杂交瘤细胞培养物在内部制备的ANG和PLXNB2 mAb均显示出降低的纯度,均质(SDS-PAGE显示纯度> 99%),不含防腐剂或添加剂,例如叠氮化钠和甘油。 CSC通过增强循环和分化来阻止。此外,我们表明ANG和PLXNB2 mAb能够在体外和体内使CSC对DTX治疗敏感。值得注意的是,PLXNB2 mAb能够将DTX对CSC的IC50降低四倍,并且PLXNB2 mAb与DTX的联合治疗对DTX耐药CSC肿瘤具有协同作用,并在停止治疗后延缓疾病复发。50并导致耐药性和疾病复发。连同针对分化的大量癌细胞的强大的抗血管生成和抗增殖活性,ANG-PLXNB2抑制剂因此有望用于治疗去势难治性,耐药性和转移性前列腺癌。
方法
动物
NSG雄性小鼠(5-7周龄)是从杰克逊实验室购买的,并饲养在塔夫茨医学中心动物设施中的无菌笼子中,该动物设施已获得实验室动物护理评估和鉴定协会的认可,并由工作人员每天进行探访兽医。所有动物实验均获得塔夫茨大学/塔夫茨医学中心的机构动物护理和使用委员会(IACUC)的批准。所有程序均按照塔夫茨大学/塔夫茨医学中心的IACUC批准的规程执行。
在检查CSCs肿瘤起始能力的实验中,根据连续稀释的最佳估计,在50μlHBSS中制备了1至5000个CSCs不同剂量的细胞,并与等体积的Matrigel(Corning)混合,皮下接种到小鼠的侧腹区域(n = 8-10)。接种后3个月检查肿瘤。
在连续传代实验中,将50μlHBSS中的100,000个细胞(用对照shRNA,ANG shRNA E4和E7,PLXNB2 shRNA 489和549稳定转染的CSC)与等体积的基质胶混合,并皮下接种到NSG小鼠的后胁。接种后第4周,手术切除肿瘤,称重,在无菌HBSS中洗涤,反复用剃刀切碎切成3–4 mm的小块,并在1 ml的0.25%胰蛋白酶(Hyclone,GE)中孵育15分钟(在室温下) 37 °C.通过将细胞悬液滤过0.45μm网眼而去除组织纤维化以获得细胞悬液。将ACK裂解缓冲液(Sigma)添加到细胞沉淀中,并在冰上孵育5分钟以消耗红细胞。洗涤细胞并将其重悬于HBSS中,在台盼蓝染色后使用血细胞计数器计数细胞活力,并在NSG小鼠中连续传代3次。
In the experiment to examine chemo-sensitizing activity of PLXNB2 mAb, 10,000 CSCs per mouse was mixed with an equal volume of Matrigel and inoculated. Tumor appearance was examined by palpation. When the size of the tumors reached approximately 100 mm3, mice were randomized into 6 groups and treated with PBS control, 4.8 mg/kg mAb17, 10 mg/kg DTX, 30 mg/kg DTX, 10 mg/kg DTX + 4.8 mg/kg mAb17, and 30 mg/kg DTX + 4.8 mg/kg mAb17, by weekly i.p. injection. Tumor sizes were measured weekly and analyzed by one-way ANOVA followed by Newman–Keuls multiple comparisons test.
在检查用乱序RNA,完整5S rRNA转染的CSC的体内生长的实验中,将5S rRNA的5'-或3'-末端片段,每只小鼠100,000个细胞与等体积的Matrigel混合并接种。在第39天通过腹腔注射给予30 mg / kg DTX治疗。
细胞
人前列腺癌细胞系PC3(雄性),DU145(雄性)和LNCaP(雄性),小鼠胚胎癌细胞系P19(雄性)购自ATCC。PC3,DU145和P19细胞在DMEM(Sigma-Aldrich)+ 10%FBS(Mediatech)中培养。LNCaP细胞在RPMI1640(Corning Cellgro)+ 10%FBS中培养。人CD34 +脐带血细胞(混合性别,混合来源)购自Stem Cell Technologies,并在StemSpan SFEM(Stem Cell Technologies)中培养,并补充了干细胞因子,Flt3配体,IL6和血小板生成素(100 ng / ml,R&D Systems)。从PC3,DU145和LNCaP细胞克隆的CSC保持在DMEM:F12(1:1)加20 ng / ml EGF,20 ng / ml bFGF(Novus Biologics)和1x B27 Supplement(ThermoFisher Scientific)组成的球形培养基中细菌培养皿(圣克鲁斯)。所有细胞均在37°C下于5%CO 2增湿的条件下培养。通过锥虫蓝排除法测定细胞活力。每3个月使用e-Myco支原体PCR检测试剂盒(Lilif,Cat#25235)筛选细胞中的支原体污染情况。每年进行9个标记(Abmgood,目录号C287)的基于PCR的短串联重复序列(STR)分析,并与ATCC数据表进行比较,以鉴定PC3,DU145和LNCaP细胞的身份。
ANG和PLXNB2组合式
使用了pLKO.1-puro慢病毒载体-shRNA系统。为了敲低PLXNB2,使用了shRNA TRCN00003-00489(489)和−00549(549)(Sigma Mission)。序列为:489,5'-CCGGGCTCTACCAATACACGCAGAACTCGAGT TCTGCGTGTATTGGTAGAGCTTTTTG-3';549,5'-CCGGGCAGAAGTACTATGACGAG ATCTCGAGATCTCGTCATAGTACTTCTGCTTTTTG-3'。击倒ANG,使用shRNA慢病毒颗粒载体(pGIPZ)E4和E7(Open Biosystems)。序列为:E4,5'-ATGTTTGACAACATGTTTAATA-3';E7,5'-CAACGTTGTTGTTGCTTGTGAA -3'。非编码shRNA用作对照。按照VirPower慢病毒表达系统(Invitrogen),根据制造商的说明,通过在HEK 293细胞中瞬时转染制备慢病毒颗粒。72小时后收获慢病毒颗粒,以781× g离心 过滤15分钟,并通过0.45μmPVDF膜(Millipore)过滤。然后将病毒颗粒以83,000×g超速离心1.5 h,然后将沉淀重新悬浮在PBS中。将pGIPZ慢病毒颗粒与第二代包装质粒(psPAX2和pMD2.G)包装在HEK 293细胞中,并通过Lenti-X浓缩器(Clontech)进行浓缩。在存在Polybrene(8μg/ ml,Millipore)的情况下,用慢病毒颗粒感染细胞24小时。用完全生长培养基代替培养基并孵育24小时,然后用嘌呤霉素以6μg/ ml的CSCs和以0.5μg/ ml的Puromycin选择4天,以用于亲代细胞和P19细胞。
膜联蛋白V凋亡分析
按照制造商的说明,将膜联蛋白V-PE细胞凋亡检测试剂盒(eBioscience)用于细胞凋亡分析。简而言之,将细胞用冰冷的PBS洗涤,以1×10 6个细胞/ ml的浓度悬浮于100μl的1x结合缓冲液中,并与5μl的PE-缀合的膜联蛋白V在室温黑暗中孵育15分钟。用1x结合缓冲液洗涤后,添加300μl1x结合缓冲液以重悬细胞沉淀,以便在Cyan流式细胞仪上进行分析。细胞活力通过7-AAD确定。Annexin V阳性门控是通过Annexin V荧光--1对照建立的。
阵列分析
按照制造商的说明使用GeneQuery TM人干细胞转录因子qPCR阵列试剂盒(ScienCell,Cat#GK125)。用Trizol试剂(Thermo Fisher Scientific)提取来自100,000个细胞的总RNA,并将其反转录为cDNA。对于qPCR反应,每个孔使用总体积为20μl的混合物,其中包含2μl的20 ng /μlcDNA,10μl的SYBR Green PCR Mix和8μl的水。以GAPDH为对照,采用比较∆∆Cq(定量循环值)方法进行定量。
通过有限稀释克隆候选CSC
PC3,DU145和LNCaP细胞的单细胞培养物是通过在96孔板中以每孔100μl常规培养基进行有限稀释来制备的。包含两个或多个细胞的任何孔均排除在进一步研究之外。将板在正常培养条件下维持,直到单细胞的克隆大小达到〜200微米的2(〜1.5个月)。用Versene分离具有球形形成趋势的克隆(小细胞,重叠在圆形形态的簇中,松散地附着),并转移到含有1 ml球形形成培养基(DMEM:F12,1:1,含有20 ng / ml EGF,20 ng / ml bFGF和1x B27补充剂)并培养4个月。在这种培养条件下存活和扩增的克隆被进一步表征并检查其干性。为了使CSC通过,通过离心去除培养基,并将细胞沉淀物悬浮在100μl的Accutase(Innovative Cell Technologies)中,并在RT上频繁移液孵育7分钟,离心并重悬于新鲜的球形培养基中,在室温下分离。比例为1:2,并在细菌培养皿中培养。
细胞周期分析
使用Cytofix / Cytoperm固定/通透试剂盒(BD)固定并通透细胞(1×10 7),并用抗人Ki-67-PE(eBioscience,Cat#12-5698-80,1:20在PBS +中染色)染色2%FBS),并使用Cyan流式细胞仪进行分析。DNA含量通过7-AAD测量。
细胞转染
使用Lipofectamine LTX DNA Transfection Reagents(Life Technologies)按照制造商的规程,将0.75μg靶基因构建体和0.5μgpBABE-puro(Addgene)质粒的混合物转染到24孔板中培养的细胞中。嘌呤霉素(生命技术公司)用于选择稳定的转染子,对于CSCs为6μg/ ml,对于PC3和P19细胞为0.5μg/ ml。CSC,PC3和P19细胞的稳定转染子分别保存在含有2、0.2和0.5μg/ ml嘌呤霉素的培养基中。对于DU145和LNCaP的CSC,在转染后72小时收获表达瞬时RNA对照和5S rRNA 3'端片段的质粒的瞬时转染子,并用于实验。
小RNA的克隆和测序
按照制造商的说明,通过ExactSTARTTM小RNA克隆试剂盒(Epicentre Biotechnologies)富集小RNA。从200μg总RNA中富集单链小RNA,先用碱性磷酸酶(Fermentas)处理,再用T4多核苷酸激酶(Fermentas)处理,以将任何可能的5'-羟基和3'-单磷酸酯末端转化为5'-单磷酸和3' -羟基末端。在3'末端添加poly(A)尾巴并将5'-单磷酸酯末端的含有PCR引物位点和Not I限制性位点的小RNA受体寡核苷酸连接后,将修饰的单链小RNA用作小RNA cDNA合成引物合成第一链cDNA的模板,该模板由oligo(dT)序列,PCR引物位点和Asc组成I(Biolabs)限制性酶切位点位于5'端。进行PCR以产生cDNA的第二条链并扩增双链cDNA以用于随后的克隆。用核酸内切酶Asc I和Not I 消化双链cDNA ,通过凝胶纯化回收,并连接至预先切割的pCDC1-K载体。然后将连接混合物转化到大肠杆菌 DH5α中。选择单个克隆并测序。
竞争性植入分析
在移植前16小时,对亚组(NSG)小鼠进行次致死性照射(2.5 Gy)。将来自混合供体的人CD34 +脐带血细胞在PBS中清洗一次,并将每只小鼠10,000个细胞静脉内注射到NSG受体中(n = 6)。雄性和雌性小鼠均用作受体。移植后16周,处死受体NSG小鼠并收集骨髓细胞。用人CD45太平洋蓝(Biolegend,Ca#304021)对贫血的红细胞骨髓单核细胞(BMMNC)进行染色,并通过流式细胞仪(FACSAria)进行分析,以证实人CD34 +细胞成功植入。来自第一只移植受体小鼠的BMMNCs被用作第二次移植实验的供体细胞。总共5×10 5将每位接受者的BMMNCs静脉内注射到12位经小剂量照射(2.5 Gy)的NSG接受者中。移植后第2周,将NSG受体随机分为两组(每组六只小鼠),并向静脉内注射500,000稳定的GFP转染的CSC或PC3的母细胞。再过4周后,在冰上以1:200的稀释度用小鼠CD45 APC-e780(eBioscience,目录号47-0451-82)对贫红细胞的BMMNCs进行表面染色,在黑暗中进行30分钟。使用BD LSRII流式细胞仪分析样品。获取GFP荧光信号以测量PC3亲代细胞和CSC的植入。
5S rRNA片段表达质粒的构建
使用pAAV-siRNA(Applied Viromics)载体表达5S rRNA片段。通过退火互补序列的两条单链寡核苷酸链来制备双链DNA。单链DNA的序列如下。扰乱RNA控制:正向5'-tttGGCTCTAGTCTGCTCTAGCCCGCGCAAGTCCCACCATACCGGCATCTGtttt-3',反向5'-gttacaaaaCAGATGCCGGTATGGTGGGACTTGCGCGGGCTAGAGCAGACTAGAGC-3'。5S rRNA的5'端片段:正向5'-tttGTCTACGGCCATACCACCCTGAAC GCGCCCG ATCTCGTCTGATCTCGGtttt-3',反向5'-gttacaaaaCCGAGATCAGACGAGATCGGGCG CGTTCAGGGTGGTGTATGGCCGTAGA-3'。5S rRNA的3'端片段:正向5'-tttGAGTACTTGGATGGGAGACCGCCTGGGAATACCGGGTGCTGTAGGCTTtttt-3,反向5'-gttacaaaaAAGCCTACAGCACCCGGTATTCCCAGGCGGTCTCCCATCCAAGTA CT-3'。5S rRNA:正向5'-tttGTCTACGGCCATACCACCCTGAACGCGCCCGATCG 通过混合等量的两种寡核苷酸并在95°C下加热,将具有互补序列的两个合成寡核苷酸退火以形成双链DNAo C 2分钟,然后冷却至室温。将双链DNA连接到用BstE II和Bbs I 预先切割的pAAV-siRNA载体上,并转化到大肠杆菌 DH5α中。使用U6引物(5'-GAGACTATAAATATCCCTTGGAG-3')或反向引物(5'-AGAGAGGGAGTGTGCACA-3')通过DNA测序确认插入片段的序列。
干细胞标记的流式细胞仪分析
用胰蛋白酶-EDTA分离细胞,用冰冷的PBS洗涤,以每150μl1 ×10 6个细胞的浓度悬浮在含2%FBS的PBS中,并用抗hCD133-PE染色(Miltenyi Biotec,目录号130-111- 1:79稀释的079),1:160的抗hCD49f-PE(eBioscience,目录号12-0495-83),1:1的抗hCD44-FITC(Miltenyi Biotec,目录号130-113-903) 100,抗hCD326 FITC(Bio-Rad,Cat#MCA1870F)在黑暗中在冰上20分钟的1:100。将染色的细胞用PBS + 2%FBS以350× g洗涤两次, 并悬浮在300μlPBS + 2%FBS中,以便在Cyan流式细胞仪上进行分析。对于CD24和Trop2,使用未偶联的一抗(eBioscience,目录号14-0247-82和14-6024-82;)以1:100稀释度使用,然后使用山羊F(ab')2的 PE偶联物抗小鼠IgG(eBioscience,Cat#12-4010-82)的稀释度为1:125。PI或7-AAD用于排除死细胞。对于ALDH分析,使用ALDEFLUOR TM试剂盒(Stemcell Technologies)。简而言之,将1 ml 1×10 6细胞与5μl活化的ALDEFLUOR TM试剂混合,立即将一半细胞(0.5 ml)移液至含有5μlDEAB试剂的对照管中,然后将两个管在细胞培养箱45分钟。然后用ALDEFLUOR TM缓冲液洗涤细胞,并以350× g离心 5分钟。将细胞沉淀物悬浮在0.5 ml ALDEFLUOR TM缓冲液中,用于在Cyan流式细胞仪上进行分析。
免疫荧光
用胰蛋白酶消化细胞,并在盖玻片上将其培养,盖玻片置于含有10%BSA的PBS中的48孔板中过夜。将细胞在-20°C的甲醇中固定10分钟,在30°C的30 mg / ml BSA中封闭30分钟,然后与流动的抗体,小鼠抗人CK18 mAb(DC10,Cell Signaling,Cat 1:500稀释度的#4548),兔抗人CK5 mAb(EP1601Y,Novus Biologicals,目录号NB110-56916)1:200,兔抗人SYP mAb(SP15,Enzo Life Science,目录号ADI-VAM) -SV011-F)(1:400),兔抗人ANG多克隆IgG R113(自制)和10μg/ ml小鼠抗PABP mAb(10E10,Abcam,目录号ab6125)在4°C下于5%的含5%BSA的PBS中过夜。用含5%BSA的PBS洗涤3次后,每次10分钟,将细胞与山羊F(ab')2一起孵育抗小鼠IgG-Alexa Fluor 555(Invitrogen,Cat#A21425)或山羊F(ab')2抗兔IgG-Alexa Fluor 488(Invitrogen,Cat#A-11070)在37°C下于1:400 1小时 将盖玻片用带有DAPI的Prolong Gold抗褪色剂(分子探针)固定在载玻片上,并在Nikon eclipse Ti荧光显微镜上拍摄荧光图像。
免疫组织化学
将福尔马林固定的石蜡包埋的肿瘤切片脱蜡并通过在60°C加热40分钟再水合,然后分别在100%,95%,90%,80%和70%的二甲苯乙醇溶液中孵育5分钟。在冷自来水中洗涤后,将玻片完全浸入装有沸腾柠檬酸钠缓冲液(10 mM柠檬酸钠,0.05%Tween 20,pH 6.0)的烧杯中,并在微波中煮沸20分钟以回收表位。将载玻片用含0.025%Triton X-100的TBS洗涤两次,在室温下于含1%BSA的TBS中的10%山羊正常血清中封闭2 h,并在湿润的培养箱中与稀释于含1%BSA的TBS中的一抗孵育在黑暗中于4°C过夜。抗BCL-2(Cat#15071),p53(Cat#9282),裂解的半胱天冬酶6(Cat#9761)的抗体,裂解的p-PARP(Cat#9548)来自Cell Signaling Technology,以1:400的稀释度使用。抗Ki-67(EMD Millipore,目录号AB9260)的多克隆抗体以1:300的稀释度使用,抗PLXNB2 mAb17(内部疯狂使用)的浓度为5μg/ ml。室温下,在TBS中用0.3%过氧化氢封闭内源酶15分钟。将山羊抗兔IgG-HRP(Bio-Rad,Cat#1706515)或山羊抗小鼠IgG-HRP(Bio-Rad,Cat#1706516)在含有1%BSA和在室温下孵育1小时。根据制造商的说明,使用过氧化物酶底物试剂盒DAB(Vector Laboratories,Inc.)开发信号。一抗的特异性通过免疫印迹确认。通过用同种型IgG对照替代一抗来确认二抗的特异性。苏木精用于复染细胞核。将玻片脱水,并使用SP15-500甲苯溶液(Fisher)用盖玻片固定。图像由尼康蚀钛显微镜拍摄。
Northern印迹分析
通过变性尿素聚丙烯酰胺凝胶电泳分离并分离总RNA,并在4°C下于80 V的预冷0.5X TBE中转移至Pall Biodyne尼龙膜(Promega)中60分钟。通过用SYBR Gold对凝胶进行转移后染色来确认转移效率。将膜在2X SSC缓冲液中冲洗,并在248 oC烘烤固定 F放置30分钟,并在室温下于透明保护纸之间存放。印迹之前,将膜在预热的地高辛(DIG)Easy Hyb缓冲液(Roche)中于50°C旋转漂洗30分钟,然后在含有热变性DIG标记DNA探针(IDT)的DIG Easy Hyb缓冲液中杂交浓度为25 ng / ml。HPLC纯化的DIG标记的探针的序列如下。5′-tiRNA Gly-GCC:5′-GGCGAGAATTCTACCACTGAACCACCACC-3′,5S rRNA的3′端片段:5′-AAGCCTACAGCACCCGGTATTCCCAGG-3′,5S rRNA的5′端片段:5′-TCGGCGCGTTCAGGGTGGTATGGCCG-3′。杂交过夜后,将膜在60°C的2X SSC + 0.1%SDS中漂洗10分钟,在60°C的0.5X SSC + 0.1%SDS中漂洗20分钟两次,并在洗涤缓冲液(Roche)中漂洗5分钟。在室温下在杂交箱中(VWR Scientific)。o C,并暴露于放射自显影胶片(Labscientific,Inc.)。
通过[ 3 H]甲硫氨酸掺入进行蛋白质合成
将P19细胞在DMEM + 10%FBS中的24孔板中培养,用不含蛋氨酸/半胱氨酸的DMEM洗涤,并提供新鲜制备的含有[ 3 H]蛋氨酸的培养基,蛋氨酸/半胱氨酸的终浓度为0.23 mCi /μmol。 -无DMEM 2小时。孵育结束时,将细胞在含1 mg / ml未标记蛋氨酸的PBS中洗涤两次,并在0.4 ml RIPA缓冲液(20 mM磷酸钠,150 mM NaCl,5 mM焦磷酸钠,5 mM EDTA,1%Triton)中裂解X-100、0.5%脱氧胆酸钠,1 mM原钒酸钠,0.1%SDS,pH 7.4)补充1片/ 10 ml的完全mini-EDTA蛋白酶抑制剂混合物(Roche)和1%BSA在冰上20分钟。裂解物以12,000× g离心 在15分钟内,取等分的10μl上清液用于通过Bradford测定法测量蛋白质浓度,通过TCA以10%的终浓度在4℃下沉淀剩余的裂解物10分钟。通过在4°C下以12,000× g离心30分钟来收集蛋白质沉淀 ,将其重悬于50μl的0.2 M NaOH中,并通过液体闪烁计数测量放射性。
通过OP-Puro结合进行蛋白质合成分析
前列腺CSCs和亲代细胞中的蛋白质合成率使用OP-Puro掺入法进行测定,然后如前所述进行流式细胞术6。简而言之,将细胞以终浓度为50μM的OP-Puro(Medchem Source)在含有或不含有30μg/ ml mAb的常规培养基中于37°C培养1 h。孵育结束时,用胰蛋白酶消化细胞(CSC球和附着的亲本细胞)并用Ca 2+和Mg 2+洗涤一次-无PBS,在冰上用1%多聚甲醛(Affymetrix)固定15分钟,用PBS洗涤一次,然后在室温下用3%FBS和0.1%皂苷(Sigma)透化5 m。将Click-iT细胞反应缓冲液试剂盒(Life Technologies)按照制造商的说明用于AF488共轭叠氮化物(5μM,Life Technologies)的叠氮化物-炔烃环加成反应。将细胞在PBS + 2%FBS中洗涤两次,重悬于300μlPBS + 2%FBS中,并在Cyan流式细胞仪上进行分析。FlowJo用于计算几何平均值。
PSA测量
CSCs和亲本细胞在35mm皿中的DMEM + 10%FBS中以每皿50,000的接种密度培养24小时。收集培养基,并通过ELISA(MyBioSource)测定PSA的量。起始和终止细胞数的平均值用于计算每个细胞的PSA分泌。
qRT-PCR analyses
Total RNA was extracted using TRIzol RNA reagent (ThermoFisher). Total RNA (1 μg) was reverse-transcribed in a 25 μl volume system containing M-MLV reverse transcriptase (Promega) and Oligo dT primer or random primers (IDT). qRT-PCR analysis was performed on a LightCycler 480 II (Roche) using SYBR Green PCR mix (Roche). Relative expression was determined by the 2−ΔΔCt method, and heat-map was plotted using log2 (fold of change) by RStudio (http://www.rstudio.com). GAPDH and glucose-6-phosphate isomerase (GPI) were used as housekeeping gene controls. See Supplementary Table 2 for primer information.
Small RNA gel electrophoresis
总RNA通过TRIzol提取,并通过NanoDrop(Thermo Scientific)定量。在Novex TBE-尿素样品缓冲液(Invitrogen)中稀释总共20μgRNA,在65°C加热5分钟,然后冷却至室温,然后上样。同时加热和冷却低分子量标记阶梯(10–100 nt,Affymetrix)。将15%TBE-尿素凝胶(Invitrogen)在74 V下预运行60分钟,将样品上样并在1x TBE运行缓冲液中以100 V电泳至凝胶底部。将凝胶用SYBR Gold溶液(Invitrogen)在搅拌下染色60分钟,并在具有UV照明的柯达电泳文献和分析系统120上成像。
软琼脂菌落形成
将细胞(1250)在球形培养基中的0.5ml 0.3%琼脂糖中混合,并接种到预先涂有0.5%琼脂的24孔板上。将板在37℃下孵育2小时,每孔添加0.25ml新鲜培养基,并每4天添加0.25ml新鲜培养基孵育15天。在实验结束时使用解剖显微镜对菌落数进行计数。通过使用尼康Eclipse Ti显微镜拍摄菌落的照片。
球体入侵
如46所述,通过悬滴法检查了PC3和CSC的侵袭。简而言之,将单细胞悬液(在30μl球形培养基中的50,000个细胞)在100毫米培养皿的盖子上培养2天。收集球体并与包含1.5 mg / ml胶原蛋白(BD)和0.15 mg / ml层粘连蛋白(Sigma)的预冷培养基(DMEM + 10%FBS)混合。当凝胶仍处于液相时,将50μl包含单个球状体的混合物转移到96孔板中。凝胶固化后,加入100μl完全培养基。为了进行定量,在半径为球体的1.5倍的区域中对活跃的浸润细胞的数量进行计数。通过连接最远的入侵细胞,通过图像J测量总侵袭面积。
肿瘤球形成
将前列腺CSC或亲本细胞(1000–10,000)接种在35毫米细菌培养皿中的2 ml球形培养基中,并培养7天。将P19细胞(100,000个细胞/ 24孔板的每个孔)接种在0.5 ml球形形成培养基中24小时。在实验结束时使用解剖显微镜对肿瘤球的数量进行计数。使用Nikon Eclipse Ti显微镜拍摄球面图像。
TUNEL测定
根据制造商的说明,通过原位细胞死亡检测试剂盒(Roche)确定肿瘤组织中的细胞凋亡率。将福尔马林固定的石蜡包埋的肿瘤切片脱蜡并通过在60°C加热40分钟再水化,然后分别在100%,95%,90%,80%和70%的二甲苯乙醇溶液中孵育5分钟,在PBS中冲洗,透化在新鲜制备的0.1%Triton X-100、0.1%柠檬酸钠溶液中溶解8分钟,然后再次用PBS冲洗。加入TUNEL反应混合物(50μl),并在黑暗中于37℃下在潮湿的室内温育60分钟。同时建立阴性对照并以相同的程序处理。将载玻片用PBS冲洗3次,并使用防褪色固定液用盖玻片固定,并在Nikon Eclipse Ti荧光显微镜下进行分析。检测细胞凋亡率,2×10将100μlPBS中的6个细胞与100μl4%PFA在室温下混合60分钟,用PBS洗涤一次,在新鲜制备的0.1%Triton X-100、0.1%柠檬酸钠溶液中在冰上透化2分钟,洗涤两次加入200μlPBS,重悬于50μlTUNEL反应混合物中,并在黑暗中于37°C的潮湿箱中孵育60分钟。
蛋白质印迹分析
通过SDS-PAGE分离总共20μg的蛋白质,并将其电转移到Towbin系统缓冲液中的硝酸纤维素膜上。膜用TBST中的5%无脂牛奶封闭,并与一抗在4°C孵育过夜,然后与适当的二抗(山羊抗兔IgG-HRP或山羊抗小鼠IgG-HRP)孵育(Bio-Rad)在室温下放置1小时。使用了以下抗体:2μg/ ml的ANG多克隆抗体R113(内部制造),2μg/ ml的PLXNB2 mAb mAb17(内部制造),AIF多克隆抗体(Cell Signaling,目录号4602)在1:1000处裂解,在1:1000处裂解PARP-1兔mAb(Cell Signaling,目录号5625),在1:1000处裂解Bcl-2兔mAb(Cell Signaling,目录号3498)和β-肌动蛋白mAb(Santa稀释度为1:600的Cruz,Cat#sc-47778)。
统计和可重复性
对于免疫印迹,使用图像J(NIH)量化条带强度。将多个独立实验标准化并平均,给出平均值和标准偏差。生物和技术重复用数字n表示。对于qRT-PCR分析,以GPI或β-肌动蛋白作为内部对照,使用2- ΔΔCt方法定量相对表达。误差棒代表标准偏差。除非另有说明,否则所有热图(RStudio,http ://www.rstudio.com )均表示2-4个独立实验的平均值。不成对的两尾学生t测试(Prism 7)用于比较两个实验组。使用单向方差分析和Newman–Keuls多重比较测试对多个组进行比较(SPSS v20)。没有对任何数据或受试者使用特定的纳入和排除标准。没有使用任何方法来确定数据是否符合统计方法的假设。对于所有分析,* P < 0.05;** P < 0.01;*** P < 0.001;ns不重要。
报告摘要
链接到本文的《自然研究报告摘要》中提供了有关研究设计的更多信息 。