T细胞贫血单倍HSCT后给予ATIR101可以减少NRM并改善急性白血病的总体生存率
T细胞贫血单倍HSCT后给予ATIR101可以减少NRM并改善急性白血病的总体生存率
摘要
异体造血干细胞移植(HSCT)后,克服移植物抗宿主病(GvHD)而不增加复发率和严重感染是一项重大挑战。ATIR101是一种单倍型,幼稚的富含细胞的T细胞产品,可去除受体同种反应性T细胞,从而最大程度降低GvHD的风险,并提供移植物抗感染和白血病活性。在对23例急性白血病患者进行的2期多中心研究中,评估了T细胞耗竭的T细胞单倍HSCT(TCD-haplo + ATIR101)无移植后免疫抑制剂后施用的ATIR101的安全性和有效性,并将其与仅接受TCD-haplo的观察性队列进行了比较(n = 35),匹配的无关供体(MUD; n = 64),不匹配的无关供体(MMUD; n = 37)和脐带血(UCB;n = 22)HSCT。使用TCD-haplo + ATIR101的主要终点为6个月的非复发死亡率(NRM)为13%。HSCT一年后,TCD-haplo + ATIR101导致NRM低于单独的TCD-haplo(P = 0.008)。与MMUD和UCB相比,TCD-haplo + ATIR101的无GvHD,无复发生存率(GRFS)更高(均P <0.03; 1年率:分别为56.5%,27.0%和22.7%),与MUD(1年:40.6%)无统计学差异。具有高第三方反应性的ATIR101移植物与较少的临床相关病毒感染相关。结果表明,单倍体选择性供体细胞耗竭可以消除对移植后免疫抑制剂的需求,而不会增加GvHD风险,GRFS与MUD相似。根据这些结果,已经开始了一项相对于移植后环磷酰胺的随机3期试验。
介绍
尽管最近取得了翻译方面的成就,同种异体造血干细胞移植(HSCT)仍然是大多数高危血液系统恶性肿瘤唯一确定的治疗选择[ 1 ]。与人类白细胞抗原(HLA)匹配的供体是降低移植物抗宿主病(GvHD)风险的首选。尽管如此,匹配无关供者(MUD)的及时供应,慢性的GvHD(慢性GVHD),和高复发率的高发仍知名障碍成果整体提高异体移植[后2,3]。由于大多数患者有多个潜在半相合家庭捐助者的最新进展在这两个T细胞充满和T细胞耗尽半相合造血干细胞移植已经克服了供体短缺,现在挑战的标准使用匹配的造血干细胞移植,而不会影响结果[ 4,5,6,7,8,9,10,11,12,13,14 ]。移植后环磷酰胺(PTCY)体内对同种异体反应性T细胞的耗竭是单倍性HSCT的最常用方法,尽管使用了免疫抑制和复发,但严重的GvHD仍会发生[仍是一个令人担忧的问题[15,16,17,18,19 ]。
在广泛的体内和离体T细胞耗竭发展之后,单倍体HSCT在1990年代初变得可行,从而在没有严重GvHD的情况下允许跨主要HLA差异稳定植入[ 15 ]。尽管如此,总体预后很差,对供者淋巴细胞的非选择性枯竭导致复发和感染[率高15,20 ]。这种历史性的方法导致了策略的发展,允许重新引入不同来源的T细胞以改善移植后的免疫重建,包括使用α-βT细胞-CD19移植物耗竭的γ-δT细胞,使用CD45RA耗竭的记忆细胞或输注未选择的T细胞在自杀基因(如诱导型caspase-9或胸苷激酶)的控制下[21,22,23,24,25,26,27 ]。尽管这些努力有助于减少移植并发症,但尚无用于单倍体HSCT的标准方法,仍然需要改善对感染,GvHD和复发的控制。
这里,ATIR101用作选择性耗尽接收者同种异体反应性T细胞的供体来源,T淋巴细胞富集制剂以最小化GvHD的风险并保持抗感染和抗白血病活性[ 28,29,30,31,32,33 ]。通过离体使用TH9402和光耗竭,ATIR101在生物上耗尽了宿主反应性供体T细胞[ 29 ]。在高风险患者中,T细胞耗竭的单倍性HSCT继之以ATIR101(TCD-haplo + ATIR101)的1期研究证明了ATIR101的安全性。最高剂量为5.0×10 6 CD3 +时未观察到3/4级急性GvHD(aGvHD)细胞/千克 在0.3–2.0×10 6细胞/ kg的较低剂量下,1年时无严重感染,与移植相关的死亡率为0%,8年后稳定生存率为67%[ 34 ]。因此,在这项单臂,关键和多中心的2期研究(CR-AIR-007)中,评估了在TCD-haplo后以2.0×10 6 CD3 +细胞/ kg 剂量使用ATIR101的安全性,可行性和功效。
根据监管机构的建议,一项观察性登记研究(CR-AIR-006)作为对照,并提供了无ATIR101的MUD,不匹配的无关供体(MMUD),双脐带血(UCB)和TCD-haplo HSCT的结果。在这项研究中,与单独使用TCD-haplo相比,在TCD-haplo中添加ATIR101显着改善了结局。有趣的是,在没有移植后免疫抑制剂的情况下,较低的aGvHD和cGvHD频率以及较低的复发率导致1年无GvHD,无复发生存(GRFS)与MUD HSCT没有显着差异。ATIR101细胞的评估也证明了幼稚的T细胞富集。此外,供体T细胞中抗第三方反应性水平的升高(可能表明“ T细胞适应性”)与严重病毒感染率降低相关。
方法
学习规划
CR-AIR-007被设计为关键的第二阶段,单臂,探索性,开放标签和多中心研究,旨在评估ATIR101在欧洲和北美中心接受TCD-haplo的患者中的安全性,可行性和有效性(“ ATIR101研究”; NCT01794299)。主要终点是HSCT后6个月的非复发死亡率(NRM),其定义为除疾病复发或进展以外的原因引起的死亡,或与移植无关的其他原因。计划进行临时分析,以分析何时有十名患者接受ATIR101治疗,并在HSCT后随访6个月。如果HSCT后6个月内的NRM病例数在接受ATIR101的前23例患者中,前10例中有6例超过6例,则应停止患者应计。次要终点包括:免疫重建;NRM;复发相关死亡率(RRM);总体生存率(OS);无进展生存期(PFS);直到2年随访结束时,aGvHD,cGvHD和感染的发生率和严重性。
CR-AIR-006是根据监管机构的建议而设计的,作为一项观察性注册表研究(“对照研究”; NCT02188290),旨在提供有效,相关的外部对照组,与未经随机分组的ATIR101治疗的患者进行比较。因此,采用了受限的队列设计,以使观察性研究的设计适应随机对照试验的原则(通过确定基线以确定患者的资格,使用与ATIR101研究相似的纳入/排除标准,并通过调整相关性预后因素和使用类似于在随机对照试验中所使用的统计方法)[ 35,36]。数据中心作为HSCT国际注册中心(例如EBMT或CIBMTR)的一部分,前瞻性地收集了数据。目的是在基于Web的数据库系统(ProMISe)中的每个中心提供一个完整的匿名清单,列出所有符合入选/排除标准的合格患者。NRM(如ATIR101研究中定义为不能归因于疾病复发或进展的死亡),RRM,OS,PFS以及GvHD的发生率和严重程度是该对照研究的终点,计划随访1年HSCT之后。GRFS是两项研究的事后综合探索性终点(请参阅补充信息)[ 37 ]。
年龄在18-65岁之间的急性髓细胞性白血病或急性淋巴细胞性白血病缓解或患有骨髓增生异常综合征且未进行干细胞移植的患者均符合两项研究的条件。有关更多详细信息,请参见补充信息。
ATIR101研究(CR-AIR-007)
在没有及时可用的合适供体的情况下,具有单性供体在未共享单倍型的HLA-A,-B和/或-DR位点有两个或三个错配的患者,需要进行ATIR101研究。
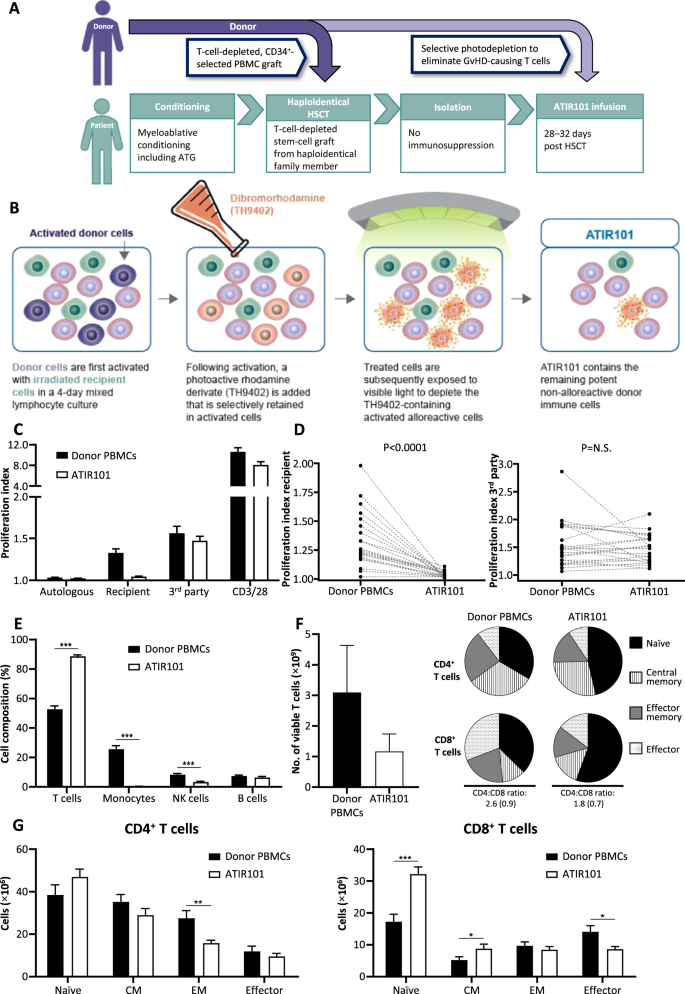
在供体粒细胞集落刺激因子治疗和移植物收集之前,通过单采血液分离术获得供体和患者外周血单核细胞(PBMC)以生产ATIR101,如图 1b和补充信息所述。根据中心程序(补充信息)进行供体外周血干细胞移植物的收集和制备。所有患者均接受噻替帕,氟达拉滨,抗胸腺细胞球蛋白,全身照射或美法仑清髓治疗(图 1a;补充信息)。没有患者接受HSCT术后免疫抑制剂GvHD预防。植入定义为连续两天中性粒细胞≥0.5×10 9 / L,血小板≥20×10 9/ L连续三天,无输血。
一个患者ATIR101治疗原理概述。获得供体和患者PBMC,以及供体血浆,以生产ATIR101。此后,将同一供体用G-CSF处理以动员干细胞并收集移植物。然后,患者接受包括ATG在内的清髓性调理,然后进行CD34 +选择移植物的HSCT 。计划在HSCT后28-32天输注ATIR101。患者不接受移植后免疫抑制。bATIR101的制造过程示意图。通过单采术收集供者和患者的淋巴细胞,并通过密度梯度进行分离。然后仅照射患者淋巴细胞,并与供体淋巴细胞一起培养4天。在此期间,由于患者细胞上存在“外源” HLA,供体抗宿主同种异体反应性T细胞被激活。接着,将4,5-二溴罗丹明甲酯(TH9402)加入培养物中。由于低P-糖蛋白活性,TH9402被选择性地保留在活化的细胞中,这导致其被挤出到外界环境中。暴露于光后,染料被激活,成为活性氧的来源,高浓度导致细胞凋亡。剩余的细胞被注入患者体内(ATIR101)。改编自图:https://www.kiadis.com/products-and-technology/(于2019年5月访问)。c基于CFSE的增殖测定法,以计算响应各种刺激的T细胞增殖指数。未经处理的供体PBMC(黑色条)和ATIR101细胞(白条)用(1)放射自体供体PBMC刺激,通过添加可能提供“饲养效应”的细胞来确定基线增殖;(2)照射受者PBMC,以确定受者特定的活动;(3)照射第三方细胞以确定针对无关HLA的活性;(4)用抗CD3 / CD28珠来确定T细胞的整体增殖能力。数据表示为平均值±平均值的标准误。d个体供体PBMC和相应的ATIR101细胞在暴露于受辐照的受体T细胞(左)和第三方(右)细胞后的T细胞增殖指数。e通过流式细胞术比较ATIR101(白色条形)与供体PBMC(黑色条形)中T细胞,单核细胞,NK细胞和B细胞的平均比例(平均值的标准误)。f通过流式细胞术和理论上等效体积的ATIR101,在供体PBMC起始体积中活T细胞的平均绝对数(平均值的±标准误)。饼图:CD4 +和CD8 +的平均比例(%)天真(黑色),中央记忆(条纹),效应器记忆(灰色)和效应器(点)T细胞以及通过流式细胞术检测的供体PBMC和ATIR101的平均CD4:CD8比(标准差)。g天真,CM,EM和效应T细胞的CD4 +和CD8 +的平均绝对数(平均值的±标准误)。该图显示了在2×10 6 CD3 +细胞/ kg剂量的ATIR101中注入的每种细胞类型的绝对数量(白色条)和在2×10 6 CD3 +细胞/ kg的供体PBMC中代表的等效样品中注入的每种细胞的绝对数目(黑色条) )。* P <0.05,** P <0.01,*** P 与供体PBMC相比,ATIR101的<0.001。ATG抗胸腺细胞球蛋白,CFSE羧基荧光素琥珀酰亚胺酯,CM中枢记忆,EM效应记忆,G-CSF粒细胞集落刺激因子,GvHD移植物抗宿主病,HLA人白细胞抗原,HSCT造血干细胞移植,NK自然杀手,NS不明显,外周血单个核细胞PBMC。
ATIR101研究中ATIR101和供体PBMC的表征
ATIR101和供体的PBMC的表征包括表型分型T细胞(CD3的比例+),单核细胞(CD14 +),B细胞(CD19 +)和天然杀伤(NK)细胞(CD3 - / CD16 + CD56 +)和通过多参数流式细胞仪确定记忆T细胞亚群(CD45RO和CD62L)(补充信息)。基于羧基荧光素琥珀酰亚胺酯稀释的增殖测定法用于确定耗竭的特异性以及剩余的ATIR101细胞和供体PBMC的免疫力。进行右旋体染色以确定CD8 +的数量病毒(Epstein-Barr病毒[EBV] /巨细胞病毒[CMV])右旋体阳性细胞。ELISA分析用于测量重新刺激的总供体PBMC和ATIR101(使用CMV,EBV或病态混合物)产生的IFNγ。有关更多详细信息,请参见补充信息。
对照研究(CR-AIR-006)
计划的对照组包括以下患者:TCD-haplo(2006年1月1日至2013年6月30日);MUD / 1-Locus MMUD(2010年1月1日至2012年12月31日); 双重UCB(2010年1月1日至2012年12月31日)。在欧洲/北美中心收集的数据收集了ATIR101临床研究的患者。数据是从TCD-haplo组的所有合格患者(以及其他组中的所有≤75个合格患者)中收集的,否则,将直接在研究数据库中以结构化查询语言进行随机选择,直到满足以下条件:大小为60–70;每个中心的每项诊断贡献了≥1名患者(蒙特利尔,其中不包括诊断为骨髓增生异常综合征的患者);诊断的总比率与TCD-haplo组中的比率相对应。在针对特定患者的研究特定病例报告表中收集了信息。补充信息中列出了收集的患者和捐献者信息。植入的定义与ATIR101研究相似(中性粒细胞绝对计数> 0.5×10连续两天9 / L;连续三天血小板> 20×10 9 / L,无输血)。
统计
Wilcoxon符号秩检验来比较ATIR101批次具有统计学显着性水平设定在特性P ≤0.05(双尾),由于目的是要测试的假设两个相关批次之间的差异(所以方差是相同的),但配对样本t违反测试(重复测量之间的差异不是正态分布的,或者存在异常值)。计算了事件至事件发生时间的比率,GvHD的累积汇总以及6和12个月时的复发率。按血液恶性肿瘤类型分层的Kaplan-Meier(KM)方法还用于估计事件发生时间的终点(OS,PFS,GRFS)和组,使用对数秩检验(两侧)和Bonferroni校正进行比较多重比较。还计算了危险比(HRs)及其对应的95%置信区间(CIs)。使用对数秩检验将KM方法用于评估各组的≥3级病毒感染的时间。NRM,RRM和GvHD使用累积风险函数评估竞争风险,分别包括RRM,NRM和无GvHD的死亡。38 ]。使用GraphPad Prism v7对ATIR101特性进行统计分析。其余分析使用SAS软件(v9.3)。
结果
患者特征
对照研究包括来自9个欧洲和北美中心的158位患者。他们在2006年2月至2013年5月之间接受了单倍体供体的T细胞耗竭(n = 35),MUD(n = 64),MMUD(n = 37)或UCB(n = 22 )的移植;补充图 1)。在2013年3月至2017年9月之间,来自CR-AIR-007(意向性治疗[ITT]人群)的26例患者接受了来自于对照研究的7个相同中心的HSCT检查。23例患者接受了ATIR101(TCD-haplo + ATIR101)。由于患者的早期死亡,生产失败和原发性移植失败,三名患者未接受ATIR101。在接受TCD-haplo + ATIR101的患者中,70%患有急性髓细胞性白血病,30%患有急性淋巴细胞性白血病,其中57%被归为高疾病风险指数[ 39 ]。尽管两项研究均符合条件,但没有MDS患者入选ATIR101研究。但是,TCD-haplo + ATIR101研究中疾病类别的分布与对照研究相比在统计学上没有显着差异(Kruskall–WallisP = 0.9713)。表1和表2列出了患者的特征 。
HSCT和ATIR101
用TCD-haplo + ATIR101治疗的患者接受了CD34 +选择的同种异体移植,其中位数为11.0×10 6 CD34 +细胞/ kg(范围:4.7–24.4),剩余的T细胞数量(中位数为0.29×10 4 CD3 +个/千克;范围0.01–1.8)。中性粒细胞和血小板植入分别发生在HSCT后第12天(8-34范围)和第11天(9-35范围)(表 1)。所有患者在HSCT后中位28天(范围28-73)接受了2.0×10 6活T细胞/ kg 的ATIR101剂量(补充信息)。图 1a说明了处理过程,图 1bATIR101的生产原理。经过这种选择性的去内膜切除过程后,针对第三方和多克隆刺激物的反应得以维持,而所有产品中的患者特异性同种异体反应均显着降低(图 1c,d)。与供体PBMC相比,T细胞在ATIR101中相对富集(89%±4.7)(53%±10.3;图 1e;P <0.001)。ATIR101中单核细胞和NK细胞的比例显着低于供体PBMC(均P <0.001),而保留了一些B细胞。对T细胞亚群的评估表明,ATIR101 中CD4 +和CD8 +幼稚细胞的比例高于供体PBMC(图 1f)。),随后的分析显示出ATIR101 的CD8 +区室中的统计绝对值绝对增加(图 1g;P <0.001)。有趣的是,与供体PBMC相比,中枢记忆T细胞绝对增加,而CD8 +效应细胞亚群减少(均为P <0.05;图 1g)。总体而言,在ATIR101和供体PBMC之间,CD4 +:CD8 +的比例仍然相当(图 1f)。
TCD-haplo + ATIR101后的免疫重建
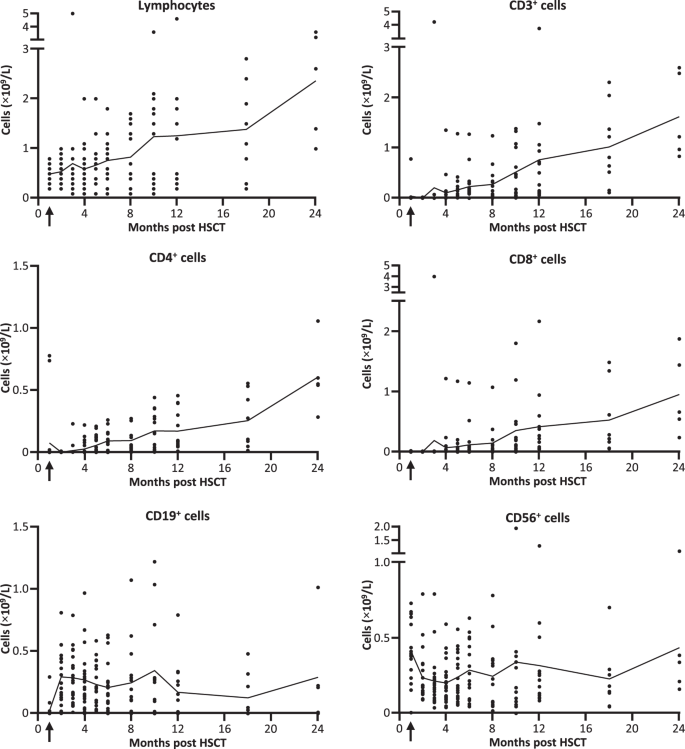
淋巴细胞的恢复是高度可变的,从移植后早期到24个月,中位淋巴细胞和CD3 + T细胞水平持续上升(图 2)。从6个月起,平均CD3 +计数高于指示最小程度重建细胞免疫的水平(0.2×10 9 / L)。HSCT后NK和B细胞恢复较早。补充信息中提供了进一步的亚群分析。
NRM,RRM,PFS和操作系统
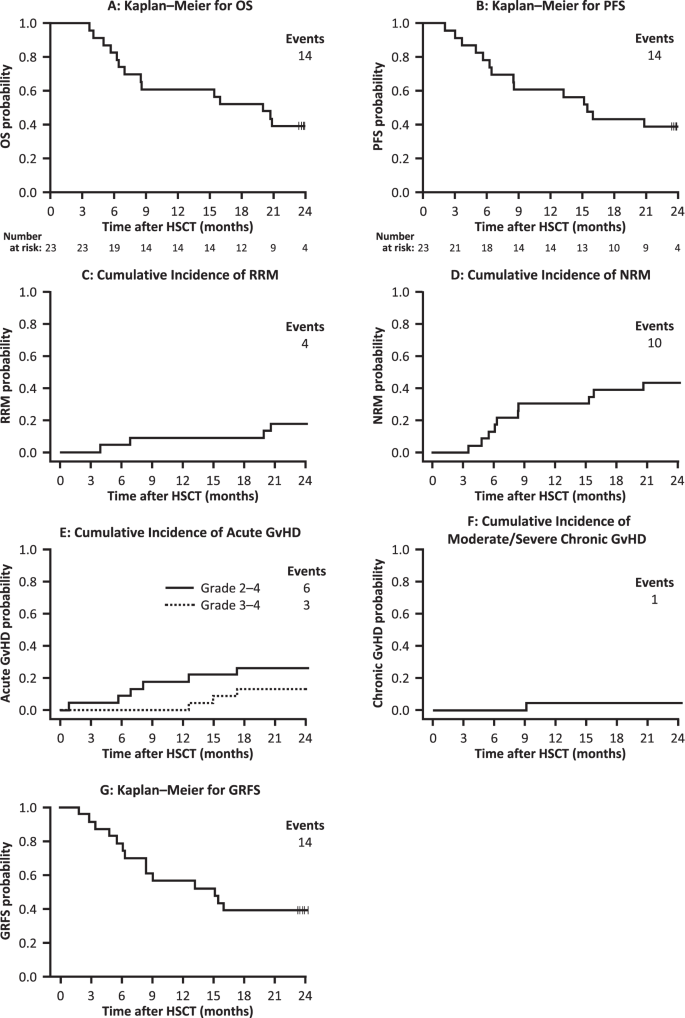
6个月NRM的主要终点发生在三名接受TCD-haplo + ATIR101的患者中(发生率13.0%;表 3)。在2年时,OS率为39.1%,其中NRM导致10例死亡(43.5%),复发导致4例(17.4%;图 3)。在ITT人群中观察到了相似的结果(补充表 1;补充图2)。)。值得注意的是,有4名患者在NRM前4–127天接受了未操纵的供体白细胞输注(DLI),这可能会导致2年时的NRM发生率,后来对该方案进行了修改,以限制不操纵DLI的使用,以防止复发或移植仅失败。未经操作的DLI用于治疗三名患者的感染或在无任何并发症的情况下控制患者的淋巴细胞计数低(补充表2)。另外两名患者接受未经处理的DLI治疗复发。4例RRM患者中有2例复发超过12个月,导致2年PFS率为39.1%(图 3)。
与TCD-haplo + ATIR101相比,仅TCD-haplo组的6个月NRM率高约三倍(分别为13.0%和37.1%;表 3)。同样,TCD-haplo组的6个月OS率(62.9%)低于TCD-haplo + ATIR101组(82.6%)。使用TCD-haplo + ATIR101的12个月OS率为60.9%,其中包括七个NRM(30.4%)和两个RRM(8.7%)。相比之下,仅TCD-haplo的12个月OS率仅为20.0%,包括23 NRM(65.7%)和5 RRM(14.3%),从而导致NRM明显高于TCD-haplo + ATIR101(图 4a);P = 0.008)。通过在TCD-haplo中添加ATIR101,估计的OS也提高了三倍以上(HR:3.10; 95%CI:1.40–6.84;P = 0.0002;补充图。3A)。在仅限于TCD-haplo组的亚组分析中,仅限于AML和ALL患者(不包括MDS患者),观察到相似的差异,6个月和12个月NRM为37.9%和75.5%,OS为62.1%和分别为17.2%。
NRM的主要原因是两个TCD-haplo人群的感染。然而,TCD-haplo + ATIR101与感染相关的NRM的12个月累积发生率接近仅TCD-haplo的一半(分别为21.7%和40.0%)。两年内接受TCD-haplo + ATIR101的11例患者发生了≥3级病毒感染/再激活(20事件)(补充表3)。从HSCT到ATIR101输注期间,没有发生≥3级病毒感染/再激活(补充表4))。在HSCT和ATIR101输注之间,病毒,真菌和细菌感染的发生率大致相同(35-39%)。在以后的时间间隔中,病毒感染胜过其他感染。在11例CMV血清阳性患者中,有10例在HSCT后通过PCR检测为CMV阳性(包括2/3的阴性供体);但是,只有一例报告了症状性CMV感染,基线CMV阴性的患者均未变为CMV阳性。尽管有91%处于危险之中,但只有39%经历了表明EBV重新激活的不良事件(基线时有8例阳性患者,而供体阳性的1例阴性患者)。EBV在6/9例患者中得到了解决:五例在治疗后得到了解决,而一例是自发的。
七名仅接受TCD-haplo的患者在HSCT后12个月复发(累积率20%),是使用TCD-haplo + ATIR101的12个月率的两倍多(8.7%;表 3)。与OS一致,TCD-haplo + ATIR101的12个月PFS率为60.9%,仅TCD-haplo的12个月PFS率为20.0%,加上ATIR101估计的PFS改善了三倍以上(HR:3.17; 95% CI:1.43-7.02;P = 0.001;补充图3B)。
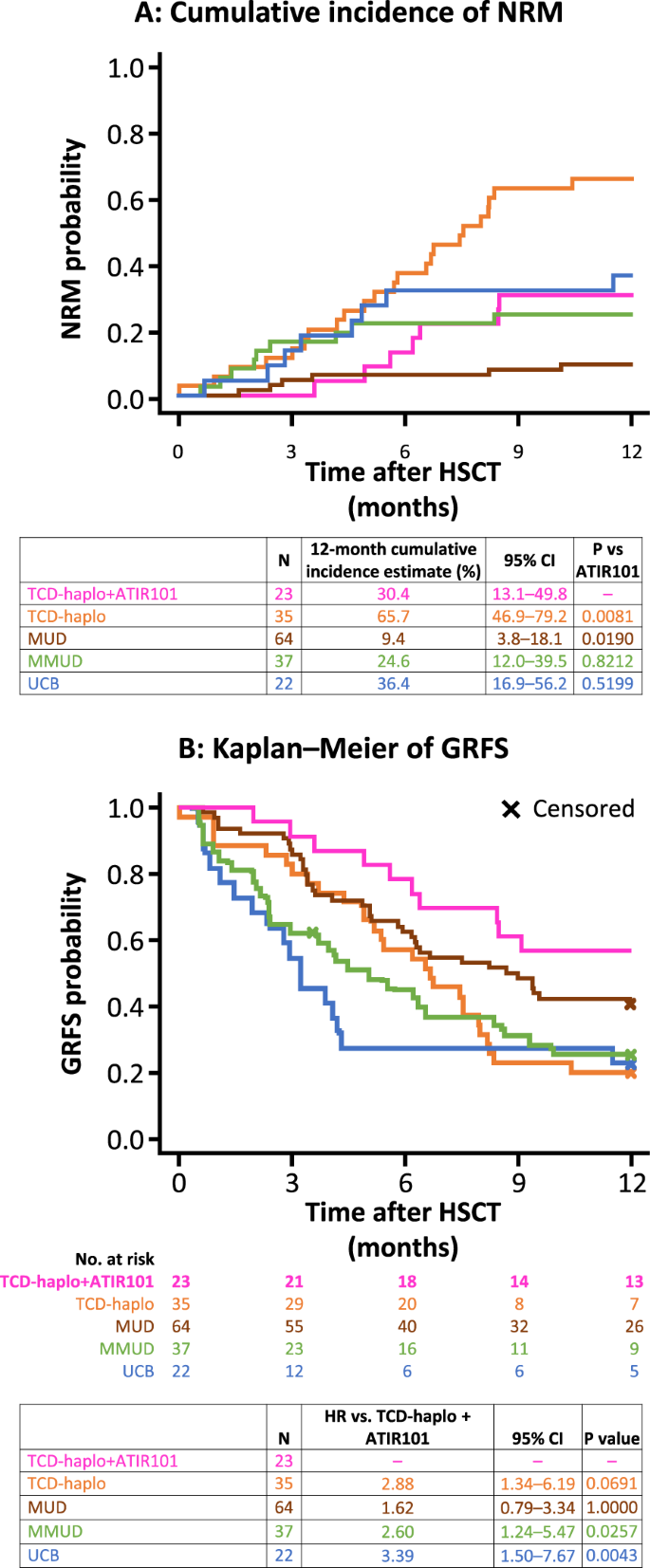
使用TCD-haplo + ATIR101的NRM的一年累积发生率(30.4%)与MMUD(24.6%)和UCB(36.4%;图4a;两者均P > 0.5)相似 。MMUD和UCB的1年累积复发率分别为16.2%和9.1%(TCD-haplo + ATIR101为8.7%)。与MMUD和UCB相比,TCD-haplo + ATIR101的RRM累积发生率或估计的PFS和OS与MMUD和UCB也没有统计学上的显着差异(所有P > 0.7;补充图3)。MUD的1年累积NRM发生率(9.4%)明显低于TCD-haplo + ATIR101(30.4%;图 4a;P = 0.019)。MUD估计的OS和PFS高于TCD-haplo + ATIR101(95%CI:0.11-0.82,P = 0.003,补充图3A ; 和95%CI:0.48-1.18,P = 0.043 ,分别为补充图3B)。尽管MUD的12个月累积复发率为14.1%(表 3),但第一年仅有3/9复发患者因复发而死亡,这解释了RRM与TCD-haplo +的累积发生率之间缺乏统计差异ATIR101(分别为4.7%和8.7%;P = 0.482;补充图3C)。比较与ATIR101研究的ITT人群相似(补充图4)。
移植物抗宿主病(GvHD)
在HSCT后的第一年内,仅接受TCD-haplo的对照组患者中有15名(累积率42.9%)发生了GvHD,包括5名2级aGvHD(14.3%),2名3/4 aGvHD级(5.7%)。 ,还有3个具有cGvHD(8.6%;表 3)。在TCD-haplo + ATIR101人群中,GvHD的1年累积累积率为30.4%(七名患者),包括三名1级患者,四名2级患者(17.4%)和无3/4 aGvHD(表 3)。1名1级aGvHD患者后来在第一年发展为中度cGvHD(4.3%)。因此,即使在没有移植后免疫抑制的情况下,添加ATIR101也不会增加2-4 aGvHD,3/4 aGvHD或cGvHD的1年累积发生率(补充图3D)。–F)仅通过TCD-haplo。相反,MUD,MMUD和UCB的3/4 aGvHD等级的发生率分别为10.9%,16.2%和27.3%(表 3; ATIR101与UCB和MMUD的P <0.05;补充图3F);值得注意的是,尽管预防了GvHD,这些还是发生了,而ATIR101却没有任何移植后免疫抑制作用。此外,与TCD-haplo + ATIR101相比,MUD(37.5%),MMUD(27.0%)和UCB(31.8%;所有P <0.05;补充图3D)的cGvHD显着更高。
在2年时,据报道有9位接受TCD-haplo + ATIR101的患者(39.1%的累积率; 19个事件)发生GvHD:仅8例接受aGvHD(最高2级:13.0%; 3级:8.7%; 4级:4.3%)另一类具有1级aGvHD和中度/重度cGvHD(图 3e,f)。3例3/4级aGvHD的所有病例均晚发(HSCT后382、455和528天; 2年时13%),并且所有这些患者在发展aGvHD之前(15-40天)都接受了未经操作的DLI。一名患者在ATIR101输注后577天死于aGvHD,是唯一因GvHD死亡(死亡记录为RRM,因为DLI用于治疗复发)。两名患者在ATIR101输注之前经历了aGvHD,这显然是由于CD34 +干细胞移植 ATIR101输注后他们没有发展GvHD。
无GvHD,无复发生存(GRFS)
使用TCD-haplo + ATIR101的12个月GRFS率为56.5%,单独使用TCD-haplo的为20%,使用MUD的为40.6%,使用MMUD的为27.0%,使用UCB的为22.7%(表 3)。与MMUD(HR:2.60; 95%CI:1.24–5.47; P = 0.026)和UCB(HR:3.39; 95%CI:1.50–7.67; P = 0.004;图 4b)。最后,TCD-haplo + ATIR101和MUD之间的估计GRFS在统计学上没有显着差异(HR:1.62; 95%CI:0.76-3.34;P = 1.000)。使用TCD-haplo + ATIR101的2年GRFS率为39.1%(图 3g)。ATIR101研究的ITT人群的数据相似(补充表1;补充图。2和5)。
捐助者和ATIR101特征对结果的影响
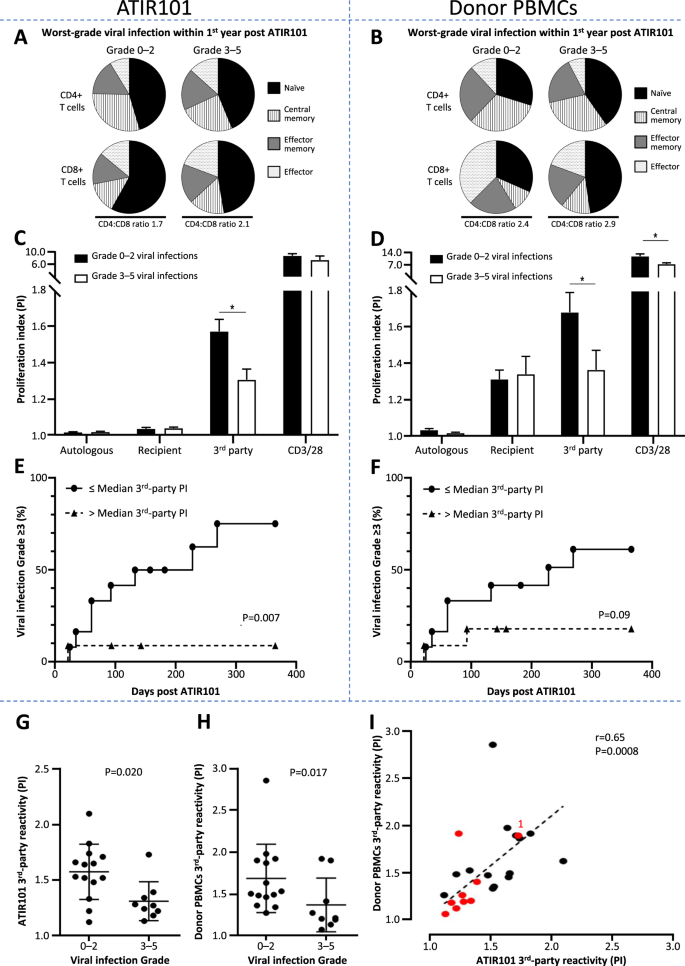
TCD-haplo + ATIR101引起NRM的最常见原因是感染。因此,评估了ATIR101特性对病毒感染的影响(病毒是最常见的感染,最有可能受到功能性T细胞缺乏的影响)。 在ATIR101发生后的1年内,将患者分为3–5级病毒感染(n = 9)和1/2级或无病毒感染(0–2;n = 14)。这些组之间在ATIR101内的T细胞亚群分布只有很小的差异,特别是在CD8 +区室中,其中初治T细胞似乎在1/2级或无病毒感染的患者中有所增加(图 5a)。
对ATIR101术后1年内无病毒感染或2级以下病毒感染(0-2级;n = 14)和3-5级病毒感染(n = 9)的患者,评估了ATIR101和供者PBMC的特征。一个,Ç,ê使用ATIR101和左显示数据b,d,˚F使用供体PBMC右侧显示数据。显示了通过流式细胞术检测的幼稚(黑色),中央记忆(条纹),效应记忆(灰色)和效应(点)T细胞的平均CD4 +和CD8 +比例(%),以及平均CD4:CD8比。用于ATIR101(a)和供体PBMC(b)根据病毒感染组别。在用自体辐照的供体细胞,辐照的受体T细胞,第三方细胞和CD3 / CD28珠刺激后,两个病毒感染组均显示了ATIR101(c)或供体PBMC(d)的T细胞PI 。Kaplan–Meier达到≥3级病毒感染的时间,分为 对刺激刺激有“高”(> PI中位数;n = 11;圆圈)和“低”(≤PI中位数;n = 12;三角形)的患者ATIR101(e)或供体PBMC(d)中的第三方小区。使用对数秩检验比较组。标明了ATIR101(g)和供体PBMC(h)。用于响应于与第三方细胞刺激对应ATIR101和供体PBMC的T细胞PI之间的相关性示于我使用Spearman相关。≥3级病毒感染的患者以红色表示。带有≥3级病毒感染且具有实质性第三方反应性(在供体PBMC和ATIR101中)的患者标有“ 1”。该患者为CMV阳性,且CMV阴性供体产生3级CMV感染。* P <0.05。CMV巨细胞病毒,PBMC外周血单核细胞,PI增殖指数。
但是,与0-2级病毒感染患者接受的细胞移植相比,在3-5级病毒感染患者接受的ATIR101细胞移植物中,针对第三方抗原的功能响应明显降低(图 5c,g)。将ATIR101的第三方反应性拆分为中位数,与接受第三方同种异体反应性高于中值的接受细胞移植的患者相比,具有较低第三方活性的患者发生≥3级感染的风险显着更高(图 5e;P = 0.007)。为了描述光耗过程的影响,还评估了第三方反应在供体PBMC中的作用。与3-5级感染患者相比,从供体到0-2级病毒感染患者的PBMC显着提高了第三方反应性(图 5d,h)。供体PBMC的第三方反应性与ATIR101的反应性相关(图 5i;P = 0.0008),因此对威胁生命的病毒感染的易感性与最初的供体PBMC以及随后的ATIR101对第三种药物的反应能力较低相关派对的挑战。此外,CD8 +病毒(EBV / CMV)右旋聚合物阳性细胞保留在来自相应供体PBMC的ATIR101样品中(表 4)。从供体或ATIR101的再刺激的总样品中上清液中的IFNγ释放,也表明与病毒肽库共同刺激后,与相应的供体PBMC相比,在ATIR101样品中保留了反应性(表 4)。
讨论区
单倍体相合HSCT的上升大多与在T细胞充满策略的上升如PTCY相关[ 4,5,8 ]。便于应用,低治疗费用,和一般的鲁棒性,连同患者需求未得到满足,而不适当的,及时提供HLA相合供者,都必然促使这个令人印象深刻的发展[ 2,8 ]。然而,该方法PTCY,如在一般的同种异体HSCT,由残留的GVHD和复发和静止的外观挑战需要移植后的免疫抑制[ 3,15,16,18,19]。免疫抑制与感染的风险,以及肾毒性和代谢,神经系统和肝脏并发症,这意味着患者必须密切监测,并可能需要这些药物停止由于毒性[ 40,41]。ATIR101是一种辅助性细胞疗法,选择性清除受体同种异体反应性T细胞,在TCD-haplo后施用,以提供抗感染和抗白血病活性,而无需使用移植后免疫抑制。在缺乏确定的单倍体HSCT标准方法的情况下,进行了一项观察性登记研究,以提供与ATIR101研究的纳入/排除标准相匹配的对照组,以将结果与经典TCD-haplo进行比较,并评估ATIR101的益处,以及与使用MUD,MMUD和UCB作为供体来源的其他护理标准方法进行比较。与仅使用TCD-haplo相比,TCD-haplo + ATIR101具有良好的耐受性,并改善了结局,并且产生的1年GRFS与MUD并无显着差异。随着基于价值的医疗保健成为当务之急,37 ]。重要的是要注意,本研究报告的对照研究组的结果与CIBMTR的结果一致,接受MUD的恶性疾病的一年生存率为68%(本研究为85.9%),而接受MUD的恶性疾病为60%。 MMUD(本研究为64.9%)和UCB为59%(本研究为54.5%),证实了比较的有效性[ 42 ]。因此,此处给出的结果证明了ATIR101对同种异体HSCT整个领域的潜在益处。
鉴于递送高剂量的HLA不匹配的供体淋巴细胞和缺乏移植后免疫抑制,TCD-haplo + ATIR101后的第一年不存在3/4 aGvHD级令人信服。第一年的所有aGvHD事件均为1/2级,其中9名患者中有2名仅在ATIR101输注前通过CD34 +移植获得GvHD 。相比之下,在单倍性HSCT和PTCY的荟萃分析中,3/4 aGvHD等级的100天发生率介于0%到25%之间[ 43 ]。在那里,中度/重度cGvHD的2年发生率介于0%到36%之间[ 43 ],而只有一名TCD-haplo + ATIR101患者经历了中度/重度cGvHD,与第一阶段的数据一致[ 34]],表明离体光耗能成功去除了引起GvHD的细胞。
ATIR101用作辅助到TCD-单倍体,单倍体相合HSCT的历史标准[ 44,45 ]。尽管在没有高水平GvHD的情况下突破了主要HLA差异的移植取得了突破性成就,但TCD-haplo的总体结果令人失望,NRM和复发率很高[ 20 ]。事实上,感染被报道的NRM的〜60-70%用TCD-单倍体[原因20,46]。考虑到这些挑战,选择6个月的NRM作为ATIR101研究的主要终点,这一比例仅为13%。而且,一年的NRM明显低于单独使用TCD-haplo。尽管在ATIR101研究中,一年时21.7%的NRM与感染相关,但与仅使用TCD-haplo的40.0%感染相关的NRM相比还是有优势的,这表明ATIR101具有抗感染活性,有助于在TCD-haplo后提供免疫保护或遵循其他移植方案。2年的NRM率为43.5%,其中8个与感染有关。然而,一名未经过充分筛查腺病毒的患者随后死于腺病毒感染,另一例发展为致命的JC病毒性脑病,这可能是由于多次剂量的利妥昔单抗和环磷酰胺治疗移植后淋巴细胞增生性疾病所致。因此,更严格的感染筛查以及添加ATIR101,对于改善TCD-haplo后的NRM至关重要。此外,在ATIR101研究中,对4/10例NRM患者使用未操纵的DLI可能也有助于NRM发生率,强调需要发展操纵的DLI,例如ATIR101 [47 ]。
在这项研究中,ATIR101第三方反应性与较少的临床相关病毒感染的发生有关,这表明增加的T细胞适应性导致了更高的抗病毒免疫性。据我们所知,这是第一个强调这种供体细胞免疫反应强度在HSCT后感染控制中可能发挥作用的研究。重要的是,考虑到大多数患者有多个可用的单倍体供体,这些数据还确定了一种潜在的供体选择工具[ 48 ],并且可以通过测量供体PBMC中的第三方反应性来选择最佳供体。如果只有一个供体可用,或在所有供体中第三方反应都受到限制,则可以考虑在采血之前进行供体疫苗接种和抗病毒特异性T细胞的过继转移[49,50,51 ]。我们关于供体T细胞对HSCT结果贡献的发现也与HLA匹配的T细胞充足的移植后GvHD的供体T细胞基因组谱预测相符,值得进一步研究[ 52 ]。虽然同种异体反应性的响应已被归因于幼稚T细胞[ 53,54,55 ],导致幼稚细胞的相对富集,同时有效地减少接受者同种异体反应性,表明患者反应性幼稚T细胞photodepletion可以选择性地耗尽。具有比存储单元更大的多样性[ 56],剩余的纯净T细胞可以提供针对捐赠者以前未遇到的传染原的保护。实际上,与那些≥3级病毒感染的患者相比,低级病毒感染或无病毒感染的患者似乎在ATIR101中具有更多的CD8 +幼稚细胞。幼稚细胞在预防病毒感染中的作用可能是观察到良好结果的重要考虑因素。
在使用PTCY单倍体相合HSCT,高复发率已经被描述为的移植物抗白血病反应和移植后使用免疫抑制的[消耗的潜在后果18,57,58,59 ]。与仅使用TCD-单倍型(20.0%)相比,较低的复发率(8.7%)支持了ATIR101维持移植物抗白血病作用。除了经典的TCD-haplo,ATIR101甚至可以作为α-βT细胞-CD19缺失的单倍性HSCT的有益佐剂,为NK细胞和γ-δT细胞的免疫力提供更多的移植物抗感染和白血病效应[ 21,22,60,61,62]。
提出的结果表明,TCD-haplo + ATIR101可能是其他方法(如PTCY和MUD HSCT的应用标准)的有希望的替代方法。鉴于此处提供的令人鼓舞的II期数据,尽管缺乏单倍体HSCT的适用标准,但仍启动了一项大型的多中心3期随机试验,旨在显示使用CD34 +在TCD-haplo的GRFS中的优越性使用PTCY(NCT02999854)选择和添加TIR完全单倍HSCT上的ATIR101。根据申办者的决定,该试验过早终止。
作者了解,就许多因素而言,使用高级治疗药物(ATMP)进行随机试验的总体困难,包括控制臂中T完全移植程序的多样性,生产的复杂性和所需的经济资源。与PTCY方法相比,使用ATIR101和其他ATMP显然在技术上要求更高且成本更高。细胞和基因治疗ATMP作为“药物”的监管途径具有挑战性,需要解决与临床试验设计和性能相关的此类关键问题,以改善患者的生活质量,转化为护理标准并获得经济认可。
|
|