中心体功能障碍:衰老与肿瘤免疫力之间的联系
摘要
中心体畸变是人类癌症的标志,并有助于衰老过程。结构和数值中心体异常触发有丝分裂错误,细胞衰老,细胞死亡,基因组不稳定和/或非整倍性,导致人类疾病,例如衰老和癌症,并影响免疫力。有趣的是,中心体功能障碍促进了多种炎症因子的分泌,这些炎症因子是衰老和肿瘤免疫逃逸的关键驱动力。在这篇综述中,我们总结了中心体功能障碍的形式,并进一步讨论了最近的进展,这些进展表明中心体缺陷以不同的方式促进了衰老进程的加速和肿瘤细胞免疫逃逸的促进。
介绍
在动物细胞中,中心体是主要的微管组织中心(MTOC)。中心体促进双极有丝分裂纺锤体的产生,并提供各种细胞类型的初级纤毛基质。除这些结构功能外,中心体和原发纤毛也已发展成为必需的信号枢纽。[1]在正常细胞中,一对中心体包含中心体,该中心体被嵌入到中心密集体材料(PCM)中,该材料是电子致密的非晶质基质。PCM提供微管成核的位置,从而确定细胞周期中微管的数量和组成。大规模的蛋白质组学研究表明,有超过200种与中心体相关的蛋白质。2 然而,大多数这些蛋白的确切功能仍是未知的,需要进一步研究。
在细胞内严格控制中心体的结构,功能和数量。为了形成有效的双极有丝分裂纺锤体,中心体必须在S期复制,并且在细胞周期的G2期募集更多的PCM材料时,中心体会进一步成熟。最后,两个中心体必须在有丝分裂进入时分开。像DNA复制一样,中心体复制也是半保守的,每个细胞周期仅发生一次。严格的监管网络可确保在G1阶段后期有序地执行这两个过程。2因此,在每个细胞中,中心体数目的确定和中心体的复制是相关的。正确的中心体复制,成熟和分离对于双极纺锤体的形成至关重要,因此对于忠实的染色体分离至关重要。因此,中心体功能障碍(CD)可能会阻碍遗传物质的准确遗传。3此外,中心体异常会导致染色体不稳定性(CIN),这是整个染色体不断增加和/或丢失的过程。4,5反过来,这会导致非整倍体,一种状态,其中过多或过少的染色体都存在。6因此,异常染色体含量是人类癌症的生物标志物,与非整倍性和CIN有关。4,7
最初,细胞衰老被认为是一种不可逆的生长停滞类型,发生在可裂解细胞遭受广泛的内在和/或外在损伤时,包括致癌性激活,线粒体功能障碍,辐射损伤,氧化和遗传毒性应激以及化学治疗剂诱导的损伤。8在细胞水平上,已经确定在不同物种的各种细胞类型中,衰老,CIN和非整倍性之间存在关联。9有趣的是,越来越多的证据支持CD与衰老之间的联系,表明中心体可能对衰老具有直接或间接的影响。10
根据百年前Boveri的研究结果,中心体数值异常可能导致肿瘤发生。11布韦里(Boveri)创造了带有多余中心体的受精卵,这些卵似乎经历了多极有丝分裂。在Boveri模型中,中心体异常导致有丝分裂期间染色体错位分离,从而引发恶性肿瘤。重要的是,越来越多的环境证据表明,异常的中心体数量和功能与非整倍性和人类癌症有关[ 3],并且已经表征了中心体异常与肿瘤发生之间的因果关系。12,13细胞培养中的中心体异常通常导致异常的纺锤体装配和损坏的微管-动线粒附着。14 Jusino等人证明,中心体异常与肿瘤的发生有关,因为中心体失调导致持续性CIN。15有趣的是,由CIN引起的染色体分离错误和复制压力可产生双链DNA(dsDNA),并通过激活环GMP-AMP合酶(cGAS)-干扰素基因信号(STING)的刺激物来活化先天免疫应答。16,17这一最新发现不仅增强了我们对CD对肿瘤发展的影响的理解,而且阐明了CD与癌细胞与免疫微环境之间相互作用有关的后果。在这里,我们探讨了这种最新进展对我们目前对衰老和肿瘤免疫方面中心体异常的原因和后果的了解的影响。
中心体异常的机制
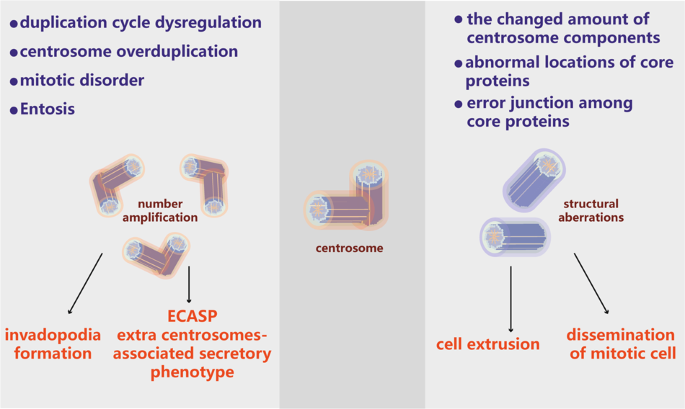
越来越多的证据表明,在实体瘤和许多造血恶性肿瘤中,细胞中心体异常相当普遍。例如,大约80%的浸润性乳腺肿瘤表现出扩增的中心体。18与这些发现一致,在72%的B急性淋巴细胞白血病患者中检测到了中心体异常。19重要的是,在多种肿瘤类型中,中心体扩增与非整倍性和CIN的发展密切相关。18,19,20,21次在中心体的肿瘤的异常可以被粗略地划分成数值异常和结构异常(图1)。中心体拷贝数的增加导致数字异常;这种增加可能是由于中心体复制错误或细胞分裂失败引起的。已发现,中心体数目与髓系白血病,非霍奇金淋巴瘤和多发性骨髓瘤的肿瘤等级和增殖指数显着相关。22,23,24虽然结构异常中心体的特性很少被寻址时,最常见的缺陷是由于PCM膨胀增加大小中心体英寸 25在恶性乳腺癌中,结构性中心体异常主要涉及过长的中心体,该中心体通过中心体断裂和异位前体的形成而增强了中心体的扩增。[26]另外,由九蛋白样蛋白(NLP)诱导的结构中心体畸变可诱导细胞骨架的重组并增加细胞刚度以触发细胞扩散。27尽管结构和数字异常通常在肿瘤中共存并诱发某些相同的作用,但它们也可以促进不同的细胞机制行为,如下所述。27,28
数值中心体异常
包括中心体扩增在内的数值异常是肿瘤中最常见的中心体缺陷。中心体扩增可以通过许多机制来诱导,例如胞质分裂失败,有丝分裂滑移,细胞-细胞融合,中心体过度复制和从头中心体组装。29各种潜在机制可以解释在癌症背景下参与中心体扩增的各种蛋白质,例如肿瘤抑制因子和致癌蛋白。30重要的是,如原发性人类黑素瘤中中心体的分析结果所示,中心体过度复制而不是胞质分裂失败或细胞-细胞融合被认为是中心体扩增的主要因素。在该研究中,CEP170染色用于评估中心体是否包含成熟的中心体。过度重复的中心粒预计不会包含CEP170,而细胞倍增事件导致的额外中心粒预计会包含CEP170。作者发现,黑色素瘤中CEP170阳性中心体的百分比低于良性样本。31
中心体复制周期的失调是导致中心体扩增的关键途径之一。复制周期部分但严格地受到许多关键性调节器的调节。在正常细胞中,可通过多种正向或负向调节中心体复制的因素来阻止中心体扩增。32但是,这个严格控制的中心体周期仅取决于少数几个进化保守的核心蛋白。33例如,马球样激酶(Plk)4是重要的核心蛋白,是中心体复制的主要调节剂。34 Plk4的活性是调节中心粒数量的关键因素,这一发现表明,Plk4的过度活性导致更多的中心粒35而Plk4耗尽会减少中心粒数。35,36,以保证正确中心粒复制,PLK4水平主要由SCFβTrCP/泛素依赖的蛋白质水解,调节37,其部分地由自磷酸化控制。38,39 P53负调节通过招募组蛋白脱乙酰酶(HDAC)阻遏到PLK4的启动子PLK4 mRNA水平。40因此,p53的缺失可通过增加Plk4的水平来促进中心体扩增。该机制与观察到的一致,p53的缺失与小鼠成纤维细胞中中心体数目的增加有关。41但是,最近的一项研究表明,p53 – / –小鼠大脑中的中心体数量正常,[ 42]表明p53缺失不足以引起中心体扩增。因此,p53可能在不同组织中对扩增的影响不同,表明就中心体扩增而言,其他机制可能比p53信号传导更具影响力。43
四倍体可能是由异常的中心体复制或细胞分裂失败引起的,最早是由Theodor Boveri在受精卵中发现的。11值得注意的是,以前的研究表明,端粒驱动的四倍体细胞发生中心体扩增,这可能是由于胞质分裂失败,有丝分裂滑移,核内复制或细胞间融合引起的,并可以促进转化。44,45虽然这些研究没有评估中心体扩增的影响,从P53细胞起源- / -已发现四倍体肿瘤增加的中心体数目。46在一项研究中,从p53 – / –中分离出四倍体细胞皮下植入裸鼠后,经历短暂胞质分裂失败的小鼠乳腺上皮细胞(MMEC)导致乳腺上皮肿瘤发生。46然而,最近的一项体外研究的一些发现与四倍体肿瘤表现出中心体过度复制的假设相矛盾:具体而言,四倍体化的p53 -/- HCT116细胞无法裂解并停止增殖,导致培养细胞中中心体的长期丧失。47导致这种结果的一个可能原因是,瞬时阻断胞质分裂可能会产生非整倍体细胞,并随后导致二倍体和四倍体p53 – / –细胞的繁殖。另一方面,致癌基因Mos在p53的多极有丝分裂中起关键作用– / –单元格。Mos抑制多余的中心体的聚结,诱导频繁的四倍体化,而Mos的敲低会使多极有丝分裂停滞并驱动p53 – / –细胞中的CIN 。48综合起来,这些发现表明,额外的中心体的产生与额外中心体的持续维持之间没有简单的对应关系。显然,中心体扩增本身是有害的。先前的研究表明,在连续培养过程中,新产生的四倍体细胞会自发消失其他中心体。49另外,胞质分裂不能诱导细胞中的四倍体从而导致长期稳定的中心体扩增,其他共存的条件必须共存,例如与特定细胞类型和遗传变化有关的条件。
值得注意的是,在癌症患者50的尿液和腹水中发现的细胞中发生了肠胃炎,并且通过细胞内细胞结构的存在来鉴定肠胃炎。51 Entosis主要发生在特定条件下的上皮肿瘤细胞中,例如异常增殖,葡萄糖耗尽,52基质脱离,51和有丝分裂应激。53肠胃分泌对肿瘤发生的影响尚不清楚;然而,在细胞被吞噬时,昆虫病可诱导非整倍性[ 54],并可为肿瘤生长提供营养。52细胞分裂,脱离或死亡是吞噬细胞的可能结局。然而,自噬体-溶酶体功能和细胞凋亡的不足会导致内化细胞被其宿主细胞释放并重新出现而不受损害。51,55在人类乳腺肿瘤,活细胞通过entosis内化,但原生细胞的中心体在宿主细胞将被保留。此外,保存的中心体在宿主细胞的细胞周期期间继续起作用,从而在宿主细胞分裂期间破坏了收缩环的形成。因此,胞质分裂失败频繁发生,产生诱导中心体数目增加的双核细胞。54 这些观察结果表明胞质分裂失败与中心体异常之间存在新的关系。
结构性中心体异常
中心体结构缺陷可大致分为两类:中心体结构缺陷和PCM成分含量缺陷(图1)。中心粒大小的改变是最直接的结构缺陷,通常观察到中心粒长度的增加。癌细胞中中心结构缺陷如何产生尚不清楚;但是,最近的研究表明,严重的中心粒过度伸长可触发中心体扩增,从而导致形成比正常中心体成核更多的微管的过度活跃的中心体。26控制中心结构的基因表达水平的改变可能是结构缺陷的基础。例如,中心体成分表达的上调或下调可能导致中心体结构异常;在一些模型系统中,发现CPAP / SAS-4的过度表达会增加中心粒长度,从而影响正常的着丝粒组装。56,57
要鉴定癌细胞中中心粒的特定结构缺陷并不容易。首先,鉴于中心粒的长度为0.2–0.5μm,接近光学显微镜的光学分辨率极限,因此测量中心粒长度需要特定的荧光技术或电子显微镜。其次,很难根据肿瘤的结构缺陷对肿瘤进行分类。例如,PCM的量可以使用中心粒周围标记从中心体的体积/直径推导出58,并且增加的PCM量被认为是结构缺陷。59但是,对于单元中PCM数量增加有两种解释。一方面,PCM的增加可能是对测量数据的有效解释,并支持将多余的PCM分类为中心体结构缺陷。58另一方面,观察到的结果可能是相间质心簇进一步聚集的结果,这被认为是数值缺陷。58,60种这两种可能性可以仅通过真实中心粒标记进行评估。也可能出现错误的分类和相反的分类,因为人们认为中心粒长度的增加会导致体外的中心粒断裂。57因此,仅通过固定细胞成像来确定中心体结构变化的起源并不是一件容易的事,并且由于大多数肿瘤研究仅考虑PCM标记而不考虑中心标记而使这一事实变得更加复杂。最重要的是,有必要通过特定的方法系统地识别和分类中心体异常,以便更好地描述人类肿瘤中的中心体异常,并阐明这些中心体缺陷是如何产生的。
中心体畸变和衰老
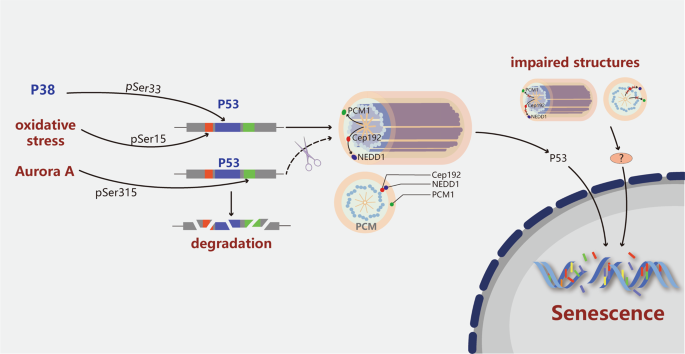
衰老或衰老是在所有活生物体中发生的自然生物过程。衰老的特征包括对细胞代谢和功能的破坏,该破坏随时间而变化,最终导致永久性细胞周期停滞和细胞死亡。虽然衰老在整个生物体都观察到61,62和在单个细胞,63个衰老的分子和细胞机制仍不清楚。在细胞水平上,已确定在不同物种的不同细胞类型中衰老与CIN和非整倍性相关。9,64的一些生理应力等的氧化应激被认为是在老化过程中发挥作用,65 DNA损伤,66端粒缩短, 67个高水平的肿瘤抑制基因表达的 68和致癌活化。69有趣的是,越来越多的证据揭示了CD与衰老之间的关系(图 2),表明中心体可能直接或间接地在衰老中起作用。例如,老化的猪卵母细胞表现出γ-微管蛋白和NuMA的损失,它们是减数分裂纺锤体的关键PCM成分;这种损失会导致主轴异常和混乱。70以同样的方式,衰老的人类卵母细胞的纺锤体逐渐失去微管,这强烈表明在衰老过程中中心体的结构和功能受到损害。71另外,在年老的人卵母细胞72和年老的果蝇细胞中,中心体和微管的完整性丧失。73此外,由于端粒缩短和氧化应激,人类原代成纤维细胞不再分裂,而是在有限数量的细胞分裂后进入复制性衰老。63这些细胞由于异常有丝分裂的频率增加和多余的中心体的发生而变得衰老。9重要的是,破坏早期传代的小鼠胚胎成纤维细胞(MEF)的核心PCM成分会诱导中心体碎片化并引发早衰,74表明单独的CD足以促进细胞衰老的进展。另一项研究表明,pericentrin和PCM-1在细胞周期调节中起作用。75 PCM-1可以使percentcentrin募集到PCM,抑制percentenrin或PCM-1会导致细胞周期永久退出,并伴随着细胞β-半乳糖苷酶(细胞衰老的标志)表达增加。同样,其他PCM成分的消耗,例如Cep192(将NEDD1吸收到PCM)和NEDD1(将γ-微管蛋白吸收到PCM),也会导致中心体分裂和过早进入衰老。73总之,这些发现表明,中心体畸变是细胞应激的一种有趣的可能性,它可以引发细胞永久退出细胞周期。未来的高分辨率和电子显微镜研究对于鉴定这些结构像差并确定其对衰老的贡献是必要的。
CD的潜在分子机制及其对各种病理应激诱导的细胞衰老的影响已被探索。如图2所示,氧化应激会随着年龄的增长诱导原代MEF的复制衰老。65然而,随着后期传代细胞开始衰老,中心体不但没有增加数量,而且还破碎成较小的碎片。74此外,中心体扩增通过增加NOX介导的活性氧(ROS)的生成来诱导早期的氧化应激反应,并且高ROS水平在具有其他中心体的细胞中诱导类似衰老的表型。28P38是一种参与细胞应激反应和衰老的蛋白质。有趣的是,p38在Ser33处被激活以磷酸化p53,这导致p53在转运至细胞核之前在中心体处积累。76与以前的研究相似,该发现表明细胞周期停滞还取决于p38和p53,并且该停滞可能是由于p53和p21的蛋白质水平升高以及磷酸化视网膜母细胞瘤(Rb)水平降低所致。此外,极光A及其下游目标TACC3在有丝分裂期间定位于PCM。K162R突变使Aurora A失活,对Aurora A或TACC3的抑制通过增加p53,p21和低磷酸化Rb水平导致p53精通的肿瘤细胞过早衰老。77p53水平升高的部分原因可以由以下发现部分解释:Aurora A通常会在Ser315上磷酸化p53,使其对降解敏感,并且在不存在Aurora A的情况下p53变得稳定。78人原代成纤维细胞经历了复制性衰老或氧化应激诱导的过早衰老P53在中心体中也积累,并在Ser15处同时显示p53磷酸化。79Ser15处p53的磷酸化不仅对于p53定位于中心体至关重要,而且对于确保有丝分裂共济失调突变(ATM)的正常细胞分裂的早期有丝分裂的默认途径也至关重要。80当有丝分裂纺锤体执行正常功能时,Ser15迅速被去磷酸化,并且p53保持分离并在中心体处失活。但是,当纺锤受损时,p53在Ser15处仍然被磷酸化。最终,磷蛋白易位至细胞核,触发细胞周期停滞和细胞衰老。因此,有可能p53的磷酸化和在中心体的蓄积是关键事件,其响应于中心体损伤和其他应激而在衰老过程的早期发生。早就知道p53位于中心体上。然而,人们对p53在这些细胞器上的功能了解甚少。79,80,81将来确定中心体p53的功能重要性及其相对于各种激酶的差异磷酸化状态将是很有趣的。阐明这些分子特征将有助于理解p53如何整合来自不同类型压力的信号以促进细胞衰老。
中心体扩增和肿瘤免疫
有效的免疫疗法在肿瘤患者临床治疗中的应用越来越受到关注。肿瘤抗原的分子鉴定是当代肿瘤免疫学和癌症免疫疗法的基础。82一些研究集中在CD对抗肿瘤免疫反应的影响和潜在的分子机制上(图3)。重要的是,中心体状态不仅调节非整倍体发育,而且还控制忠实的染色体遗传。18,20此外,一些观察表明,CD也能诱导改变的免疫表型。
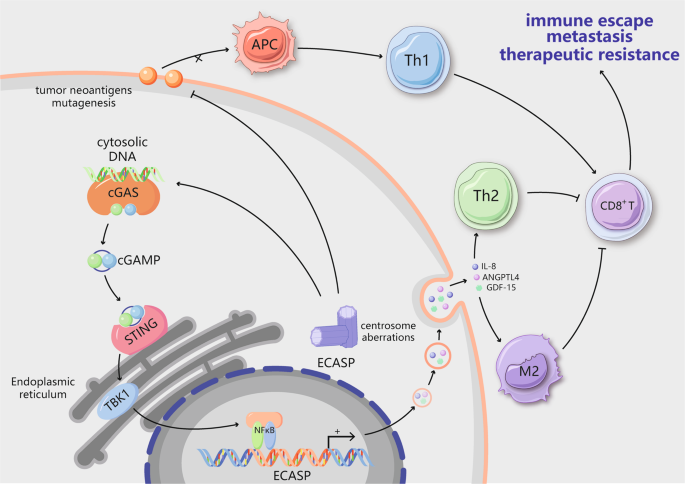
中心体畸变触发免疫抑制性微环境。中心体畸变可导致双链DNA(dsDNA)在细胞质中积聚。胞质dsDNA的存在会激活cGAS–STING途径。然而,在具有中心体功能障碍的癌细胞中,替代性的炎性STING依赖性信号传导(如NF-κB信号传导)被激活。慢性NF-κB活化已被证明可通过影响包括IL-8,GDF-15和ANGPTL4在内的蛋白质来介导额外的中心体相关分泌表型(ECASP)。IL-8也是衰老相关分泌表型(SASP)的成分之一。它募集Th2细胞和M2巨噬细胞来塑造免疫抑制微环境。此外,中心体畸变会导致肿瘤新抗原表达降低和诱变,从而抑制MHC I类抗原呈递并减少CD8 + T细胞浸润,从而能够逃避抗肿瘤免疫反应。最终,中心体异常会导致免疫逃逸,远处转移和治疗抵抗力
关于非整倍性,Senovilla等。首先发现了非生理性四倍体与免疫监视之间的联系。在免疫缺陷的小鼠中,钙网蛋白(CALR)在细胞膜上的升高暴露使超倍体癌细胞具有免疫原性,这可能是通过组成性增加内质网(ER)应激引起的。CALR促进树突状细胞识别肿瘤抗原,最终诱导抗肿瘤免疫反应,并通过细胞毒性CD8 + T细胞抑制肿瘤生长。相比之下,超倍体细胞只有在具有免疫能力的小鼠中延迟后才能产生肿瘤。导致的肿瘤显示出降低的DNA含量,内质网应激和CALR暴露。83因此,非整倍性使细胞能够逃离免疫监视系统。仔细分析免疫微环境中涉及的成分后发现,非整倍性与总体肿瘤白细胞级分正相关,并且与炎症信号通路的激活相一致。巨噬细胞是非整倍体肿瘤微环境的最重要组成部分,其特征在于涉及肿瘤生长因子-β(TGF-β)激活的免疫抑制表型。84此外,高度非整倍性肿瘤会减少CD8 + T细胞浸润,从而降低对免疫疗法的反应。85同样,具有非整倍性的肿瘤表现出抑制性的MHC I类抗原呈递和有缺陷的免疫原性,从而逃避了抗肿瘤免疫反应。86这些有趣的相关性要求建立可用于解剖非整倍体肿瘤细胞与相应免疫微环境之间相互串扰的动物模型。
已经阐明了中心体扩增对CIN的影响。在肿瘤组织中,大小和数量均中心体异常与CIN呈显着正相关,而与p53突变无关。18,87进行的,以限定的基本机制的研究表明,额外中心倾向于促进双极细胞分裂过程中染色体误偏析。49随后,许多研究小组描述了一种直接机制,与有丝分裂CIN有关的错误通过在后期停滞期间通过形成称为微核的结构来产生DNA断裂。88这些微核周围的包膜易于破裂,从而导致基因组内容物暴露于细胞质中。89当dsDNA在相间接触细胞质溶胶时,微核中的dsDNA激活cGAS–STING途径。16 cGAS首先检测胞质dsDNA,导致生成cGAMP(环状二核苷酸),继而促进STING核周定位于ER膜90(图3)。STING介导炎症途径的转录激活,包括I型干扰素信号传导途径,以及衰老相关分泌表型(SASP)的建立。通过荧光激活细胞分选(FACS)和随后的RNaseH2单细胞RNA测序– / –MEF,Mackenzie等。优雅地揭示了促炎性干扰素刺激基因(ISG),包括CCL5和CXCL10,仅在具有微核的细胞中被诱导。91此外,染色体跟踪实验表明,经历异常分离的同一条染色体最终被片段化为细胞质染色质[ 16],表明染色体错误分离与先天免疫信号之间存在直接联系。综上所述,这些发现表明,由中心体引起的CIN可以通过cGAS–STING途径激活免疫信号传导途径。
ECASP将衰老与免疫微环境联系起来
最近,已将额外的中心体相关分泌途径(ECASP)鉴定为独特的分泌表型,包括由额外的中心体产生的多种细胞外基质(ECM)相关因子。[28]还证明了中心体扩增促进释放促侵袭因子以触发非细胞自主侵袭28(图3)。来自具有多个中心体的细胞的条件培养基可以促进正常细胞中侵袭足的产生。此外,已经显示具有附加中心体的细胞释放与肿瘤发生以及癌细胞的侵袭和迁移有关的多种前侵性因子(例如,IL-8,ANGPTL4和GDF-15)。侵袭性因子的释放不需要Rac1信号;然而,响应正常中心体细胞中的这些分泌因子,Invadopodia的形成需要Rac1信号传导。这一发现表明,非细胞自主性ECASP与先前报道的途径不同,该途径促进具有额外中心体的细胞中侵袭足的细胞自主形成。60尽管尚不清楚其他中心体如何促进ECASP,但已确定该反应部分取决于中心体扩增细胞中ROS水平的增加。28同样,衰老的细胞会产生可溶性和不溶性因子的复杂混合物,其中包括SASP 92,包括细胞因子,趋化因子和其他信号分子。SASP的具体构成取决于细胞的类型和诱导衰老的物质。IL-8是SASP的成分之一,可以促进癌前上皮细胞侵袭基底膜。93这表明IL-8可以将ECASP与SASP连接。该机制涉及cGAS / STING和NF-κB的激活以及这些蛋白在染色质组分中的积累,这可能是中心体异常,免疫微环境和衰老的收敛点。越来越多的证据表明,肿瘤可以通过多种机制达到耐受性,包括通过调整其对细胞质DNA信号的反应或获得基因组拷贝数异质性来避免激活先天免疫的有害成分。尽管肿瘤细胞可能抑制由胞质DNA诱导的I型干扰素信号传导,但STING的激活以肿瘤细胞自主的方式促进了其他炎症途径。尽管STING与ISG之间缺乏重要关联,94与报道的cGAS–STING途径对细胞衰老的作用一致。95 STING有助于通过许多促炎性转录因子相关途径(例如经典和非经典NF-κB途径)进行信号传导。96尽管这些因素的功能重叠,但是由于其在STING下游的各种作用可能会产生不同的结果。例如,经典的NF-κB途径通过原代人肺IMR90成纤维细胞中的细胞质DNA信号触发SASP炎症因子的产生。94,95此外,通过cGAS–STING的低水平和持续激活,非典型的NF-κB途径得以增强,并且对MDA-MB-231细胞的迁移和侵袭能力具有至关重要的作用。16这些特定于途径的功能似乎与干扰素调节因子3(IRF3)不相关。尽管ECASP在肿瘤发展中的作用仍是未知的,但该途径参与了一种机制,通过该机制,其他中心体触发正常中心体对附近细胞的旁分泌侵袭。28可能需要进行染色体错误分离的一小部分肿瘤细胞才能产生SASP相关的细胞因子,从而将免疫细胞吸引到肿瘤微环境。炎性微环境反过来可能导致非整倍性,并通过直接的基因毒性应激或上皮-间质转化(EMT)的诱导在肿瘤细胞中传播CIN,形成前馈环。97探索结构性中心体改变的后果,以确定它们是否与诱导侵袭性分泌表型的数字改变相似,这将是有趣的。
中心体异常与癌症治疗
中心体聚集抑制剂的最新发展可能使得能够验证中心体在体内癌症中的作用。在癌症细胞中优先触发多极有丝分裂的一些化合物,如GF-15(灰黄霉素的衍生物),聚(ADP核糖)聚合酶(PARP)抑制剂和紫杉醇(即,紫杉醇),已经开发了98,99,100,101,102,103,104,105,106,107,108,109,110,111(表1)。具有附加中心体的细胞对这类抑制剂表现出更高的敏感性,但是尚不确定肿瘤细胞中中心体的扩增是否会引起这种敏感性。另一可能性是这些试剂影响微管动力学,从而导致多极纺锤体的发展,而不是导致产生额外的中心粒。紫杉烷类化合物(已被证明可稳定微管的天然抗肿瘤药物)通过诱导与中心体有关的异常(特别是异常的纺锤体)和抑制纺锤体微管动力学来阻止细胞周期进程。110紫杉醇,一种抑制紫菜素聚合的原型紫杉烷类抗肿瘤药物,可诱导异常的多极纺锤体形成,从而维持切割失败并导致细胞逐渐死亡。109灰黄霉素具有与紫杉醇相同的许多特性。灰黄霉素促进低浓度下微管的不稳定性,并且微管蛋白上的灰黄霉素结合位点与紫杉醇结合位点相同,从而表明灰黄霉素在诱导多极纺锤体形成中具有相似的作用。108 GF-15(灰黄霉素的衍生物)有效抑制中心体簇,从而在体外和体内抑制肿瘤细胞的生长。100此外,一种喹啉-磺酰基杂合蛋白酶体抑制剂VR23靶向20S蛋白酶体的催化β2亚基,并通过促进泛素化细胞周期蛋白E的积累来诱导选择性的杀死癌细胞,从而诱导异常的中心体扩增周期。107此外,中心体簇化学抑制剂-01(CCCI-01)诱导多极纺锤体形成并抑制BT-549乳腺癌细胞的克隆生长,该细胞具有额外的中心体,但保留了与正常上皮细胞相似的双极纺锤体。106同样,已经发现CP-673451和crenolanib是中心体簇的强效抑制剂,对具有额外中心体的细胞具有选择性的细胞毒性。从机理上讲,这两种化合物都通过cofilin介导的皮质肌动蛋白去稳定作用诱导有丝分裂纺锤体多极性。105鉴于PLK在中心体成熟中的关键作用,已经开发了一些靶向性PLK1和PLK4抑制剂以显着抑制肿瘤生长,目前处于临床开发阶段。103,104最终,PARP-1定位于中心体并催化中心体p53的聚(ADP-核糖基)化,这参与了中心体复制的调控和染色体稳定性的监测。112此外,已发现PARP抑制剂可抑制中心体簇集并专门根除多中心体人类癌细胞。98,111因此,PARP抑制剂治疗可能是大范围的人类癌症中一个新的,选择性的和高效的中心体靶向治疗。
除了通过这些公认的细胞作用机制起作用外,抑制剂还可以通过增强cGAS-STING途径信号传导来影响染色体分离,从而产生抗肿瘤免疫力。Zierhut等。研究表明,STING是紫杉醇处理的乳腺癌细胞中有丝分裂细胞死亡的重要决定因素。113同样,最近的研究表明,PARP抑制剂可以影响cGAS-STING信号传导和抗肿瘤免疫,如可移植性卵巢癌和结直肠癌小鼠模型中肿瘤反应的评估所表明的那样。101,102无论相关的挑战如何,显而易见的是,快速准确地靶向中心体的药物的识别对某些患者在临床上将是有益的。此外,已显示紫杉醇和PARP抑制剂可增强多种癌症的免疫检查点阻断作用。114,115因此,靶向治疗中心体可促进抗肿瘤反应,和联合治疗是有希望的新的途径。
结论与观点
中心体对衰老的影响是一个重要的研究课题,已被广泛忽略。尽管需要进一步的研究,但现有证据表明CD与细胞衰老有关。我们建议CD是另一种形式的应激,除了众所周知的细胞应激(例如DNA损伤,氧化应激,致癌激活和肿瘤抑制因子过度表达)之外,还可以防止细胞周期停滞和细胞衰老。值得注意的是,越来越多的证据表明p53是这些不同途径中的常见蛋白质。响应不同的压力来源,p53在中心体中迅速积累。随后,在特定残基处不同激酶对中心体p53的磷酸化介导了下游事件,包括p21和Rb刺激,导致永久性细胞周期停滞和细胞衰老。尽管人们已经很好地了解了核p53在转录过程中的调控作用,但该蛋白在中心体中的生物学功能仍值得进一步研究。例如,p53穿梭进出中心体的机制以及p53对衰老的特定作用值得进一步研究。此外,自噬反应的激活是否可以延迟CD介导的衰老值得研究。对这些主题的探索可能会为细胞衰老,细胞死亡和不受控制的细胞生长之间的关系提供有用的见解,而这些关系都与适当的中心体功能密切相关。该蛋白在中心体中的生物学功能值得进一步研究。例如,p53穿梭进出中心体的机制以及p53对衰老的特定作用值得进一步研究。此外,自噬反应的激活是否可以延迟CD介导的衰老值得研究。对这些主题的探索可能会为细胞衰老,细胞死亡和不受控制的细胞生长之间的关系提供有用的见解,而这些关系都与适当的中心体功能密切相关。该蛋白在中心体中的生物学功能值得进一步研究。例如,p53穿梭进出中心体的机制以及p53对衰老的特定作用值得进一步研究。此外,自噬反应的激活是否可以延迟CD介导的衰老值得研究。对这些主题的探索可能会为细胞衰老,细胞死亡和不受控制的细胞生长之间的关系提供有用的见解,而这些关系都与适当的中心体功能密切相关。自噬反应的激活是否可以延迟CD介导的衰老值得研究。对这些主题的探索可能会为细胞衰老,细胞死亡和不受控制的细胞生长之间的关系提供有用的见解,而这些关系都与适当的中心体功能密切相关。自噬反应的激活是否可以延迟CD介导的衰老值得研究。对这些主题的探索可能会为细胞衰老,细胞死亡和不受控制的细胞生长之间的关系提供有用的见解,而这些关系都与适当的中心体功能密切相关。
了解CD作为先天性免疫信号激活剂和肿瘤适应介质的双重作用对于开发合适的治疗靶标至关重要。尽管最近的发现提高了我们对生物系统中CD潜在机制的理解,但CD靶向疗法的临床应用才刚刚开始。CD研究的进一步进展对于增强我们预防肿瘤细胞适应细胞质DNA的能力以及通过针对癌症的致死特征提供治疗益处至关重要。此外,成功的治疗取决于能够激活自噬以去除异常中心体并促进抗肿瘤免疫反应的药物的开发。
|
|