哺乳动物多梳阻遏物复合物在免疫调节中的结构异质性
摘要
表观遗传调控主要是由酶介导的,这些酶可以通过改变DNA或组蛋白的结构来修饰染色质的结构。已经鉴定了参与表观遗传过程的蛋白质,以研究参与特定mRNA表达调控的详细分子机制。进化上保守的聚梳基团(PcG)蛋白可以通过在赖氨酸27残基处的组蛋白H3三甲基化(H3K27me3)和在赖氨酸119残基处的组蛋白H2A单泛素化(H2AK119ub)充当转录阻遏物。PcG蛋白质形成两种功能上不同的蛋白质复合物:多梳阻遏物复合物1(PRC1)和PRC2。在哺乳动物中,每个PRC复合物的结构异质性通过其亚基蛋白的几个旁系同源物而大大增加。用转基因小鼠进行的遗传研究以及RNA-seq和染色质免疫沉淀(ChIP)-seq分析可能有助于定义PcG蛋白旁系同源物的细胞特异性功能。在这里,我们总结了有关PcG蛋白与每个PRC复合物的组成多样性相关的免疫调节作用的当前知识,并介绍了针对PcG蛋白在造血系统恶性肿瘤中的治疗药物。
介绍
在真核生物中,染色质结构的改变是通过调节特异性DNA复制和mRNA转录1来修饰细胞表型的主要方法之一。除DNA甲基化外,改变组蛋白某些氨基酸残基的性质是修饰染色质结构的主要方法。参与组蛋白的乙酰化,甲基化,泛素化和磷酸化的酶已被鉴定和广泛研究以定义每种酶的生物学功能2。许多研究提供了证据,证明组蛋白修饰在诸如致癌,分化,增殖和衰老3等细胞命运中起着决定性作用。
聚梳组(PcG)蛋白最初是从果蝇中鉴定出来的。在进化过程中,它们从无脊椎动物到哺乳动物都得到了很好的保护。PcG蛋白可以通过组蛋白H3和H2A 4的三甲基化或单泛素化来抑制特定基因位点的mRNA转录,从而充当转录阻遏物。为了启动和维持这种染色质修饰,两个不同的蛋白质复合物,即多梳阻遏物复合物1(PRC1)和PRC2,彼此协同工作。PRC2展品甲基转移酶活性,以甲基官能团添加到特定的氨基的组蛋白H3的氨基酸残基,而表现出PRC1 E3泛素连接酶活性来修改组蛋白H2A的结构4,5。哺乳动物PRC复合物显示结构可塑性,因为PcG亚基蛋白6的几个旁系同源物的存在。特别地,基于简单的组合算法7,可能存在100多种不同类型的哺乳动物PRC1复合体。
尽管涉及转基因动物技术的生化和分子分析的最新进展揭示了通过组蛋白修饰调节mRNA表达的PcG蛋白核心亚基的功能重要性,但PcG亚基蛋白的每个旁系同源物如何相互作用以协调精细染色质结构的调节仍然难以实现。在这篇综述中,我们总结了有关PcG蛋白与每个PRC复合物组成多样性相关的免疫调节作用的当前知识。我们还介绍了靶向PcG蛋白的治疗药物。
结构异质性与PcG蛋白的功能有关
PcG基因最初被鉴定为参与同源基因表达调控的基因,对果蝇的体轴计划和节段发育至关重要8。PcG蛋白存在于植物,线虫和后生动物中,从苍蝇到哺乳动物,表明这些蛋白在进化过程中通过染色质结构的修饰9是保守的转录阻遏物。每个PcG蛋白都是多蛋白复合物的一个亚基,分为两个不同的功能组:PRC1和PRC2 10。
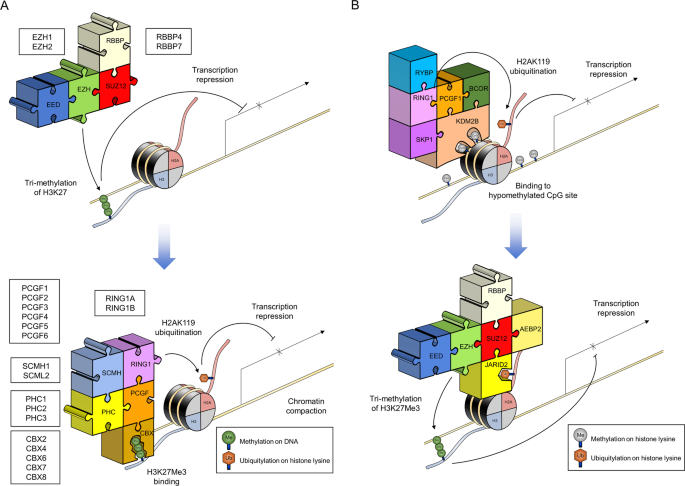
胚胎外胚层发育(EED),zeste抑制剂(SUZ)12和zeste同系物增强剂(EZH)是PRC2的催化核心亚基。由于EZH具有两个旁系同源物(EZH1和EZH2),因此在PRC2的催化核心中发现了两个结构变体(图1a)11。EZH2是PRC2复杂,其充当S-腺苷的酶亚基升经由单- ,二- ,或赖氨酸残基27中的组蛋白H3(H3K27me1,H3K27me2三甲基-蛋氨酸(SAM) -依赖性组蛋白甲基,或的H3K27me3)(图1和表1)11,12,13,14,15,16。与EZH2 10相比,EZH1还可以作为甲基转移酶,具有降低的酶活性。EZH1或EZH2的SET结构域包含催化核心和SAM结合位点,对于它们的甲基转移酶活性而言必不可少。然而,纯化的EZH1或EZH2单体单独不能有效地发挥在体外酶活性,因为它们必须与两个其他非催化亚基蛋白,SUZ12和EED(图结合1,表1和2)9,11,12,17,18,19,20,21。SUZ12含有一个锌指结构域,可以与DNA或RNA结合并促进蛋白质与蛋白质的相互作用22。EED包含WD40重复序列,可以假定与H3K27me3结合(表2)23。的PRC2核心亚基的第四构件是成视网膜细胞瘤结合蛋白4(RBBP4)(NURF55)或RBBP7(图1,表1和2)9,12,18,19,24,25。RBBP 4/7是否包含在PRC2的催化核心中仍存在争议,因为PRBP2的体外催化活性不需要RBBP 4/7活性26。但是,RBBP 4/7还包含WD40域,可以结合组蛋白并促进PRC2在体内的催化活性26。
除PRC2的核心亚基外,其他几种蛋白质也可与这些亚基结合并调节PRC2的酶活性。基于在人类非核心其亚基蛋白(表两种不同类型的复合物PRC2的(PRC 2.1和2.2 PRC)已被鉴定1)11,12,27。PRC2.1包含其他三个亚基,包括梳状蛋白(PCL),PRC2相关LCOR同种型(PALI),elongin B / C和PRC2相关蛋白(EPOP)(表1)11,12,28,29,30。PCL具有三个Paralog:PCL1,PCL2和PCL3。它们分别也称为PHF1(PCL1),MTF2(PCL2)和PHF19(PCL3)。PALI,也称为C10ORF12,具有两个旁系同源物:PALI1和PALI2 28,29,30。三种非核心亚基蛋白(PCL,PALI和EPOP)可作为促进剂来促进PRC 2.1的催化活性。PCL的功能对于PRC 2.1对H3K27me3是必不可少的,因为PCL的TUDOR域识别H3K36me2 / 3是PRC 2.1引入H3K27me3商标的前提31。PCL也由PRC 2.1所需的识别DNA的非甲基化CpG岛的32,33。PALI1可以促进PRC2在体外和体内的催化活性34。与EZH2缺陷型小鼠的表型相似,PALI1缺陷型小鼠表现出胚胎致死率 34。EPOP可以介导PRC2.1和Elongin B / C之间的相互作用,这对于维持PRC2靶基因座 35的转录抑制非常重要。
脂肪细胞增强子结合蛋白2(AEBP2)和十文字富含AT相互作用的结构域2(JARID2)是附加的亚基对于PRC 2.2与PRC2核心亚基沿(图1和表1)11,12,27,36。AEBP2和JARID2都需要通过特异性结合到DNA 36的CpG富集区域来募集PRC 2.2到染色质。最近的研究表明,含Jarid2的PRC 2.2可以特异性识别并结合由PRC1.1(非规范的PRC 1)复合物标记的组蛋白H2A(H2AK119Ub)处的单泛素化赖氨酸119残基(图1b)37。Jarid2与H2AK119Ub的结合可进一步促进PRC 2.2的甲基转移酶活性(图1b)37。
PRC1复合物的亚基比PRC2(图的更加多样化1b中,表1)11,12。根据果蝇的原始发现将PRC1复合物分为两组。规范的PRC1复合物由从果蝇到哺乳动物保守的亚基蛋白组成,而非经典的PRC1复合物的亚基蛋白在果蝇中保守性较低38。在正则和非正则PRC1复合物中都发现了非常有趣的新基因1(RING)和多梳齿无名指(PCGF),这表明这些蛋白质是结构上和功能上必不可少的成分38。RING蛋白表现出2个旁系同源物(RING1A和RING1B),其具有E3泛素连接酶活性当它们与PCGF蛋白(H2AK119Ub活性)(图组合1,表1和2)9,11,12,17,18,19,20,21,38,39。PCGF蛋白表现出六个旁系同源物(PCGF1–PCGF6)20。在与RING蛋白的相互作用,PCGF蛋白可以通过充当辅因子增加泛素连接酶活39,40。每个PCGF旁系同源物(通过PCGF6 PCGF1)可以是(通过PRC 1.6 PRC1.1)不同类型的PRC1复合物的亚基(图1A,表1和2)9,11,12。
在六种不同类型的PRC1配合物(PRC1.1–PRC 1.6)中,含PCGF2(MEL-18)的PRC1.2和含PCGF4(BMI-1)的PRC1.4配合物被归类为规范的PRC1配合物41。染色体盒同源物(CBX)可以与RING蛋白和PCGF2(MEL-18)或PCGF4(BMI-1)形成典型的PRC1复合物(图1a)41。已发现在哺乳动物中有五个CBX旁系同源物(CBX2,CBX4,CBX6,CBX7,CBX8)充当规范的PRC1复合物的亚基(图1a)41。CBX在规范的PRC1复合物中的拟议作用是将PRC1募集到H3K27me3标签,因为CBX蛋白包含可识别PRC2引入的H3K27me3标签的色域(图1a)42,43。此外,polyhomeotic同系物(PHC)和上midleg同系物(SCMH)性别梳可以与核心蛋白(RING和PCGF),以形成规范PRC1复合物(图相互作用 1A,表 1) 44,45。PHC蛋白表现出3个旁系同源物(PHC1-PHC3) 3,7。SCMH蛋白表现出两个旁系同源物(SCMH1和SCMH2) 46。这两种类型的蛋白质包含无菌α基序结构域,使他们能够结合其它规范PRC1复杂蛋白质,参与PRC1招募到染色质(表 1)44,45。PHC蛋白还具有锌指结构域,可促进核酸结合和染色质紧缩[ 46]。
非经典PRC1复合物由多种蛋白亚基(表1)11,12。在非经典PRC1复杂,核心亚基(RING1和PCGF)可与环和YY1结合蛋白(RYBP)或YY1相关因子2(YAF2)或CBX8(表相互作用1通过)ç末端无名指和WD40泛素像(RAWUL)结构域12,47。先前的观察表明,RYBP可以与CBX竞争RING1B 48的结合位点。YAF2和RYBP发生在非经典PRC1以相互排斥的方式复杂,因为YAF2是RYBP(表的同系物1)。
非规范的PRC1复合体的功能明显不同于规范的PRC1复合体(图1)。根据“分层抑制模型”,PRC2可以通过H3K27me3标签抑制目标基因座。规范的PRC1复合物可以通过CBX识别该甲基化标签,并通过引入H2AK119标记进一步抑制目标基因座(图1a)43。最近,发现含有RYBP的非经典PRC1复合物比含有典型的PRC1的PCGF4-RING1B具有更高的E3连接酶活性49。这一发现表明,除了“分层抑制模型”外,还存在另一种转录抑制途径。事实上,KDM2B在PRC1.1复杂的CxxC DNA结合结构域可特异性识别的CpG DNA序列和招募PRC1.1到目标轨迹50,51。然后PRC1.1经由H2AK119ub标签(图抑制特定mRNA的转录1B)50,51。此后,PRC 2.2含JARID2可以特异性识别和结合的H2AK119Ub标签,并进一步通过引入的H3K27me3标签(图修改染色质的结构1b中)37,50,51。该模型被称为“反向分层抑制模型”,因为PRC1.1首先抑制mRNA的特异性转录,而不是PRC2.2。
在果蝇中,通过识别的PRC推定DNA区域已被确定,经过验证的,并命名为PCG / trithorax组响应元件(的PRE)2,3,4,5,6,7。围绕丰富的CpG序列脊椎动物PRE网站的存在也有人认为36,52。然而,哺乳动物PRCs的保守的DNA结合基序以及哺乳动物PRCs识别特定DNA区域的详细机制仍然难以捉摸。由于果蝇PRC2或PRC1的核心亚基不直接结合DNA,因此有人认为果蝇的Pho蛋白可以识别PRE并指导PRC1和PRC2的核心亚基形成PRE。53。在脊椎动物中,Pho同源物YinYang1(YY1)可以结合到保守的DNA区域并与PRC1亚基相互作用 54。因此,YY1可以通过与RYBP或YAF2 55相互作用识别PRE位点并引导非规范的PRC1。
PcG蛋白在免疫调节中的作用
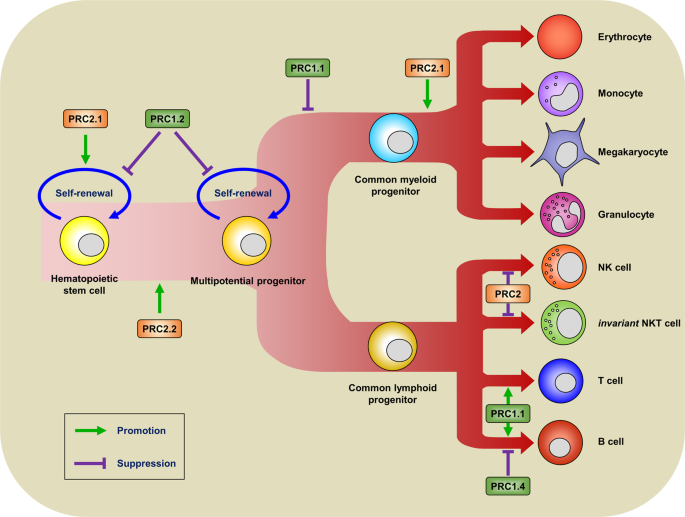
大多数研究已使用敲除(KO)小鼠模型和使用cre-lox系统在条件敲除(cKO)小鼠模型中产生的细胞类型特异性PcG基因缺失来研究PcG蛋白在免疫调节中的功能(表3)56,57,58,59,60,61,62,63,64,65,66,67,68,69,70,71,72,73,74,75,76,77,78,79,80,81,82。除了编码RBBP基因,已生成在编码PRC2的每个核亚基的基因缺陷小鼠和表征(表3)56,57,58,59,60,61,62,63,64,65,66,67,68,69,70,71,72,73,74,75,76,77,78,79,80,81,82。基于动物研究中,EZH1可部分替代EZH2的功能在特定细胞类型83,84。例如,不需要用于在成人骨髓长期造血干细胞(LT-HSC的)的自我更新活动EZH2 64。但是,Ezh1缺陷小鼠由于HSC 56的自我更新活性的明显丧失而表现出免疫缺陷。因为INK4a / Arf基因座,编码可以抑制细胞周期进程的p16INK4a和p19Arf是PcG介导的阻遏的目标,PRC2和规范的PRC1某些核心亚基的缺乏会导致HSC自我更新活性的丧失85。除了EZH1缺乏,PRC2的其它亚基,包括EED或SUZ12的不足,可能会导致造血干细胞的自我更新的活性丧失64,66。PRC1的一些典型亚基,包括BMI-1和PHC1,也可引起造血干细胞的自我更新的活性丧失的不足67,68,75。然而,PRC1的其他经典亚基,包括MEL18,CBX2,CBX8,和PHC2,不影响造血干细胞的自我更新的活动72,76,77,79。由于每个PcG亚基的冗余或旁系同源物,在不同PcG亚基缺陷的每只小鼠中观察到的这些表型变异反映了结构异质性,取决于细胞或组织的特定阶段(表3)。已经提出了各种PRC1和PRC2复合物的细胞类型特异性作用(图2)12。为了支持这些观点,LT-HSCs中的EZH2表达在胚胎第14.5天达到峰值,此后逐渐降低,直到出生后10个月64。然而,从胚胎的14.5天到出生后的10个月,LT-HSC中EZH1的表达逐渐增加64。BMI-1和MEL18表达模式也遵循EZH1 / 2表达范式。BMI-1主要在免疫细胞的特定谱系前体中表达,而MEL-18的表达与成熟的免疫细胞群体相关[ 86]。PcG蛋白除了有助于造血干细胞的自我更新活性外,还参与造血祖细胞(HPC)向免疫细胞特定谱系的分化。表3和图2总结了PRC2和经典PRC1根据“分层抑制模型”对免疫细胞分化的贡献。
关于PcG蛋白在免疫细胞功能中重要性的研究要比对PcG蛋白在免疫细胞分化过程中的影响的研究少得多(表3)。关于PcG蛋白对免疫细胞功能的功能性贡献的大多数研究都集中在T细胞功能上(表3)。使用CD4-Cre或颗粒酶B-Cre系统对Ezh2或Eed进行CD8 + T细胞特异性缺失,发现CD8 + T细胞的抗原特异性活化需要PRC2复合物的功能(表3)61。有趣的是,PcG蛋白对CD4 +的贡献T细胞功能是有争议的,因为每个PcG蛋白缺陷小鼠的表型彼此完全不同。例如,CD4 + T细胞特异性Ezh2缺失通过记忆Th 2细胞的积累,导致2型辅助性T细胞(Th 2)倾向性免疫,这加剧了过敏性疾病(表3)59。然而,Bmi1的和Mel18敲除小鼠是在缺陷的Th 2细胞分化71,73。此外,Bmi1基因敲除小鼠表现出增强的记忆Th 2细胞凋亡69。
当前的RNA序列和染色质免疫沉淀(ChIP)序列数据可用于鉴定PcG蛋白的靶基因座
与RNA-seq和染色质免疫沉淀(ChIP)-seq分析相结合的转基因小鼠的表型分析可能是鉴定PcG蛋白的其他目标基因座或每种PcG蛋白旁系同源蛋白在特定免疫细胞类型中的独特功能的好方法。表4总结了从转基因小鼠的特定细胞类型或遭受PcG功能抑制的特定细胞系生成的当前基因芯片和RNA-seq数据库(http://www.ebi.ac.uk/arrayexpress/)。大多数RNA-seq数据是从胚胎干细胞(ES细胞),HSC(LSK细胞,LSK,Lin - Sca-1 + c-kit +细胞),造血干细胞和祖细胞(HSPC)以及癌细胞系,包括白血病,多发性骨髓瘤,肉瘤,卵巢肿瘤和胃癌细胞系,因为对PcG功能的初步鉴定强调了自我更新活性的维持(表4)。为了扩大差异表达基因(DEG)数据的收集,需要使用多种免疫细胞(包括B细胞,单核细胞,树突状细胞,肥大细胞和多形核细胞)进行RNA-seq分析。在PcG缺陷细胞中鉴定出的所有DEG可能不是PcG蛋白的直接靶标。可能需要芯片序列数据来验证这些DEG是否为PcG蛋白的直接靶标。表5总结了针对特定细胞类型的当前ChIP-seq数据库(http://www.ebi.ac.uk/arrayexpress/)。通过ChIP-seq分析了PRC2的大多数核心亚基(RBBP除外)和PRC1.2的核心亚基(RING1B和MEL18)的DNA结合位点(表5)。还分析了CBX和Jarid2(PRC2.2的一个亚基)的某些旁系同源物的DNA结合位点(表5)。但是,大多数ChIP-seq数据均来自干细胞谱系,仅有少数例外(表5)。因此,需要使用针对其余PcG蛋白(包括RBBP,BMI-1和PHC)的抗体通过Chip-seq分析广泛的细胞,以鉴定被PcG蛋白抑制的新型靶基因。
通过抑制PcG蛋白活性来治疗造血系统恶性肿瘤的治疗剂
由于PcG蛋白的功能对于维持干细胞的自我更新活性很重要,因此PcG蛋白可能充当致癌基因以促进肿瘤发生。为了支持这一想法的,EZH2的高表达已在几个造血系统恶性肿瘤,包括骨髓增生异常综合征,急性髓细胞性白血病,和各种类型的淋巴瘤观察到87,88,89。特别是,小鼠EZH2缺乏症可通过降低白血病的增殖率来抑制白血病的发生90。与这些观察结果一致的是,PRC1的典型的亚单位,包括BMI1,CBX7,CBX8,和RING1A,的表达水平在许多造血肿瘤起源是升高88,91,92。包含转化细胞的 Bmi1缺陷小鼠的小鼠模型也支持BMI1可以在某些造血恶性细胞中充当癌基因的观点 93。但是,由于突变或缺失导致PcG蛋白功能的丧失也可能导致造血系统恶性肿瘤 91。特别地,在PRC2的核心亚基,包括EZH2,EED,和SUZ12缺陷,已经在各种急性淋巴细胞性白血病和骨髓增生异常综合征发现 94,95,96,97。因此,至少PRC2可以起癌基因或抑癌作用,具体取决于所涉及的造血恶性细胞的类型 91。需要进一步研究来确定这些蛋白质在肿瘤发生中的双重功能的机制。
表6总结了应用于造血系统恶性肿瘤和其他类型肿瘤的临床试验中的PcG蛋白抑制剂。主要的抑制剂组靶向EZH酶活性(表6)。大多数经过临床试验的EZH2抑制剂都与SAM竞争与SET结构域的结合98。在EZH的竞争性抑制剂中,tazemetostat(EPZ-6438)是一种口服的小型化学品,已应用于多种恶性细胞类型,包括淋巴瘤,肉瘤,间皮瘤,卵巢癌和晚期实体瘤(表6)98。目前正在临床试验中的其他PcG蛋白抑制剂靶向EED和BMI-1活性(表6)。MAK683是一种变构EED抑制剂,在结合99时会驱动EED的H3K27me3结合口袋中的构象变化。EED中的这些构象变化进一步阻止了EED和EZH2之间的相互作用,从而阻止了H3K27me3 99。PTC596是一种BMI-1抑制剂,可以通过诱导BMI-1 100 N末端的细胞周期蛋白依赖性激酶1介导的双磷酸化来促进BMI-1的降解。
结论与未来展望
在这篇综述中,我们强调了哺乳动物PRC2和PRC1复合物的结构多样性与它们对免疫调节的功能性贡献有关。我们还描述了当前可用的RNA-seq和ChIP-seq数据,可用于挖掘PcG蛋白的新目标基因座。最后,我们列出了目前正在进行临床试验的PcG抑制剂。以前的许多报道表明,PcG蛋白是主要的染色质修饰剂,可以通过影响特定的基因阻抑(主要是使用功能丧失模型)来调节许多生物学过程。
不幸的是,由于PRC复合物募集的许多旁系同源物和辅助蛋白引起的结构异质性,我们仍然不知道自然界中存在多少种不同类型的PRC。我们还不知道每个包含特定旁系同源物亚基的不同PRC如何对特定细胞类型的表型作出贡献。解决这些未知问题可能为PcG介导的基因调控提供新的靶点,并扩大被认为是治疗癌症以外其他人类疾病的治疗靶点的PcG蛋白的范围。
|
|