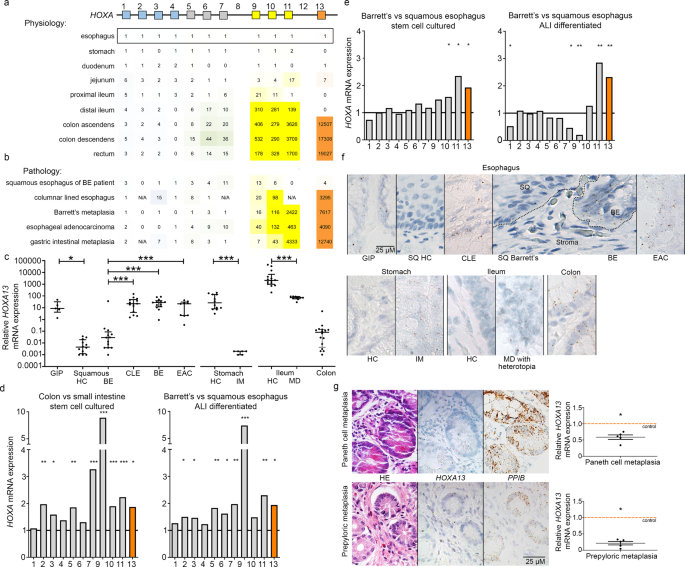
霍克斯 成簇基因在胃肠道中的表达在人和小鼠中呈共线关系。 调查 霍克斯 基因mRNA在小鼠和人胃肠道中的表达,我们观察到与成人和小鼠相似的共线性(图一)。 1A 为人类 霍萨 ,补充图。 1 为所有人 霍克斯 基因与补充图。 2 的图形表示 霍克斯 人群和活检的地点( n =3)和鼠标( n =4)胃肠道。最高层 霍克斯 基因簇在结肠中的表达,除了 HOXC 集群。对于个别的目录,有一个更高的表达式5‘Hoxa/B 上消化道的基因 HOXA 5/B5 继续前进。在所有 霍萨 目录、表示. HOXA 13 是最高的,仅限于结肠(如图所示)。 1A ). HOXA 13 表达受incRNA调控 热尖 ,它位于5‘到 HOXA 13 14 。因此, 热尖 和 HOXA 13 有相似的表达模式(附图)。 1A )。为 霍克斯 ,所有的副命令基因在远端结肠中的表达都增加了,而 HOXC 主要分布在近端和回肠区。因此, 霍克斯 基因的表达与哺乳动物肠道中的位置同源性有关,对于哺乳动物肠道来说,共线性特别强。 Hoxa/B 目录。
图1: 霍萨 聚类基因表达沿成人胃肠道呈共线性,但在Barrett‘s食管(BE)、各种化生细胞和食管腺癌(EAC)中表达减弱。 a 霍萨 聚类基因沿着成人的胃肠道(GI)共同表达。 n =3)。数字代表相对于食管的mrna折叠变化,因此可以在每个食管内进行比较。 霍萨 副戒律成员,但不是他们之间。 b 霍萨 Be患者食管鳞癌中簇基因的表达(英文) n 13),柱状内衬食管(CLE)( n =14),为( n =13),选管会( n 和胃肠上皮化生(IM) n =12)的特征是5‘ 霍萨 基因。数量代表正常人食管的mRNA折叠变化。c HOXA 13 QPCR定量检测胃Be、CLE、IM和胃肠道异型阿片及其相应的生理上皮细胞的表达。鳞状上皮(SQ)Barrett‘s和Be来自同一个人( n =13)。胃入口补片(GIP); n 5);健康对照(HC)鳞状食管( n =12);CLE( n =14) n =13);选管会( n =12);胃( n =14;胃IM( n =12);回肠( n Meckel憩室合并胃异位症(MD)n 和冒号( n =9)。中位数±IQR,* p < 0.05; **p < 0.01; ***p < 0.001. For esophagus, Kruskal–Wallis test with Dunn’s multiple comparisons test (SQ healthy vs. GIP, p =0.015;SQ健康对CLE ,p < 0.0001; SQ healthy vs. BE, p < 0.0001; SQ healthy vs. EAC, p =0.0009)。胃和回肠,曼-惠特尼试验(两尾), p < 0.0001. d 霍萨 聚类基因,特别是5‘ 霍萨 基因包括 HOXA 13 ,在大肠有较高的表达( n =3技术副本)与小肠比较( n =3技术复制),干细胞(左面板)和分化细胞(右面板)。将小肠的mRNA表达设定为1进行正常化。* p < 0.05; **p < 0.01; ***p < 0.001. This figure includes no estimate of variance as the empirical Bayes-moderated two-sided t-statistic was used which does not generate a standard error. e 5‘ 霍萨 在干细胞和气液界面(ALI)分化培养中,Be中的簇基因表达高于鳞状食管。 n =12(BE) 对决 n =2(鳞状食管)在技术上重复显示为干细胞培养和 n =技术副本中ALI差异样本各1份。将mRNA表达定位于食管鳞状细胞,实现正常。* p < 0.05; **p < 0.01; ***p < 0.001. This figure includes no estimate of variance as the empirical Bayes-moderated two-sided t-statistic was used which does not generate a standard error. f 解除管制 HOXA 13 临床标本RNA原位杂交检测胃肠道病理组织中的表达。 HOXA 13 在IM和异位症中表达上调,在结肠幽门和潘氏细胞上皮化生中表达下调。分析每种组织类型的一个样本。 g 下调 HOXA 13 表达(修正肽酰脯氨酸异构酶B-) PPIB 相对于邻近的非化生组织,观察到潘氏细胞化生。 n =5;FC 0.59; p =0.0003)和幽门化生( n =5;FC=0.22; p =0.0001)(下面板)。未配对t检验(两尾)。苏木精和伊红(HE)染色的典型图像, HOXA 13 RNA-范围,和 PPIB 参考基因RNA-范围内的Paneth细胞上皮化生(从结肠)出现在两个腺体的右下角(上面板)和幽门化生(从结肠)在左上两个腺体(中板)。
随后,我们讨论了GIHox编码是否已经存在于GI干细胞阶段,还是仅在分化衍生物形成的情况下才存在的问题。为此,我们使用了Wang等人公开发表的数据。它包含从胃肠道分离出来的人干细胞的mRNA表达,或者作为干细胞培养,或者在气液界面(Ali)中分化。 15 。对这些数据的分析表明 霍克斯 干细胞和ALI细胞的基因表达模式相似。 霍萨 和 B 聚类基因在大肠中的表达明显高于小肠,尤其是5‘。 霍萨 基因包括 HOXA 13 (无花果) 1D 为 霍萨 基因,用于集群 HOXB , C ,和 D 见附图。 3 )。并无明确的规管 HOXC 或 D 在DataSet中可以看到集群,除了 HOXC 10 在大肠。因此, 霍克斯 编码是特定于位置的干细胞的固有特征,并在其衍生物中保持。
HOXA 13 Be、GI异位症与GI癌 由于位置表型与Hox在生理上的状态有关,我们随后对其进行了表征。 霍克斯 在已知的几种化生组织中,mRNA的表达表现为其他肠道部位的形态表型,以及它们的后遗症。正表现出对.的升华 HOXA 10 , 11 ,和 13 ,和 HOXB 6 , 7 , 9 ,和 13 与正常食管相比,qPCR法检测食管组织中mRNA的表达(图1)。 1B 和补充图。 4 ),非常类似于结肠 霍萨 和 B 表达模式。高5‘ 霍萨 基因表达也存在于柱状内衬的食管中,没有杯状细胞(CLE;Be相关条件)、食管腺癌(EAC)和胃IM(见图)。 1B,c )。根据对.的管制作用 热尖 在……上面 HOXA 13 表达,我们发现 热尖 在be中也过表达,并与 HOXA 13 表达模式(附图) 5A-C ). 霍塔 ,一个位于 HOXC 肿瘤进展过程中与染色质重编程相关的簇 16 也被放大(补充图。 5D-f )14 。我们得出结论:BE、EAC和各种具有尾部组织形态学特征的元细胞瘤都有。 霍萨 和 HOXB 典型的尾状胃肠道的表达模式,并伴有 HOXA 13 表达是突出的特征。异欧阿片,即食道近端的胃入口补片和梅克尔憩室的异位症,是一种具有生理形态的组织,但通常位于不同的位置。这两种异鸦片都有丰富的特征。HOXA 13 MRNA表达 1C Meckel憩室上皮上皮化生的方向是前部的,而不是后部的,这表明Meckel憩室的情况是例外。关于Be起源细胞的现有假设之一,即可能产生于具有能够产生多种细胞类型的祖细胞的细胞。17 。为了研究Be中Hox基因的异常表达是否是在上皮特异性干细胞的水平上建立的,我们询问了Yamamoto等人的公开资料。 15 ,18 霍克斯 获取食管鳞状细胞和BE干细胞及其各自的ALI分化衍生物的基因表达模式。Hox基因在这些地方的干细胞培养物中的表达类似于ALI分化的干细胞(图1)。 1E ,补充图。 3 )。在Be干细胞中,5‘的上调 霍萨 基因(图1. 1E )以及 HOXB 6 , 7 , 13 ,和 HOXC 10 见(附图)。 3 ),达到与在结肠中观察到的水平相似的水平。因此,与BE相关的另一种Hox编码是在上皮特异性干细胞水平上建立的,并在所涉干细胞的衍生物中保持。
根据共线性理论,与前类组成员相比,13组成员更有可能呈现BE中所见的远端特征。 19 。第13组成员中, HOXA 13 和 HOXB 13 在be中被过度表达,与 HOXA 13 表现出比 HOXB 13 在BE,EAC和IM的胃(补充图。 4 )。因此,虽然Hox基因,如 HOXA 11,B6,B9 ,和 B13 也是潜在的有趣的候选人,这里我们选择的重点是 HOXA 13 用于进一步深入分析不同化生组织的基因。AS免疫组织化学 HOXA 13 未成功,(检测了两种抗HOXA 13抗体,但缺乏特异性),我们采用原位杂交(ISH)方法。 HOXA 13 进一步证实该基因在不同组织中的非典型表达(如图所示)。 1F) 。化生在整个胃肠道都有发现。而BE和IM则具有更远的表型,位于远端的结肠幽门和潘氏细胞化生,与炎症性肠病有关,具有更多的鼻端表型。 20 。因此,下调对.的管制 HOXA 13 表达式(更正为 PPIB 作为参考基因表达)相关的邻近非化生组织,可见这些组织(图)。 1g ,再次支持 HOXA 13 在位置身份上)。
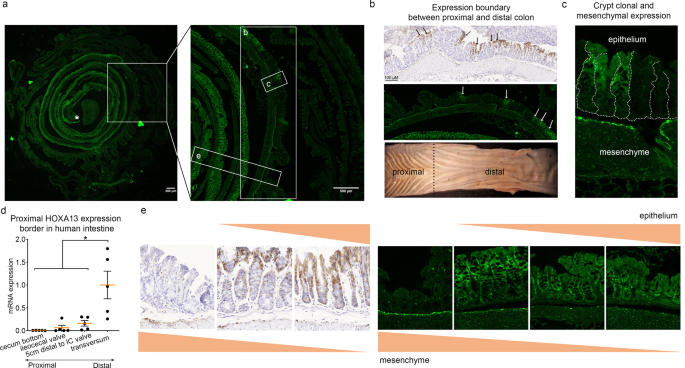
二进制调节 HOXA 13 表达 为了更详细地研究健康胃肠道中哪些细胞表达hoxa 13,我们采用了内源性小鼠模型。 霍萨13 启动子驱动Hoxa13-GFP融合蛋白的表达。在上皮室内,近端表达边界位于从远端到近端结肠的过渡处,如荧光图像和抗GFP IHC染色所见(如图所示)。 2A,b 和补充图。 6A-d 获取更大的概览图像)。这个近端的表达边界似乎是克隆性的,有些隐窝表达Hoxa 13,而另一些则没有(见图中的箭头)。 2B 在图中特写。 2C )。这种克隆性的功能后果尚不清楚,虽然超出了本手稿的范围,但却提出了一个有趣的生物学问题。远端Hoxa 13-GFP的表达受肛门鳞状体尺交界处的限制(SCJ;附图)。 6E 请注意,这一点在图中是不能理解的。 2A ,因为这部分是为这只老鼠损坏的)。为了研究人类是否也存在Hoxa 13表达的这些局部梯度, HOXA 13 在另一组来自不同结肠部位的活检标本中,用qPCR方法检测mRNA的表达。盲肠活检 HOXA 13 否定,而 HOXA 13 从回盲瓣到远端横结肠的表达增加,表现出与小鼠相似的表达模式(如图所示)。 二维空间 ).
图2:小鼠和人类 HOXA 13 表达式在冒号中受到严格的空间控制。 a 一个典型的例子来自3只小鼠的“瑞士卷”结构的大肠Hoxa13-GFP杂合子小鼠模型。星号表示上皮的最远端部分。嵌体的放大显示在面板上。 b , c 和 e . b 生理Hoxa 13在成年小鼠中表达的近端边界呈片状分布,位于结肠近端和远端之间,以底部面板上的黑色虚线(打开的小鼠结肠的宏观图像)表示。有代表性的抗GFP,IHC和共焦显微镜的图像。箭头表示在Hoxa 13阴性地穴中Hoxa 13阳性的地穴。 c Hoxa 13的表达为隐窝克隆。这是观察到的 n =1。 d 成人盲肠底部为阴性 HOXA 13 而积极情绪则会大幅增加( n =5个独立样本)。平均±扫描电镜* p < 0.05, repeated measures ANOVA with Holm-Šídák’s multiple comparisons test, p =0.001。 HOXA 13 横结肠中mRNA水平正常。 e Hoxa 13的表达沿着基底-腔轴受到严格的调控。在远端,Hoxa 13沿结肠隐窝的整个下腔轴表达,近端仅在腔侧表达。此外,间充质在上皮下的细胞中有表达,主要在近端结肠。显示了反GFP、IHC和共焦图像。
除了沿着胃肠道的Hoxa 13梯度,上皮性Hoxa 13-gfp的表达也在单个隐窝的基底腔轴上受到严格的调控。近端仅见根尖表达,而远端Hoxa 13-gfp沿地穴的整个下腔轴表达(图1)。2E )。此外,间充质在近端结肠上皮下的细胞中也有表达(如图所示)。 2E )。在细胞内,最强烈的信号与细胞核共定位,正如预期的那样,但细胞质染色也可以用核糖体合成来解释。 2E ).
我们的结论是,HOXA 13表达的空间调控是非常精确、稳健和结肠特异性的,这就提出了在BE中观察到HOXA 13表达的细胞起源的问题。
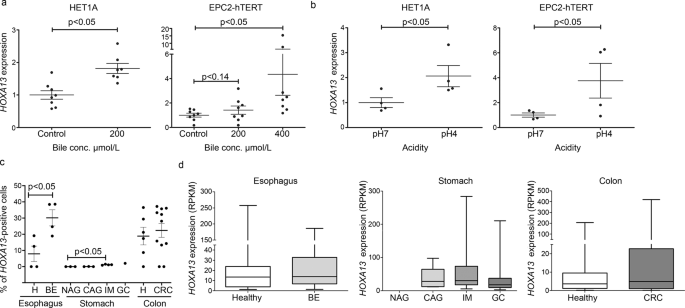
个人Hoxa 13/HOXA 13 -上消化道阳性细胞 无显著表达 HOXA 13 应用qPCR技术检测BE患者食管鳞状细胞中mRNA的表达(见图)。 1C,e ),暗示GERD不会引起 HOXA 13 表达本身。事实上,当两株永生化的食管鳞状细胞(EPC2-hTERT和het-1A)暴露在胆汁酸或胆汁酸中时,只有轻微的作用。 HOXA 13 观察到两到四倍的低基线表达;如图所示。 3A,b ),与细胞的相对高度一致。 HOXA 13 表现出更好的生存治疗,而不是提高表达本身。对欧文等人最近公布的可公开获得的单细胞RNAseq数据库的分析证实了这一点。 21 。单细胞水平的结果显示, HOXA 13 -Be患者正常食管组织中阳性细胞(8%)。在BE组织中,这些HOXA 13阳性细胞的百分比增加到30%,但它们的个体。HOXA 13 与正常食管的HOXA 13表达细胞相比,mRNA水平没有增加。 3C,d )。同样, HOXA 13 -阳性细胞,但不是阳性细胞 HOXA 13 表达 每 细胞,在胃、早期胃癌和结直肠癌的IM中增加(如图所示)。 3C,d )。因此,我们进一步研究了Hoxa 13在我们的样本细胞水平。尽管 HOXA 13 在上消化道4只小鼠中,只有1只在Q-PCR中检测到mRNA的表达. 2 )用免疫组织化学方法检测Hoxa 13-GFP小鼠胃中单个Hoxa 13阳性细胞。这种信号从GEJ开始出现在胃的基底外侧,但在沿食管的鳞状细胞和间质中未见(图1)。 4A 和补充图。 7 )。这是特别令人感兴趣的,因为GEJ被认为是Be的起源地。 17 。少量Hoxa 13-GFP阴性无阳性(补充图)。 6d ,补充图。 7D )。后来,我们雇用了ISH HOXA 13 3例成人GEJ手术标本分析 HOXA 13 -在人上消化道表达细胞。在这三个样本中,ge连接区都含有一个清晰的阳性信号。 HOXA 13 MRNA,部分信号在胃近端细胞,而在鳞状上皮和间质细胞中信号更低(见图)。 4B 和补充图。 8a,b )。食管黏膜下腺体(ESMG) 21 存在于一个样本中 HOXA 13 阳性(图1. 4C )。有趣的是,ESMG对 KRT 7 + KR5 + TP 63 + 细胞(在GEJ中被假定为原产细胞) 22 )虽然与HOXA 13不同 + 细胞, KRT 7 + KR5 + TP 63 + 胃内未发现三重阳性细胞。 4D )。(请注意,这是为一个样本显示的,我们无法评估可能的可能性。) HOXA 13 由于缺乏特异性HOXA 13抗体,与这些三重阳性细胞共表达。我们还研究了 HOXA 13 3例17~20周龄自然流产胎儿GEJ表达,以食管上皮由柱状向鳞状表型转变为妊娠期。我们观察到高度和特异性 HOXA 13 贲门部表达较少,远端胃及食管上皮较少阳性。 4E ,补充图。 8C,d )。这些数据表明 HOXA 13 -人类胚胎食管在上皮过渡期存在阳性细胞,成人鳞状食管中阳性细胞减少,而BE则再次增加。因此,人和小鼠成人上消化道的上皮细胞,特别是人类的GEJ和ESMGs,其特征是存在以下几个亚群体: HOXA 13/ Hoxa 13阳性细胞 HOXA 13/ Hoxa 13负环境。
图3: HOXA 13 +细胞而非细胞表达水平与化生有关。 接触胆汁(pH值为7)( a )或酸性( b ),在胃食管反流病(GERD)的两个离体模型系统中,轻微诱导胃食管反流病(GERD)的表达 HOXA 13 在两个原发性永生化食管细胞系中的低水平表达。误差条表示平均值的95%CI。 n =4项独立实验。对于Het1a,双尾 t -使用测试( p =0.0096 a, p =0.0322(B),对于EPC2-hTERT Dunn的多重比较测试,a(对照对200 M, p >0.99;控制对400 M, p =0.0112;200 M对400 M, p =0.14),单尾 t -测试 b , p =0.0486。 c .的数目 HOXA 13 -Barrett食管(BE)和肠上皮化生(IM)的阳性细胞较正常食管或胃组织增加。健康和BE食管样本都是从同样的病人身上提取的。平均±扫描电镜显示。 n =4人为食管,n =3表示NAG,CAG, n =4对IM, n =1表示GC, n 健康结肠=6, n =11代表“儿童权利公约”。图表是基于对单细胞RNA数据的分析。 21 、GSE 134520 82 ,GSE 81861 83 。双尾 t -食道试验 p =0.0443)和冒号( p 0.6808),用邓尼特多重比较检验法对胃进行单因素方差分析(P<0.01)。 p < 0.0001). d HOXA 13 每个单元格的表达式级别不变。表示级别 HOXA 13 + 只有细胞。 H 健康, 成 巴雷特的食道 唠叨 非萎缩性胃炎, CAG 慢性萎缩性胃炎, 我 胃肠上皮化生, 气相色谱 早期胃癌 启联 结直肠癌。 n =37对H, n =132表示Be,NA表示NAG, n =CAG=5, n =163对IM, n =69表示GC, n 健康结肠=37, n =87来自(C)中提到的个人的单个细胞的CRC。对于GC,统计数据不显示为每个病人没有提供数据。中间线为正中线,上下铰链对应第25至75百分位数,晶须代表最小最大值。
图4:HOXA 13在上消化道的表达。 a 胃食管结合部Hoxa 13-GFP杂合子小鼠抗GFP免疫组化代表例(SQ;鳞状上皮,ST;胃) n =3)。Hoxa 13从GEJ(5-6)开始在胃单个细胞中表达,在食管和间质(1-4)中缺失。 b HOXA 13 RISH在具有代表性的示例中的表达 n 3与成人GEJ相似,放大板为:a-食管,B-GEJ区,C-近端胃。橙色圆圈表示概览图像中的正信号。 c HOXA 13 RNA ISH检测人食管粘膜下腺体(ESMG)的表达,放大板为:a-H&E,C,D-ESMG,B,E-鳞状食管。 n =1。 d 在ESMG中发现角蛋白7(KRT 7)、角蛋白5(Krt 5)和p63三重阳性细胞。 n =1。 e 一个具有代表性的17周龄胎儿GEJ的例子综述:a)食管远端分层食管上皮(蓝色),B)GEJ区,C)近端胃上皮(粉红色), n =3。
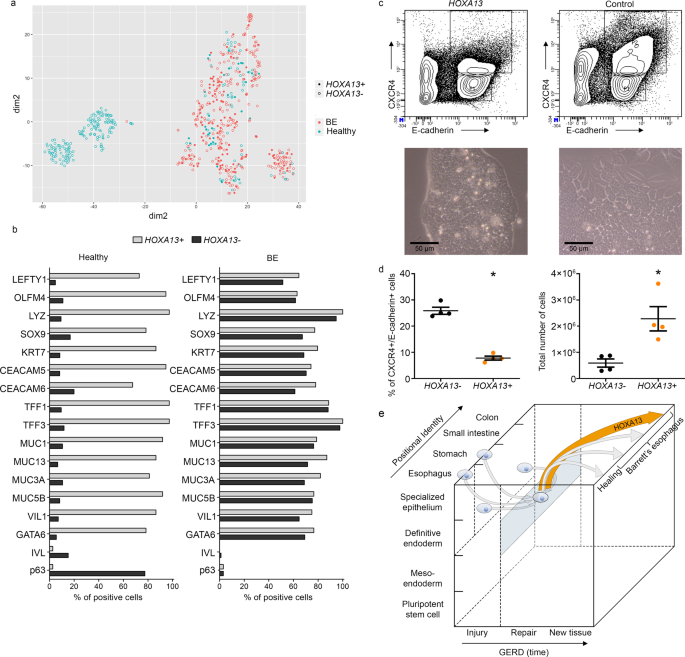
HOXA 13 影响分化潜能和后验 在确定单个HOXA 13阳性细胞存在于生理上消化道,并在BE组织中增强后,我们接下来将开始研究这一群体细胞在BE病因中的潜在作用。为此,我们进一步分析了单细胞rna-seq。21 上述数据集。在这项研究中,没有对GEJ进行抽样分析。然而,8%的正常食管细胞表达 HOXA 13 从t分布的随机邻接嵌入(t-SNE)图中可以看出,Be组织中的细胞与转录重叠。 5A )。基因表达分析表明,这些细胞来源于ESMG。 5B 和补充数据 1 )21 ,23 。具体而言,与 HOXA 13 -阴性细胞人口,占人口总数的70%以上 HOXA 13 -正常鳞状黏膜的阳性细胞为黏膜下标记物。 LEFTY 1 和 Olfm 4 ,被指定为esmg标记,也被描述为be祖细胞的标记。 21 。此外, HOXA 13 -阳性细胞表达粘膜标记物 TFF 3 , 利兹 和 SOX 9 ,以及柱状标记和BE标记 TFF 1、KRT 7、VIL 1、MUC5B、MUC3A、MUC 13、MUC 1 ,和 CEACAM 5 ,而角化标记阴性 IVL 和基底上皮细胞标记物 P63 (无花果) 5B 和补充数据 1 的基因列表 HOXA 13 -阳性细胞)。在BE中,这些柱状标记和导管标记阳性细胞的百分比在 HOXA 13 -阴性群体,这意味着在分化过程中,有些细胞可能会失去 HOXA 13 表达,或者说有不止一个群体产生组织。这将与小鼠数据一致,因为小鼠食道缺乏ESMGS和Hoxa 13阳性细胞。有趣的是,虽然在此数据集中很少见,但在 TFF 3 + 四组细胞均为三倍阳性。 KRT 14 (基因对) Krt 5 ), TP 63 和 KRT 7 21 但这些都不是积极的 HOXA 13 .
图5:HOXA 13细胞表达调控细胞命运。 a HOXA 13 + T分布随机近邻包埋正常食管细胞与BE细胞 (t-SNE) 基于单细胞RNA表达谱的作图 21 b 对单细胞RNA seq数据的分析表明,与 HOXA 13 − 细胞, HOXA 13 + 细胞表达黏膜下腺体标记物、Barrett食管标记物(BE),降低正常食管鳞状细胞标记物(p63、IVL)的表达。在BE中没有观察到这种差异。 n =846个HOXA 13 − 健康食道中的细胞, n =37 HOXA 13 + 在健康的食道, n =263 HOXA 13 − Be中的细胞, n =132 HOXA 13 + 细胞进入Be。 c HOXA 13- 过度表达的内胚层对终末分化具有相对的抵抗力。小鼠胚胎干细胞(MESC) HOXA 13 表达从多能干细胞分化为确定性内胚层。分化的最终内胚层细胞的百分比,定义为CXCR 4。 + /E-钙粘蛋白 + 细胞,用流式细胞仪分析(上板)。下面的面板(典型的光学显微镜图像)显示了不同培养物的形态差异。 HOXA 13 MESCs在分化为确定的内胚层时过度表达和野生型mESCs,诱导细胞层变平,有较大和不规则的形状细胞。 d 对FACS分析结果的量化结果表明,CXCR 4所占的百分比 + /E-钙粘蛋白 + 细胞减少 HOXA 13 -在分化条件下过度表达细胞培养物( p < 0.0001). HOXA 13- 在分化过程中,表达细胞的扩张速度比对照细胞快(细胞总数增加) p =0.0135)。平均±扫描电镜* p < 0.001, n =4个独立实验, t -试验(二尾)。 e Be发展中的细胞同一性模型。这个 X 轴代表接触GERD诱导剂后的时间(假设单位)。 Y 轴在胚胎学和病理过程中表现出分化。 Z -轴指示胃肠道组织的位置同一性。关于BE的起源细胞有几种理论:它们可能是完全分化的食管或胃细胞,也可能是这些器官内较少分化的细胞(由这些器官上的4个细胞描述)。 Y-Z 飞机)。无论其位置或分化状态如何,这一细胞或起源可能失去其正确的位置身份或保持其异常的位置身份,并类似于一个明确的内胚层样细胞。这是可视化的蓝色矩形隐藏的细胞与更厚的蓝色轮廓。对于BE中的细胞身份模型,我们的数据表明 HOXA 13 在GEJ中表达克隆(用橙色描述)可能会超过克隆与另一个位置的同一性,从而为在BE中观察到的远端表型提供了一个解释。
起源于BE段形成的细胞应该能够产生各种分化的细胞类型,表现为结肠、胃、胰腺腺泡或其他表型。 24 ,25 。在小鸡胚胎中, HOXA 13 调整发展1.5天后的区域化,显示 HOXA 13 在早期分化中,这一基因对这类多能祖细胞的细胞表型的影响是一致的。 26 。为了在实验上测试.的影响. HOXA 13 关于细胞命运,我们 HOXA 13 -诱导性多能小鼠胚胎干细胞(MESCs)。通过CXCR 4和E-cadherin的膜表达,可以将这些多能mESCs有效地分化为多能的最终内胚层。 5C )。RNAseq进一步证实了这一点,显示出明确的内胚层标记有很强的上调作用,例如 Sox 17 和 FOXA 1 在这些分化的细胞中,同时多能标记,如 奈诺 被下调(见补充表) 1 )。利用独创性途径分析(IPA)进一步分析不同表达基因,发现与“胚胎细胞分化”呈正相关。 z =1.82, p =6.38×10 −15 )。有趣的是,当 HOXA 13 诱导表达,CXCR 4测定的细胞向确定内胚层分化的效率较低。 + /E-钙粘蛋白 + 表达和形态学评估(图。 5C,d )。与减少的单边分化一致,克隆表达 HOXA 13 显示了更大的扩张(图)。 5D ).
接下来我们比较了无分化多能体的转录组。 HOXA 13- 过表达和控制培养物以识别潜在的分子中介物 HOXA 13 观察到的效果。差异基因表达的ipa分析结果与 HOXA 13 赋予多能表型。特别是,强迫 HOXA 13 表达导致“的作用”的提升。 奈诺 哺乳动物胚胎细胞多能性“类别( z =1.34, p =2.32×10 −3 ),一种涉及 SOX 2 , 奈诺 , TBX 3 , Hesx-1 ,和 DPPA- 其中1人 27 ,28 (见表 1 有关更多详细信息/结果,请折叠更改,以及 q -与这项试验有关的价值观)。 HOXA 13 表达似乎也下调了wnt信号,可能是通过bmp信号。 29 。众所周知,Wnt信号可以促进中胚层的分化。 30 ,这些结果与 HOXA 13 -介导Wnt信号在轴向伸长过程中的下调 31 。因此,由 HOXA 13 与维持相对多能表型是一致的,这反过来又会增加室间隔的扩张。
表1的变化和Q值的mRNAs提到的结果一节的主要文本有关的细胞培养模型分析的RNA-Seq。 HOXA 13 表达并不能完全阻断mESC细胞的内胚层分化,提示mESC的作用是 HOXA 13 在这个隔间里仍然是相关的。明确内胚层是整个胃肠道上皮的一个特征,不能区分上、下消化道上皮本身。调查.的作用 HOXA 13 在这个细胞室里测试我们的预测 HOXA 13 表达使内胚层易于获得远端表型,我们对CXCR 4进行了分类。 + /E-钙粘蛋白 + 细胞 HOXA 13 阳性和阴性培养并比较其mRNA表达。 HOXA 13 上调与确定内胚层细胞形态学有关的基因表达。在IPA分析中,“肌动蛋白细胞骨架信号”被激活最多( z =3.00, p =3.74×10 −2 )。“RhoA信号”,刺激肌动蛋白聚合,( z =2.12, p =1.12×10 −2 )也受到刺激。 HOXA 13 通过微绒毛相关基因的上调来支持远端上皮功能, 埃兹尔 和 维尔 角蛋白 Krt 19 和 20克朗 ,河豚网络基因, IgG 8 ,以及外分泌功能相关基因,如 Gcnt 3 ,通常在胃肠道远端上皮中表达。 32 。此外,还有更多“癌细胞增殖”的转录本( z =1.13, p =1.5×10 −6 )和“癌细胞瘤”( z =1.13, p =2.22×10 −4 )类别,例如 FGFR 2 和 内克2 ,被检测到。因此,强迫 HOXA 13 内胚层分化过程中的表达支持尾状上皮功能和增殖潜能(见表)。 1 对于折叠变化和 q -数值;见补充数据 2 其他相关分子)。
总的来说,这些数据与 HOXA 13 -表现出祖细胞表型并具有竞争优势的表达细胞,同时驱动获得一种更远的柱状表型,一旦致力于分化(见图1)。 5E ).
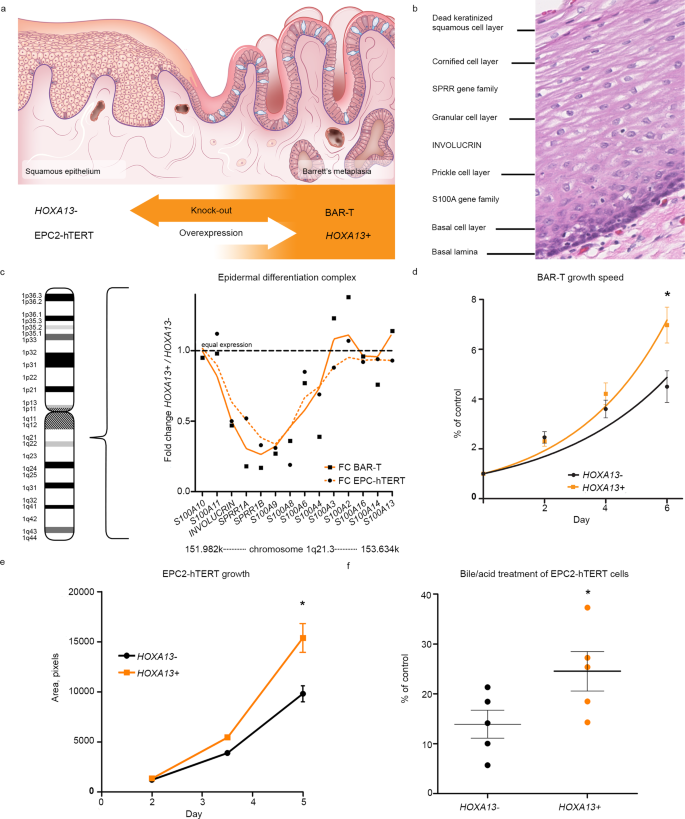
HOXA 13 与1号染色体表皮分化复合体 进一步支持 HOXA 13 在食管鳞状表型丢失和尾柱型的出现中,我们通过实验研究了其对食管鳞状细胞表型和尾状柱状表型的影响。 HOXA 13 直接出现在食管细胞模型上。为此,我们使用crispr-ca9技术删除。 HOXA 13 一种来源于BE患者化生组织的原发单克隆永生化细胞系,其细胞同时表达柱状和鳞状标记。 33 。三分 HOXA 13 为了规避潜在的目标效应,选择了敲除克隆。相反,我们引发了慢病毒 HOXA 13 EPC2-hTERT在永生化食管鳞状细胞株EPC2-hTERT中的表达。对于这些后期的实验,我们使用混合细胞群的慢病毒转导细胞,以避免克隆伪影影响结果。在这两个模型的转录(图。 6A )与各自的控制线进行对比。在基因组中有大量的重叠,主要受损失的影响。 HOXA 13 在bar-T中,与那些受 HOXA 13 在EPC2-hTERT中,考虑到监管的方向(X) 2 测试: p =4.74×10 −34 )(见补充数据 3 )。对这两个技术上独立生成的数据集的重叠调查限制了偶然发现或单一模型系统偏差的发生率。重叠基因 HOXA 13 在食管细胞中的表达 IL7r , FAM196B , ADAMTS 6 , NRG 1 , LTBP 1 , 日航1 , ELL 2,Smad 7 , C12ORF75 , 阿克塞尔 , TIPARP , IKBIP , DUSP 7 ,和 GOLIM 4 。被 HOXA 13 表达 SERPINB 13 , MYO5C , KLK 7 , ANXA 9 , TMPRSS 4 , TTC 9 , MATN 2 , TNFAIP 2 , RAB27B , HCAR 2,C6ORF 132 , EXPH 5 , MAP3K5 ,和 FUCA 1 。IPA分析结果预测“(恶性)细胞转化”( z =2.00, p =5.81×10 −3 )和减少“器官炎症”( z =−2.59, p =8.29×10 −3 基因功能在补充数据中被描述 3 )在细胞中表达。 HOXA 13 。有趣的是, HOXA 13 抑制表皮分化复合体(EDC); 6B,c )。EDC位于1q21.3染色体上,包含与分层鳞状上皮细胞角质层形成相关的多基因簇,如S 100和小脯氨酸区(Sprr)基因。 34 。在这两种细胞模型中重叠的下调基因中, ANXA 9 也与分化角质形成细胞有关。 35 ,和 EVPL , SCEL ,和 KLK 7 被修饰的包膜基因 36 ,37 ,38 EMP 1 和 SERPINB 13 下调与胃癌的严重程度有关( EMP 1 )和头颈部鳞状细胞癌(SCC) SERPINB 13 )39 ,40 。见表 1 对于折叠变化和 q -价值和补充数据 3 以获得更多与形态学相关的差异表达的分子。已知对维持鳞状表型至关重要的基因区域的下调为改变这种观念提供了机械支持。 HOXA 13 表达是激发Be表型的基础。
图6: HOXA 13 对抗鳞状组织,促进食管细胞的生长。 a 构造了两个模型来研究 HOXA 13 在胃食管交界处(GEJ)。一种模型采用EPC2-hTERT,这是一种原发性永生化的人食管鳞状细胞株,其特点是低。 HOXA 13 表达,其中 HOXA 13 被换上了。第二种模型采用的是Barrett‘s食管(BE)细胞株Barrett’s原代永生化细胞系bar-T,其特征是高度。 HOXA 13 表达,其中 HOXA 13 被击倒了。 b 一例患者食管鳞状细胞的苏木精和伊红(H&E)染色,未显示某些Ch1q21.3表皮分化复合体产物的预期位置,也未显示表皮角质层的其他基因。 c HOXA 13 在这两个模型系统中,Ch1q21.3表皮分化复合物中的基因被下调。三次样条拟合 HOXA 13 用bar-T控制的转导细胞株与其比较,显示了mRNA的调节作用。 HOXA 13 击倒对手,和 HOXA 13 与亲本相比,EPC2-hTERT细胞高表达. FC 折叠零钱。 d HOXA 13 MTT法测定,Be细胞中的敲除可降低细胞池的生长。平均±扫描电镜* p < 0.05, exact p =0.0204,双尾 t -测试, n =9项独立实验。 e HOXA 13 EPC2-hTERT细胞在三维培养(球体面积,平均±扫描电镜,*)中的过表达促进了细胞的生长。 p < 0.05, p =0.0174,双向方差分析与西达克的多重比较检验)。 f EPC2-hTERT细胞 HOXA 13 过度表达对胆汁酸暴露不太敏感( p =0.0343)。MTT数据显示为相应的车辆处理的对照%。平均±扫描电镜* p < 0.05, t -试验(二尾)。
这些实验也为以下观点提供了机械支持: HOXA 13 表达式可以解释为什么Be容易发展到EAC。 HOXA 13 介导edc的下调,许多edc和corniated包膜基因在be to eac级联过程中被逐渐下调。 36 ,41 。在BE、EAC和食管SCC中,EDC杂合性丢失(LOH)是常见的。 42 ,43 ,44 。EDC基因低表达可预测化疗无效,EDC的LOH与早期治疗的EAC患者的生存率降低有关。 43 ,45 。在我们的实验模型中,我们观察到 HOXA 13 -介导Notch信号相关基因的上调,特别是 DLL 1 , 呋喃 ,和 日航1 。Notch信号与恶性转化相关 46 ,47 。在IPA分析中“非黑色素瘤实体瘤”( z =2.03, p =9.28×10 −8 )和“细胞入侵”( z =2.08, p =2.47×10 −3 )被证明是被激活的。 HOXA 13 ,鉴于 HOXA 13 表达对“凋亡”有负面影响( z =−1.5 2, p =2.23×10 −3 )和“杀死细胞”( z =−2.03, p =2.03×10 −3 3 ).
最后,使用 HOXA 13 在Barrett‘s和鳞状细胞中的敲除和过度表达,我们证明 HOXA 13 下调上皮分化复合体等角膜内皮基因,维持鳞状上皮细胞的形态,发挥抑癌基因的作用。此外,Notch信号被过度表达,许多单个基因在原癌方向上表现出差异调节。
HOXA 13 支持柱状表型并提供增殖优势 建立了转录效应 HOXA 13 在bar-T和EPC2-hTERT细胞上,我们接下来研究了 HOXA 13 在这些细胞里。就像mESCs一样, HOXA 13 表达显著提高食管细胞的生长速度。对于bar-T细胞来说,这是一种增殖优势。 HOXA 13 在2D培养中有表达(如图所示)。 6d ),而对EPC2-hTERT而言, HOXA 13 在三维培养条件下,细胞生长的表达更为明显。 6E )。此外, HOXA 13 表达降低角质形成细胞对胆汁酸暴露的敏感性(如图所示)。 6f ),与以下概念一致: HOXA 13 在类似GERD的条件下给予细胞保护。
进一步了解…的作用 HOXA 13 在细胞形态和组织方面,我们利用EPC2-hTERT细胞可以在三维球体培养中分化,并在球体中间形成更加扁平的细胞学组织和高表达角蛋白等角化标记物的事实,类似于食管分层上皮(见图1)。 7A 分化形态的顶部面板) 48 。过度表达 HOXA 13 ,EPC2-hTERT球状体在保持较低分化表型的同时增大(未分化形态图)。 7A 底部面板)。对这些形态状态的量化表明,在对照组培养中,80%的球体达到分层的上皮表型,而HOXA 13的过度表达则使这一数目减少到28.6%( p < 0.05, Fig. 7b 左面板)。以雪莲为角化标志的染色进一步证实了这一点,表明其在球体中的表达减少。 HOXA 13- 高表达EPC-hTERT细胞( p < 0.05, Fig. 7b 右面板)。因此,在原发性永生化食管细胞中 HOXA 13 过度表达可以减少角质化。
图7: HOXA 13 支持肠型柱状上皮分化。 HOXA 13 过表达会影响EPC2-hTERT球体的鳞状分化,如有代表性的图片( a )和基于苏木精和伊红(H&E)或抗雪莲(IVL)免疫组织化学(IHC)的形态学定量评估( p =0.0086)。( b )。中间带四分位数范围,* p < 0.05, Mann–Whitney test (two-tailed). c HOXA 13 敲除(KO)影响条形T细胞的空间分布.平均±扫描电镜* p < 0.001, p =0.0001, t -试验(二尾)。 e 柱状和混合的bar-T上皮的长度 HOXA 13 大鼠气管KO活体组织重建模型。平均±扫描电镜* p < 0.05, exact p =0.0439。 d 典型的H&E,PAS染色,抗IVLIHC从大鼠气管组织重建模型的bar-T上皮。H&E染色显示移植动物体内有更多的细胞层。 HOXA 13 + 野生型细胞。周期性酸性希夫(PAS)染色多囊糖类分子,且阳性是杯状细胞的标志.箭头指向PAS正性,它存在于右侧面板中,而不在左侧面板中,其中bar-T HOXA 13 − 细胞显示。IVL染色在左侧组的形态鳞状细胞中较强,而在左侧组中较弱。 HOXA 13 + 上皮( n =3 霍萨 − 和 n =5 HOXA 13 + ). f HOXA 13 − 和 HOXA 13 + 条形T型细胞培养系统的H&E染色、PAS染色和IVL IHC的代表图片表明: HOXA 13 KO将柱状上皮表型向鳞状角质化上皮( n =1项独立实验)。
我们进一步研究了HOXA 13在Be衍生的bar-T细胞中的形态学作用。在2D培养中,观察到细胞在生长模式上的空间分布变化,在没有HOXA 13的情况下,细胞更紧密地生长在一起,这表明对组织形态有影响(图1)。 7C )。条形T细胞模型还允许测试 HOXA 13 论柱状 对决 鳞状细胞分化在体外和体内的设置。采用体内三维组织重建模型,将条状T细胞移植到失活、剥脱的大鼠气管腔内,植入NOSCID小鼠体内。在这些条件下,亲本未转染的bar-T细胞从同一克隆中产生肠型柱状上皮和复层鳞状上皮。因此,该细胞系有可能产生两种形态不同的上皮细胞。 33 ,49 (无花果) 7E 和补充图。 9 )。因此,模型中的上皮细胞发现自己处于两种形态之间的临界点上。这一特点使得活体组织重建模型适合于研究形态学调节剂的影响,即显示调节剂是否偏向肠型柱状上皮或复层鳞状上皮。研究 HOXA 13 敲出,提出了两个重要的观察。首先, HOXA 13 敲除会减少柱状上皮的长度,柱状上皮含有PAS阳性细胞,而雪莲蛋白阴性(见图)。 7E 、f)。因此,损失 HOXA 13 对抗肠型柱状上皮的增殖,而复层鳞状上皮增生仍然存在。第二, HOXA 13 从上皮层的厚度推断,敲除一般会损害上皮细胞的增殖(如图所示)。 7D ;补充图。 9B )。这些细胞系的2D有机型ALI体外培养证实了体内研究结果。 HOXA 13 将bar-T上皮细胞重排至鳞状角化分化上皮(图1)。 7F )。最后, HOXA 13 支持肠型柱状上皮分化和Barrett‘s上皮的增殖,证实了以下观点: HOXA 13 表达既能调节竞争优势,又能调节柱状表型形成的倾向。